芍药甘草汤对大鼠酒精性胃溃疡的保护作用及其可能机制研究*
2023-07-04上海市徐汇区中心医院
上海市徐汇区中心医院
杨黎娜 王 君△ 王 爽△△(上海 200030)
提要 目的:本研究旨在评估芍药甘草汤(SGD)对大鼠酒精性胃溃疡(GU)的保护作用及其可能机制,以期为临床治疗提供参考。方法:采用单次灌胃10 mL/kg 75%乙醇建立大鼠胃溃疡模型,对胃组织进行组织病理学检查。用双抗体夹心法测定胃组织中肿瘤坏死因子-α(TNF-α)、表皮生长因子(EGF)、前列腺素E2(PGE2)、超氧化物歧化酶(SOD)和血浆硫代巴比妥酸反应物质(TBARS)水平。应用网络药理学研究方法,进一步研究SGD治疗GU的可能机制。结果:组织学特征显示,酒精性GU大鼠的胃组织在整个胃黏膜层均有明显的损伤,而SGD治疗组大鼠的胃黏膜损伤明显减轻。标志物检测显示,SGD(9.90 g/kg)组和SGD(19.80 g/kg)组TNF-α的水平显著下降(分别为模型组的87.17%和86.50%,P<0.01)。SGD(9.90 g/kg)组和SGD (19.80 g/kg)组PGE2水平均显著高于模型组(分别为模型组的172.40%和220.86%,P<0.01)。与模型组比较,SGD(19.80 g/kg)组SOD水平均显著升高(为模型组的162.13%,P<0.01)。而在脂质过氧化方面,SGD(9.90 g/kg)组、SGD(19.80 g/kg)组TBARS水平显著下降(分别为模型组的78.66%、71.83%,P<0.01)。结论:SGD对乙醇所致GU有改善作用。此外,本研究还揭示了SGD治疗GU的多组分、多靶点、多途径的特点,为进一步的药物开发研究提供了基础。
胃溃疡(GU)是影响消化系统的最常见疾病之一,具有高发病率、高复发率和高癌变率。用于治疗GU的常规药物包括质子泵抑制剂、抗酸剂、H2受体拮抗剂和抗胆碱能药物[1]。然而,目前的治疗方法的疗效并不是绝对的,它们可能有严重的副作用,如胃肠道反应、反弹反应、高胃泌素血症、肝肾毒性、过敏和心律失常[2]。因此,许多学者开始寻找具有治疗作用的天然产物或天然资源,以取代副作用较强的药物[3]。
芍药甘草汤(SGD)是中医的经典方剂,自汉代张仲景的《伤寒论》记载以来,一直沿用至今[2]。SGD由白芍和甘草按1∶1比例配伍而成,具有双向调节、解痉挛、止痛等药理作用,对多种疾病均有较好的疗效[4]。芍药为君药,味酸、微甘,性微寒,可养血调经、敛阴柔肝止痛,既能滋肝阴而养肝血,又能够敛肝阴而柔肝体,可发挥镇痛、抗炎及护肝等药理作用。芍药有效成分芍药苷,既可减轻炎性反应,缓解炎性疼痛,又可减轻神经性疼痛。甘草为臣药,具有补虚、缓急止痛之功效。现代药理研究表明甘草中的甘草总黄酮可以与芍药总苷协同作用,缓解神经性疼痛,临床上主要用于治疗以内脏平滑肌绞痛和严重痉挛为特征的疾病,如GU和十二指肠溃疡[5]。但是,至今尚未有研究阐明SGD对GU的胃保护作用的相关机制。因而本研究通过组织病理学评价系统,研究了SGD对大鼠酒精性GU的保护作用,并进一步研究炎性细胞因子的释放、胃黏膜保护性介质的产生和氧化应激状态。
1 材料与方法
1.1 材料准备 本研究使用为SPF级雄性SD大鼠(6~8周龄,实验动物伦理号IACUC-20190101-01),体质量(220±20)g,实验动物均在SPF实验动物中心饲养,饲养环境为(25±2)℃,相对湿度40%~60%。实验前禁食12 h,禁水3 h,动物实验经医院动物伦理委员会批准(伦理号:2022014)。SGD由白芍和甘草(批号:20020101,200316,购自国药同济堂贵州药业有限公司)按1∶1的比例组成。2种中草药(110 g)按1∶8的比例在冷水中浸泡0.5 h,在强热下煮沸后,在慢火下加热1 h,然后过滤。残渣用8倍量冷水煮沸1 h,再次过滤。将滤液组合并浓缩干燥。以原干粉为原料,在使用前加入适量的超纯水,并以1 g/mL的最终浓度将其超声制成悬浮液。
1.2 SGD诱导治疗GU 所有大鼠(48只)随机分为6组(n=8):对照组(CON)、模型组(MOD)、阳性对照组(硫糖铝)、SGD-L、M、H(4.95、9.90、19.80 g/kg)组。根据原料计算SGD的剂量,根据人-动物剂量换算公式按人剂量给动物给药。麻醉药物和剂量:戊巴比妥购自上海卓凯生物科技有限公司,批号ZC-36981。所有大鼠采用腹腔麻醉,剂量麻药:体质量=1∶100。大鼠在上午9 时灌胃给药1次。7 d后,对照组、模型组大鼠灌胃生理盐水(10 mL/kg),阳性对照组灌胃硫糖铝0.36 g/kg(上海阿拉丁生物试剂有限公司,批号为:2020107724),SGD-L、M、H组分别灌胃4.95、9.9、19.8 g/kg,每日1次。第6 d给药后,禁食12 h,随意饮水。第7 d给药前,断水3 h,按上述方法给药。造模方法为除对照组外,其余大鼠均于末次给药后1 h灌胃75%乙醇10 mL/kg[4-5],造模成功如图1所示。对照组大鼠灌胃生理盐水10 mL/kg、其余5组大鼠75%乙醇灌胃,1 h后,麻醉下颈椎脱位处死大鼠,取胃,固定在福尔马林中,进行组织学分析。
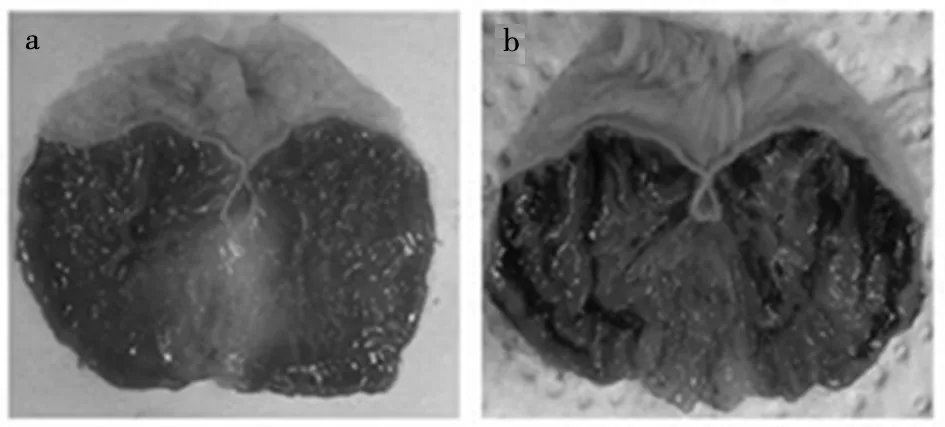
图1 空白对照组大鼠胃(a)与模型组大鼠胃(b)
1.3 观察方法 固定组织脱水,石蜡包埋,切片,脱蜡,苏木精-伊红染色镜检。用数字切片扫描仪观察和拍摄图像,并观察特定的病变。将胃组织从冷冻箱(-80 ℃)中取出,解冻。在冰浴条件下,切割切片,加入9倍体积(约100 mL)的预冷PBS溶液,使用电动组织均质器将切片均质。匀浆在4 ℃、5 000 r/min下离心10 min,离心后收集上清液进行测定。所有步骤均严格按照试剂盒说明执行。最后,使用多功能微板读取器测量每个井在特定波长的吸光度。根据标准曲线测定肿瘤坏死因子-α(TNF-α)、表皮生长因子(EGF)、前列腺素E2(PGE2)、超氧化物歧化酶(SOD)和血浆硫代巴比妥酸反应物质(TBARS)水平(上述Elisa试剂盒均购买自上海阿拉丁生化科技有限公司,批号依次为:20222400789,CS-E10005,363-24-6,19160-1KT-F,104821-25-2)。
2 结果
2.1 组织学特征 具体如图2所示,HE染色结果显示,胃黏膜上皮细胞完整,炎性细胞正常,未见浸润、充血、水肿。与对照组比较,模型组大鼠胃黏膜全层损伤更明显,黏膜上皮和固有层坏死,黏膜上皮缺失,固有层管状胃腺形态结构模糊,大量壁细胞和主细胞坏死,胞核溶解。细胞质溶解或缺失,表明75%乙醇对大鼠胃黏膜造成严重损伤。与模型组比较,SGD-L(4.95 g/kg)组大鼠胃组织损伤程度无明显减轻。SGD-M(9.90 g/kg)组大鼠胃组织浅表黏膜损伤较轻,黏膜下层、肌层和外膜相对完整,具有明显的层次性。黏膜下层可见不同程度的炎性细胞浸润。阳性模型组损伤程度与SGD-M(9.90 g/kg)组相似。SGD-H(19.80 g/kg)组损伤程度最小,胃组织黏膜层、黏膜下层、肌层、外膜结构较完整、层次化,黏膜下层未见明显水肿,炎细胞轻度浸润。
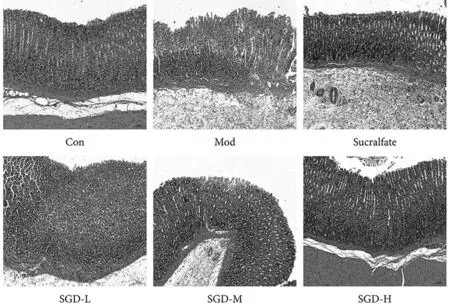
图2 SGD对模型大鼠胃黏膜病理形态的影响 (×100)
2.2 SGD对各标志物产生的影响 具体如图3所示。如图3a所示,与对照组相比,模型组胃组织中TNF-α水平升高(变化1.17倍),引发炎症反应。但与模型组比较,阳性模型组和SGD(4.95 g/kg)组TNF-α水平降低(模型组分别为85.83%和88.87%,P<0.05)。SGD(9.90 g/kg)组和SGD(19.8 g/kg)组TNF-α的水平显著降低(分别为模型组的87.17%和86.50%,P<0.01)。研究结果表明,SGD可降低GU大鼠胃组织TNF-α的表达水平,减轻炎症,保护胃黏膜。
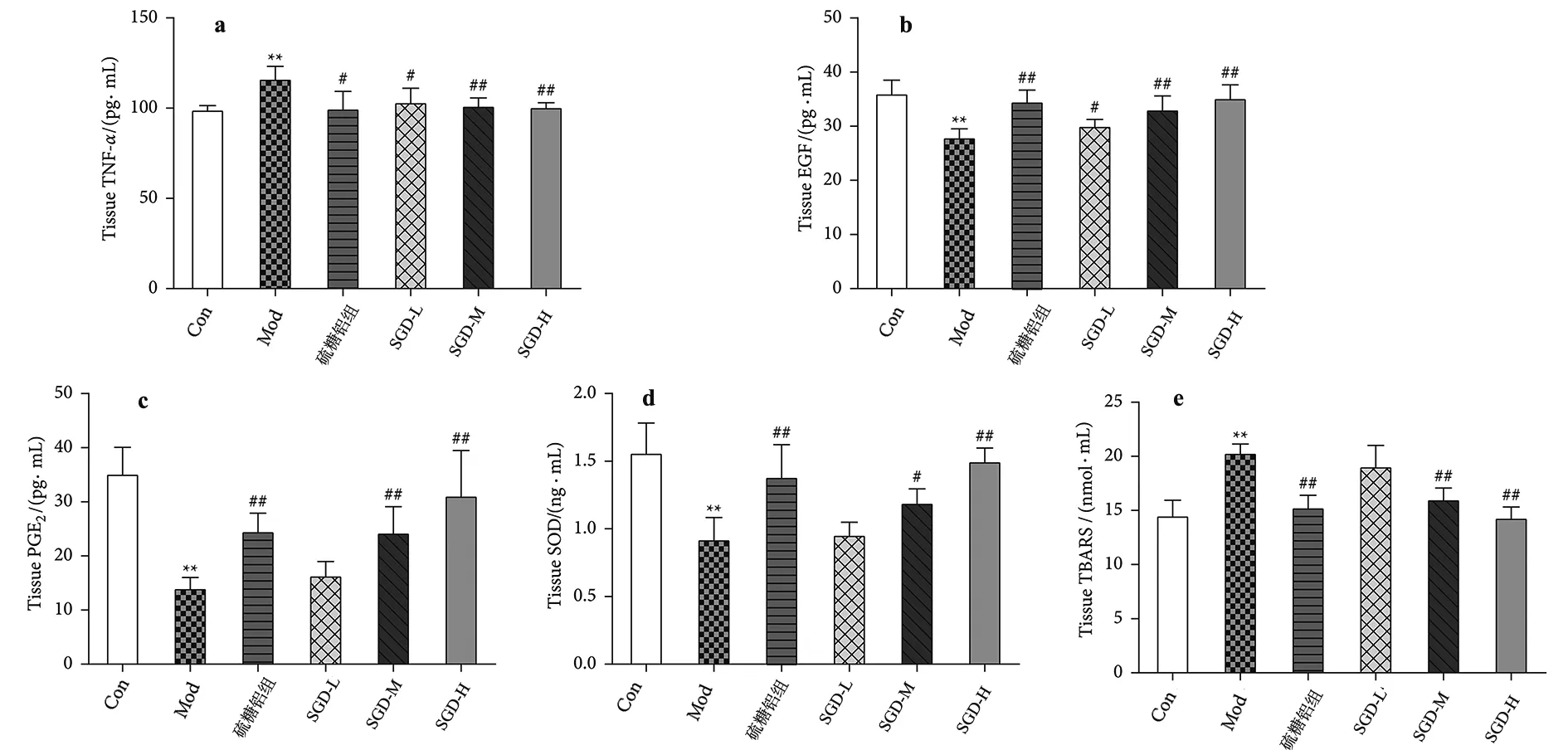
注:a.TNF-α;b. EGF;c.PGE2;d.SOD;e.TBARS。数值为8个样本的平均值±标准差。与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。图3 SGD对模型大鼠胃组织TNF-α、EGF、PGE2、SOD、TBARS水平的影响
图3b和图3c显示了SGD对GU大鼠胃组织中EGF和PGE2水平的影响。统计分析显示,与对照组相比,模型组胃组织中EGF和PGE2水平显著降低(EGF变化1.28倍,PGE2变化2.49倍,P<0.01)。与模型组比较,阳性模型组、SGD(9.90 g/kg)组、SGD(19.80 g/kg)组EGF水平均显著升高(分别为模型组的123.53 %、118.45 %、125.90 %,P<0.01)。同样,阳性模型组、SGD(9.90 g/kg)组和SGD(19.80 g/kg)组PGE2水平均显著高于模型组(分别为模型组的174.15 %、172.40 %和220.86 %,P<0.01)。研究结果提示,SGD可增加GU大鼠胃组织中EGF和PGE2的表达,提高胃黏膜屏障的保护功能。
如图3d所示,乙醇诱导的胃损伤是由活性氧(ROS)的增加介导的。对ROS的防御机制主要体现在增加内源性抗氧化酶水平和抑制脂质过氧化。在抗氧化酶方面,模型组胃组织SOD水平明显低于对照组(变化1.69倍)。与模型组比较,阳性模型组和SGD(19.80 g/kg)组SOD水平均显著升高(分别为模型组的149.78 %和162.13 %,P<0.01)。SGD(9.90 g/kg)组 SOD的水平升高(是模型组的129.16 %,P<0.05)。
如图3e所示,在脂质过氧化方面,模型组大鼠胃组织中硫代巴比妥酸反应物质(TBARS)水平明显高于对照组(1.37倍变化,P<0.01)。与模型组比较,阳性模型组、SGD(9.90 g/kg)组、SGD(19.80 g/kg)组TBARS水平显著降低(分别为模型组的77.10 %、78.66 %、71.83 %,P<0.01)。研究结果提示,SGD可有效提高大鼠胃组织中SOD的表达水平,降低大鼠胃组织中TBARS的表达水平,减轻氧化应激损伤,从而保护胃黏膜。
3 讨论
芍药甘草汤(SGD)作为《古代经典名方目录(第一批)》中的100个经典方剂之一,方剂简练,配伍清晰,疗效准确,临床用药记录丰富,具有极其重要的研发价值[6]。本研究采用75%乙醇建立大鼠酒精性GU模型,从抗炎、胃黏膜保护、抗氧化3个方面验证SGD的抗GU作用[7]。炎症是GU发病机制中的一个重要方面,多种炎症细胞因子参与其中。TNF-α主要是由肥大细胞、血管内皮细胞和单核巨噬细胞分泌的一种具有广泛生物学活性的效应分子。它能有效地促进中性粒细胞的渗透。因子可激活中性粒细胞大量聚集在溃疡周围,阻碍溃疡周围的血液微循环,引起胃微循环障碍,诱发溃疡形成[8]。在本研究中,正常大鼠灌胃75%乙醇后,胃组织中TNF-α的水平升高,给药能降低GU大鼠胃组织中TNF-α的表达水平,减轻炎症反应。笔者的研究结果与前人的研究结果一致[7-8],表明SGD的抗炎活性在一定程度上具有胃保护作用。
EGF和PGE2是胃黏膜重要的防御和修复因子。EGF可以抑制胃酸和胃酶的分泌,减少对黏膜的损伤,增加胃黏膜和糖蛋白的合成和分泌,调节其对胃黏膜的营养和保护作用,维护胃黏膜的完整性[9]。PGE2可增加胃黏膜局部血流量,刺激胃黏膜基底细胞向表面迁移,促进黏膜修复,维持黏膜完整性,增强黏膜防御功能[10]。在本研究中,给予SGD后,EGF和PGE2的水平显著升高。笔者的结果与许多以前的研究结果是一致的[9-10],提示SGD可促进胃黏膜合成、分泌和释放PGE2,增加内源性EGF水平,从而促进胃黏膜的生长。损伤修复,增强胃黏膜屏障防御功能。
氧化应激是指生物体或细胞内氧自由基的产生和清除之间的失衡,导致体内或细胞内活性氧物种(ROS)的积累,进而引起氧化[11]。SOD是一种重要的细胞内抗氧化酶,是抵御ROS的第一道防线。它催化超氧自由基转化为更稳定的过氧化氢,然后在体内被过氧化氢酶分解成完全无害的水,保护细胞免受ROS的毒性损害[12]。过量的活性氧会导致脂质、蛋白质、核酸和其他细胞成分发生脂质过氧化,从而导致功能障碍,增加TBARS的水平,并严重损害胃组织的表面。SOD过程在黏膜损伤的发病机制中起着关键作用[13]。在本研究中,正常大鼠灌胃75 %乙醇后,胃组织中的SOD水平显著降低,而TBARS水平显著升高。SGD能有效提高大鼠胃组织中SOD的表达水平,降低大鼠胃组织中TBARS的表达水平。研究结果表明,SGD可以减轻氧化应激损伤,从而保护胃黏膜。胃黏膜上皮细胞的凋亡与溃疡的发生密切相关。胃黏膜上皮细胞具有持续更新的能力,即损伤后具有一定的修复功能[14]。正常情况下,胃黏膜上皮细胞处于凋亡与增殖之间的平衡状态。然而,当胃黏膜受到严重破坏时,就会破坏胃上皮的结构和功能细胞,打破其增殖和凋亡的平衡,引起GU[15]。
综上所述,SGD对大鼠胃黏膜有保护作用,对酒精性GU损伤有保护作用,并能促进溃疡愈合。SGD的保护作用至少部分通过抗炎作用、EGF产生、PGE2产生和抗氧化应激作用来解释。当然,SGD抗胃溃疡的潜在机制有待进一步验证,需要更清晰的作用机制和动力学基础,为SGD的临床应用提供更科学可靠的实验数据支持。
