炎症相关因子TLR4 NF-κB在特发性膜性肾病肾组织中的表达及临床意义
2023-07-04刘程君陈卫东常保超
刘程君, 潘 艳, 刘 磊, 陈卫东, 陈 畅, 常保超
(蚌埠医学院第一附属医院肾内科, 安徽 蚌埠 233000)
特发性膜性肾病(idiopathic membranous nephropathy,IMN)是肾病综合征常见的病理类型,也是导致肾衰竭的主要原因。近年来,IMN的发病率显著上升,逐渐成为成人常见的原发性肾小球疾病之一。其发病机制目前尚不十分明确,多数学者认为免疫介导和炎症损伤在其发病过程中起主导作用,而且越来越多的研究显示多种炎症因子和免疫反应相互作用共同参与了肾病的发病机制,与肾脏疾病进展有着密切关系。炎症反应的发生涉及多种信号通路,其中核转录因子-kappa B(nuclear factor-kappa B,NF-κB)途径是人类肾脏疾病中重要激活靶点,多种致病因素激活Toll样受体4(Toll-like receptor 4,TLR4)信号转导通路,进而激活下游通路NF-κB途径,引起肾小球免疫炎症反应[1]。既往已有动物实验研究显示,TLR4、NF-κB在膜性肾病大鼠中高表达,通过抑制TLR4/NF-κB转导通路可以减轻肾脏损伤,我们有理由相信炎症因子TLR4、NF-κB在IMN患者肾脏组织病变过程中发挥同样重要作用[2]。因此,本研究选取IMN患者进行肾组织炎症因子TLR4、NF-κB水平表达,观察炎症在IMN中的表达,为IMN的发病机制及治疗方案提供依据。
1 资料与方法
1.1研究对象及分组:研究对象选取2021年3月至2022年3月于蚌埠医学院第一附属医院经肾活检初次诊断为特发性膜性肾病的患者45例为特发性膜性肾病组(IMN组),平均年龄(50.40±7.77)岁,其中男性30例,女性15例。同期选取因肾挫伤、肾肿瘤或输尿管肿瘤等行肾脏切除留取健康肾脏组织20例作为正常对照组(NC组),平均年龄(56.80±7.32)岁,其中男性12例,女性8例。同时根据病理结果Masson染色观察肾小管-间质是否伴有纤维化,将IMN组分为IMN纤维化组29例,平均年龄(53.24±6.69),IMN无纤维化组16例(45.25±7.04)。主要纳入标准:所有研究对象年龄均大于18岁,均排除近期合并感染、严重心脏疾病、肝脏疾病等,且未接受过糖皮质激素及免疫抑制剂治疗;IMN组的患者需经我院肾活检初次诊断为IMN,排除因肿瘤、糖尿病、高血压、药物、肥胖、自身免疫性疾病等其他继发性膜性肾病的可能;对照组选取的肾组织经我院病理科证实为无肿瘤转移的正常肾组织。此研究经蚌埠医学院第一附属医院伦理委员会批准(伦理批号:[2020]第117号)。
1.2一般临床资料及生化指标:收集所有研究对象的一般临床资料,包括姓名、性别、年龄、住院号、病程及联系方式等。所有受试者的生化指标均来自在我院行空腹抽取外周静脉血所得,包括血清白蛋白(Alb)、甘油三酯(TG)、尿素氮(BUN)、高密度脂蛋白(HDL)等,并化验24h尿蛋白定量(24h-Upro)。
1.3病理组织:IMN组患者的病理组织蜡块从合肥金域医学检验公司获取,将由我院泌尿外科获取的NC组肾组织制作成病理组织蜡块,分别将包埋在蜡块中的肾组织标本取3μm厚度切片。
1.4主要试剂:兔抗P-NF-kB p65多克隆抗体(货号GB113882,稀释比例为1∶300),兔抗TLR4多克隆抗体(货号GB11519,稀释比例为:1∶300)。上述抗体均购于武汉塞维尔生物科技有限公司。
1.5组织染色:将石蜡切片依次放入二甲苯Ⅰ20min、二甲苯Ⅱ20min、无水乙醇Ⅰ5min、无水乙醇Ⅱ5min、75%酒精5min,流水反复冲洗几遍,脱蜡至水。分别进行HE、Masson染色,光镜下观察各组肾脏组织病理变化。
1.6免疫组化染色:将石蜡切片依次放入二甲苯Ⅰ20min、二甲苯Ⅱ20min、二甲苯Ⅲ20min、无水乙醇Ⅰ5min、无水乙醇Ⅱ5min、85%酒精5min、75%酒精5min,流水反复冲洗几遍,脱蜡至水后,置于柠檬酸抗原修复缓冲液(PH6.0)中进行抗原修复,阻断内源性过氧化物酶,然后于室温下进行血清封闭30min,依次在PBS中滴加按一定比例配好的一抗、二抗,DAB显色,苏木素复染细胞核,脱水封片,显微镜镜检,最后进行图像采集分析。苏木素染细胞核为蓝色,DAB显出的阳性表达为棕黄色。肾组织免疫组化中棕黄色染色为炎症因子阳性表达,棕黄色着色越深,炎症因子表达越高。每张切片在高倍镜(×400)下随机选取10个视野,用Image J图像分析软件测得每个视野的平均光密度值,并以其10个视野的平均光密度值的均值反映炎症因子阳性表达的强度,均值越大,阳性表达越强。
2 结 果
2.1IMN组与NC组病理组织学检查:在光镜下HE染色及Masson染色显示,IMN组患者肾组织具有肾小球形态不规则弥漫性病变,毛细血管袢基底膜上皮下嗜复红物沉积,系膜细胞及基质增生,肾小管上皮细胞空泡及颗粒样变性,肾间质水肿伴有炎性细胞浸润等特征。结果见图1。
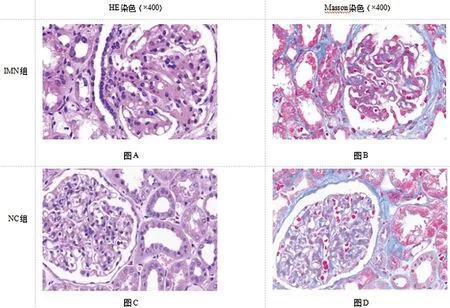
图1 两组肾组织病理染色结果(×400)注:图A、图B分别为特发性膜性肾病组肾组织行HE染色、Masson染色的显微镜下图片;图C、图D分别为正常对照组肾组织行HE染色、Masson染色的显微镜下图片
2.2IMN组及NC组肾组织炎症因子的表达:肾组织免疫组化中棕黄色为炎症因子的阳性表达,显微镜下显示IMN组与NC组肾组织中有不同程度的炎症表达,IMN组中的肾小管及肾小球细胞中存在的炎症因子TLR4、NF-κB的阳性表达量明显高于对照组。利用Image J图像分析软件测得10个视野的平均光密度值,并取其均值进行分析统计,结果显示IMN组肾组织的炎症因子TLR4(t=10.83,P<0.01)、NF-κB(t=9.80,P<0.01)表达图像的平均光密度值显著升高,炎症表达明显增强,与NC组比较明显差异,具有统计学意义。IMN纤维化组TLR4、NF-κB的阳性表达的平均光密度值明显高于无纤维化组(t=2.09,P<0.05)、(t=3.15,P<0.05),具有统计学意义,详见表1、图2及图3。
表1 各组肾组织中TLR4 NF-κB平均光密度值比较
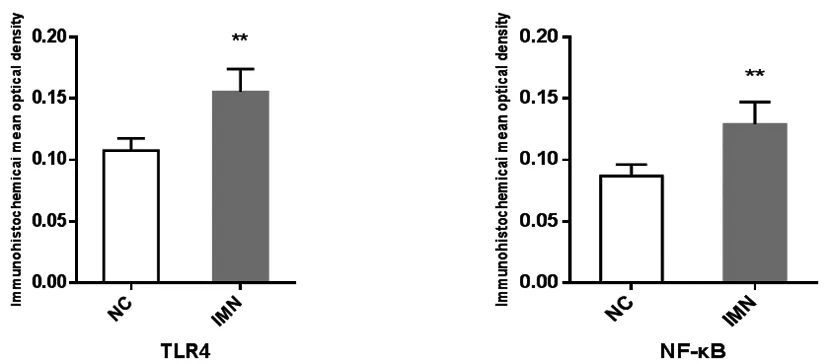
图2 两组TLR4、NF-κB的表达水平

图3 三组肾组织免疫组化染色结果注:图a、b分别为IMN纤维化组,图c、d分别为IMN无纤维化组,图e、f分别为NC组等肾组织切片行免疫组化检测TLR4、NF-κB在显微镜下所采集的图片
2.3肾组织炎症相关因子的表达与临床指标的相关性分析:相关分析结果提示,TLR4表达水平与血清白蛋白(r=-0.544,P<0.01)、高密度脂蛋白(r=-0.463,P<0.01)呈负相关,与24h尿蛋白定量(r=0.308,P<0.05)、血清胆固醇(r=0.485,P<0.01)、低密度脂蛋白(r=0.433,P<0.01)呈正相关。NF-κB表达水平与血清白蛋白(r=-0.307,P<0.05)、高密度脂蛋白(r=-0.334,P<0.05)呈负相关,与24h尿蛋白定量(r=0.319,P<0.05)呈正相关。TLR4、NF-κB表达水平与血清肌酐、尿酸、尿素氮均无相关性(P>0.05)。详见表2。

表2 TLR4 NF-κB平均光密度值与各临床指标的相关性分析
2.4TLR4、NF-κB相关性分析:相关分析结果示,肾组织中TLR4的表达与NF-κB的表达两者之间呈正相关,相关系数r=0.476,差异有统计学意义(P<0.01)。结果见表3。

表3 TLR4 NF-κB的相关性分析
3 讨 论
近些年来,越来越多的研究显示炎症因素在IMN的发病过程中起到重要作用。炎症是疾病发展过程中的重要病理反应,它可以发生在各种类型的疾病中,各种炎症因子之间相互作用介导的肾损伤而产生的蛋白尿是膜性肾病发病机制中的重要一环,在慢性肾脏病的发生、发展中扮演着重要角色[3]。因此,分析炎症因子在IMN表达显得极为重要。
Toll样受体是先天性免疫受体,会对机体内源性危险因素进行反应,并促进机体进行免疫和炎症反应,其中TLR4是肾脏炎症的重要介质,主要表达于肾小管上皮细胞、系膜细胞,同时作为信号通路的启动因子,激活肿瘤坏死因子、NF-κB等多个下游通路,进而激活多种炎症介质的释放引起肾脏纤维化,导致肾脏结构及功能改变。已有研究报道,在膜性肾病患者的肾组织中,TLR4表达上调,血管紧张素Ⅱ通过提高TLR4表达而促进足细胞凋亡,引起肾损伤[4]。Mertowski[5]等研究显示Toll样受体作为肾脏疾病潜在的生物标志物,TLR4的基因表达在对照组及IMN组患者中存在明显差异,其与IMN发病过程密切相关。本实验通过免疫组化方法对IMN患者肾组织中TLR4水平的检测发现IMN组TLR4表达水平上调,而NC组TLR4低水平表达,结果与既往研究相符。在此基础上,进一步做了TLR4与临床资料进行Pearson相关性分析,结果显示TLR4与血清白蛋白、高密度脂蛋白呈负相关,与24h尿蛋白定量、血清胆固醇、低密度脂蛋白呈正相关。因此我们考虑可以通过多种途径来干预TLR4的表达,减轻肾脏炎症反应,改善肾病患者临床症状。蔡莉[6]等研究通过miR-25-3p靶向抑制TLR4转录和翻译,进而抑制促炎性因子的转录,改善糖尿病肾病炎症反应。也有研究报道,可以通过抑制TLR4/MyD88、TLR4/NF-κB等信号通路来干预TLR4的表达,从而改善肾脏纤维化,延缓疾病进展。结合本实验研究结果,炎症因子TLR4与IMN密切相关,参与了IMN的发病过程。
NF-κB广泛存在于肾小管上皮细胞和系膜细胞中,为炎症反应的下游信号通路,在细胞损伤和肾脏纤维化中起到重要作用[7]。多种外界因素刺激下,如氧化应激、炎症反应等,可导致细胞中NF-κB激活,促进白细胞介素-6(IL-6)、巨噬细胞趋化蛋白-1(MCP-1)、肿瘤坏死因子-α(TNF-α)等细胞因子的释放,对肾脏足细胞、系膜细胞造成炎性损伤,导致肾组织纤维化和蛋白尿等,严重者引起肾衰竭[8]。樊红卫[9]等研究指出NF-κB在膜性肾病大鼠中表达上调,川芎嗪可以使NF-κB p65失活从而抑制炎症反应,改善肾脏损伤。本研究结果显示,NC组NF-κB低水平表达,IMN组NF-κB表达水平上调,炎症表达明显增强。同时进行Pearson相关分析提示NF-κB表达水平与血清白蛋白、高密度脂蛋白呈负相关,与24h尿蛋白定量呈正相关,这提示了NF-κB在IMN疾病发生、发展中扮演重要角色。Chebotareva[10]等研究也发现,在慢性肾小球肾炎患者中,NF-κB的表达水平与蛋白尿密切相关,这与本实验研究相符,因此我们可以设想通过阻断NF-κB信号通路的表达,减少蛋白尿,保护肾功能。
此外本研究发现,炎症因子TLR4、NF-κB在IMN肾组织中不仅表达水平升高,且相关性分析显示两者间呈正比,表明其在炎症过程相互作用和相互影响,从而认为机体可能通过激活TLR4/NF-κB信号通路,进而影响下游通路细胞因子的表达,促进肾组织纤维化,加重肾脏损伤,共同参与了IMN的发病。
综上所述,IMN患者肾组织中炎症因子TLR4、NF-κB表达水平明显升高,且两者间相互作用导致肾组织纤维化,引起肾脏损伤,说明TLR4/NF-κB信号通路介导的炎症反应在IMN的发生与发展中发挥重要作用,为进一步探索IMN发病机制提供依据,也为IMN的诊断及治疗提供新的视角。但本实验样本量较少,需加大样本量得到更有利的实验结果,同时完善外周血清中炎症因子的表达进一步探讨信号通路在IMN中的表达。