miR-876-5p通过负反馈调节上皮-间质样转化在胃癌进展中的作用及机制研究
2023-07-04赵翠娟屈振杰
崔 琴, 赵翠娟, 屈振杰
(内蒙古包钢医院, 内蒙古 包头 014010)
胃癌是全球最具侵袭性的恶性肿瘤之一,也是全球癌症相关死亡的第三大原因,其进展快速且高度转移的生物学特性是导致患者死亡率居高不下的关键因素[1]。近年来,尽管早期诊断和治疗取得了进展,但胃癌患者尤其是转移性胃癌患者的预后仍然较差。上皮-间质样转化(epithelial-mesenchymal transition,EMT)是上皮细胞在特定的生理和病理情况下向间质细胞转化的过程,在肿瘤进展如侵袭和转移中起着关键作用,肿瘤细胞可以通过EMT变得更具侵袭性。在临床诊疗中,EMT与胃癌患者的预后不良密切相关[2]。因此,需要更好地了解胃癌转移中调控EMT过程的关键靶点及潜在机制,制定阻断肿瘤的侵袭转移过程以对抗胃癌进展的有效治疗策略。微小RNA(MicroRNA,miRNA)是内源性非编码调节RNA,具有17~25个核苷酸,在转录后基因调控中起重要作用,通过与对应靶标mRNA的3'-非翻译区域结合互补,导致mRNA降解或翻译抑制,从而调节基因表达。miRNA参与调节多种生物学过程,如细胞增殖、转移、分化、凋亡、EMT等。越来越多的研究表明,miRNA的异常表达与肿瘤发生发展密切相关,胃癌组织和胃癌细胞系中miRNA表达失调有助于肿瘤发生,且表达特征可能与不同的癌症类型和临床病理特征相关[3]。miR-876-5p的表达与功能已经在多种类型的癌症中进行了研究,包括肺癌、肝细胞癌、乳腺癌等[4],此外,已有研究证实miR-876-5p在胃癌肿瘤组织中的表达水平较低,过表达miR-876-5p抑制了胃癌细胞增殖并促进了细胞凋亡[5]。但miR-876-5p在胃癌EMT中的作用机制及与EMT介导胃癌进展的之间的关系尚待明确。本研究进一步检测了胃癌组织内miR-876-5p表达变化,探究了miR-876-5p在TGF-β1诱导胃癌EMT过程及进展中的作用及具体机制。现报道如下。
1 资料与方法
1.1临床资料:选取2021年6月至2022年4月期间在我院行胃癌根治性手术的49例患者的肿瘤组织及癌旁正常组织(距肿瘤边缘5cm以上),切除后立即置于液氮中,然后保存于-80℃冰箱,所有肿瘤标本经病理检查明确诊断为胃癌。其中女性22例,男性27例,年龄42~70岁,平均年龄(56.80±5.46)岁,术前均未进行过放化疗、靶向治疗、免疫治疗等其他治疗,排除患有心、肝、肾等器脏疾病或其他恶性肿瘤患者。所有患者同意进行此研究并签署知情同意书,也获得我院医学伦理委员会批准同意。
1.2主要材料与试剂:人胃癌细胞系BGC-823购于苏州思瑞坦细胞库。胎牛血清、双抗液及DMEM培养基购于美国Gibco公司,TGF-β1购于美国Sigma公司,Trizol试剂盒和LipofectamineTM2000试剂盒购于美国Invitrogen公司,miRNA反转录与定量检测试剂盒购于日本Takara公司,CCK-8试剂盒购于北京索莱宝生物公司,EdU染色试剂盒购于广州锐博生物公司,Transwell小室和Matrigel胶购于美国Corning公司,Triton X-100购于北京百奥莱博公司,结晶紫染液、Hoechst染液、DAPI染液、RIPA裂解液、ECL显色液及PVDF膜购于上海碧云天生物研究所,兔抗E-cadherin多克隆抗体、兔抗Vimentin多克隆抗体、兔抗N-cadherin多克隆抗体、兔抗Snail多克隆抗体、兔抗MMP-2多克隆抗体、兔抗MMP-9多克隆抗体、兔抗ERK1/2多克隆抗体及兔抗p-ERK1/2多克隆抗体、兔抗GAPDH多克隆抗体、Alexa Fluor标记的山羊抗兔IgG抗体及辣根过氧化物酶标记的山羊抗兔或驴抗兔均购于英国Abcam公司。
1.3方 法
1.3.1实时荧光定量PCR反应:将冻存的胃癌组织及癌旁正常组织取出,无菌环境下剪碎,加入液氮研磨成粉末状,采用Trizol法提取总RNA,超微量分光光度计测定样品的吸光度值,鉴定RNA纯度、浓度。Real-time PCR实验将总RNA反转录为cDNA。以U6做为内参基因,根据miRNA定量检测试剂盒说明书配制20μL PCR反应体系,依次加入底物与各试剂后,将该体系置于定量检测系统上进行实时荧光定量PCR反应,设置反应程序为:95℃ 10min预变性,循环1次;95℃ 10s,60 ℃ 30s,循环40次。实验引物序列如下:miR-876-5p Forward 5′-TGGATTTCTTTGTGAATCACCA-3′,Reverse 5′-AACGAGACGACGACAGAC-3′;U6 Forward 5′-GCAAATTCGTGAAGCGTTCCATA-3′,Reverse 5′-AACGAGACGACGACAGAC-3′。扩增结束后,生产溶解曲线,将阈值设定在荧光值对数图的线性部分,读取Ct值,根据2-ΔΔCt法计算miR-876-5p相对表达量。
1.3.2细胞实验分组与处理:将胃癌细胞系BGC-823置于37℃、5%CO2孵箱,使用含10%胎牛血清及双抗液的DMEM培养基培养24h至细胞汇合度达80%,调节密度为3×105个的细胞数量接种于6孔板培养,次日,弃原培养液,将细胞分为5组:①对照组,胃癌细胞正常培养;②EMT组,参照文献方法[6]加入5ng/mL TGF-β1诱导24h以建立胃癌细胞EMT模型;③miR-NC+EMT组,将miR-NC转染至胃癌细胞后再建立EMT模型;④miR-876-5p+EMT组,将miR-876-5p转染至胃癌细胞后再建立EMT模型;⑤miR-876-5p+EMT+ISO组,将miR-876-5p转染至胃癌细胞后建立EMT模型,同时以20μmoL LL ERK信号通路激活剂ISO处理24h。细胞转染实验中,利用LipofectamineTM2000试剂盒将miR-876-5p mimic或miR-NC转染至胃癌细胞,具体按照制造商说明书进行操作。
1.3.3免疫荧光染色:将处理后的各组胃癌细胞接种至防脱载玻片上,利用4%多聚甲醛固定,滴加0.1%Triton X-100室温孵育10min,再以10%山羊血清室温封闭2h。将兔抗E-cadherin多克隆抗体、兔抗Vimentin多克隆抗体、兔抗N-cadherin多克隆抗体均稀释为1∶200,再滴加适量抗体工作液覆盖玻片,置于4℃冰箱孵育过夜。取出玻片,常温复温30min后,PBS清洗,滴加稀释的Alexa Fluor标记的山羊抗兔IgG抗体(1∶500),置于37℃培养箱孵育30min,PBS清洗,加入DAPI避光染核10min,PBS再次清洗,封片,自然晾干,通过荧光显微镜观察细胞染色情况并采集图像。
1.3.4Western blot:在收集的胃癌细胞中加入RIPA裂解液,超声粉碎,置于冰上裂解30min,低温离心机4℃下以12000rpm离心10min,取上清,即为蛋白样品,BCA法测定浓度。将等量缓冲液与蛋白混匀,100℃煮沸变性,取40μg蛋白样品上样至10%SDS-PAGE凝胶孔内,固定电泳装置,电泳分离蛋白,电转至PVDF膜,室温下以5%脱脂奶粉封闭1h。将兔抗E-cadherin多克隆抗体、兔抗Vimentin多克隆抗体、兔抗N-cadherin多克隆抗体、兔抗Snail多克隆抗体、兔抗MMP-2多克隆抗体、兔抗MMP-9多克隆抗体、兔抗ERK1/2多克隆抗体及兔抗p-ERK1/2多克隆抗体均按照1∶1000稀释后,与膜在4℃冰箱内共孵育过夜。TBST洗膜,滴加稀释后的辣根过氧化物酶标记的山羊抗兔或驴抗兔(1∶5000),室温孵育1h。ECL显色曝光,紫外凝胶成像仪拍照,采用ImageJ软件分析各蛋白条带灰度值,以GAPDH作为内参蛋白,以目的蛋白与GAPDH蛋白的灰度值之比表示目的蛋白相对表达量。
1.3.5CCK-8法:将处理后的各组胃癌细胞置于37℃、5%CO2孵箱,分别在0、24、48、72h进行CCK-8实验,在每孔加入10μLCCK-8试剂液,轻柔混匀,继续放入孵箱内培养2h,通过酶标仪检测各孔细胞在450nm波长处的光密度值,并记录分析。
1.3.6EdU染色:将处理后的胃癌细胞浓度调节为1×105个/mL,吸取100μL接种至96孔板,添加10μmoL/L EdU室温孵育2h,PBS清洗,加入Apollo488室温避光染色30min,再以Hoechst避光染核30min,PBS清洗后,封片,自然晾干,通过荧光显微镜观察细胞染色情况并采集图像,镜下EdU阳性细胞呈绿色。随机选择6个视野,计数EdU阳性细胞数目与总细胞数目,分析计算EdU阳性比率,EdU阳性率(%)=EdU阳性细胞数目/总细胞数目×100%。
1.3.7Transwell小室法:收集处理后的各组胃癌细胞,使用不含胎牛血清及双抗液的DMEM培养基调节细胞浓度为4×104个/mL,吸取100μL细胞悬液加到Transwell小室的上室,在下室加入500μL含10%胎牛血清的DMEM培养液。将Transwell小室置于37℃、5%CO2孵箱培养24h,取出上室,弃下室培养液,置于PBS中清洗,利用4%多聚甲醛固定10min,滴加0.1%结晶紫染色15min,PBS再次清洗,封片,自然晾干,并在光显微镜下对迁移细胞进行计数并采集图像。侵袭实验中,首先将稀释的Matrigel胶加入到Transwell小室的上室,37℃下放置至胶凝固,形成基质屏障后再加入细胞,其余步骤均与迁移实验步骤相同。
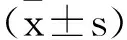
2 结 果
2.1胃癌组织及对应癌旁正常组织内miR-876-5p表达比较:实时荧光定量PCR测定结果显示,相较于癌旁正常组织,胃癌组织中miR-876-5p相对表达量显著下降,差异具有统计学意义(P<0.05),见图1。
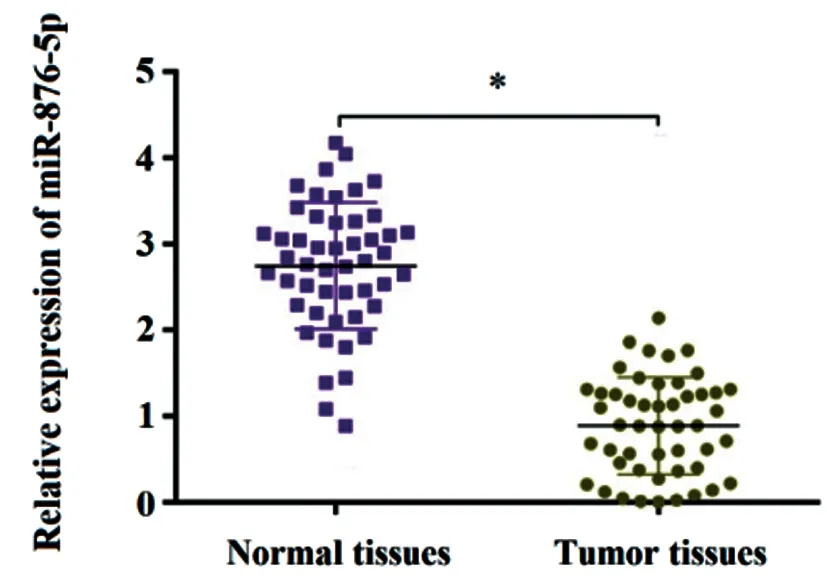
图1 胃癌组织及对应癌旁正常组织内miR-876-5p表达比较注:与癌旁正常组织比较,*P<0.05
2.2各组胃癌细胞上皮-间质样转化水平比较:免疫荧光染色结果显示,与对照组比较,EMT组胃癌细胞E-cadherin荧光表达减弱,Vimentin与N-cadherin荧光表达增强;与EMT组比较,miR-876-5p+EMT组E-cadherin荧光表达增强,Vimentin与N-cadherin荧光表达减弱,而miR-NC+EMT组E-cadherin、Vimentin及N-cadherin荧光表达未发生明显变化;与miR-876-5p+EMT组比较,miR-876-5p+EMT+ISO组E-cadherin荧光表达减弱,且Vimentin、N-cadherin荧光表达增强,见图2。

图2 各组胃癌细胞E-cadherin、Vimentin、N-cadherin荧光表达测定结果(免疫荧光染色,×100)
Western blot测定结果显示,与对照组比较,EMT组E-cadherin蛋白相对表达量显著下调,Vimentin、N-cadherin、Snail、MMP-2及MMP-9蛋白相对表达量均显著上调差,差异具有统计学意义(P<0.05);与EMT组比较,miR-876-5p+EMT组E-cadherin蛋白相对表达量显著上调而Vimentin、N-cadherin、Snail、MMP-2及MMP-9蛋白相对表达量均显著下调,差异具有统计学意义(P<0.05),miR-NC+EMT组各蛋白表达均未发生显著变化(P>0.05);与miR-876-5p+EMT组比较,miR-876-5p+EMT+ISO组E-cadherin蛋白相对表达量显著下调,同时Vimentin、N-cadherin、Snail、MMP-2及MMP-9蛋白相对表达量均显著上调,差异具有统计学意义(P<0.05),见图3。

图3 各组胃癌细胞上皮-间质转化相关蛋白表达水平比较注:1为对照组,2为EMT组,3为miR-NC+EMT组,4为miR-876-5p+EMT组,5为miR-876-5p+EMT+ISO组。与对照组比较,*P<0.05;与EMT组比较,#P<0.05;与miR-876-5p+EMT组比较,^P<0.05
2.3各组胃癌细胞增殖水平比较:CCK-8检测结果显示,在24、48、72h时,EMT组胃癌细胞增殖活性显著高于对照组,差异具有统计学意义(P<0.05);与EMT组比较,miR-876-5p+EMT组细胞增殖活性显著降低,差异具有统计学意义(P<0.05),miR-NC+EMT组则未发生显著变化(P>0.05);miR-876-5p+EMT+ISO组细胞增殖活性显著高于miR-876-5p+EMT组,差异具有统计学意义(P<0.05),见图4。
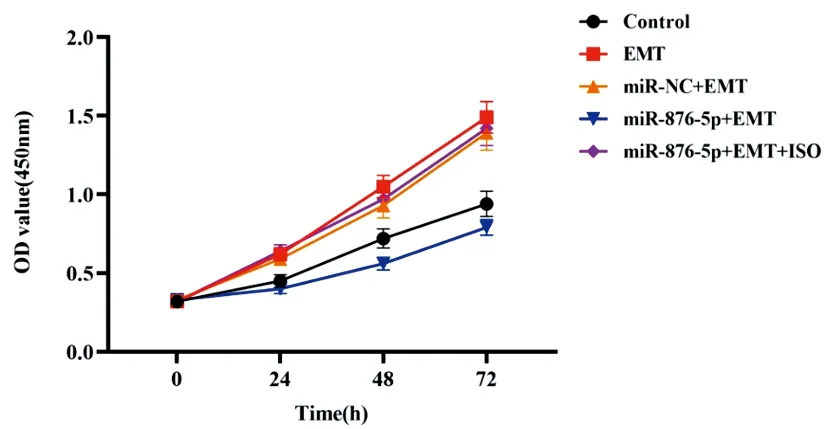
图4 各组胃癌细胞增殖活性比较
EdU染色结果显示,EMT组胃癌细胞EdU阳性率显著高于对照组,差异具有统计学意义(P<0.05);miR-876-5p+EMT组EdU阳性率显著低于EMT组,差异具有统计学意义(P<0.05),miR-NC+EMT组与EMT组的EdU阳性率差异未有统计学意义(P>0.05);miR-876-5p+EMT+ISO组EdU阳性率显著高于miR-876-5p+EMT组,差异具有统计学意义(P<0.05),见图5。
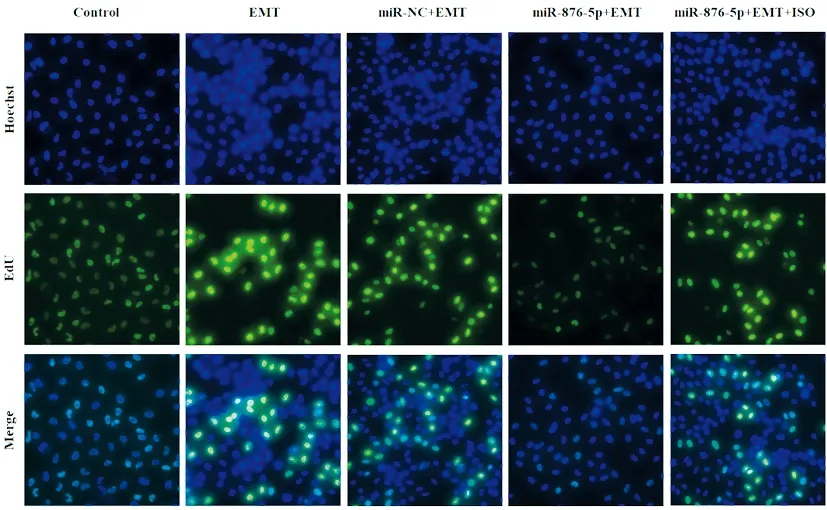
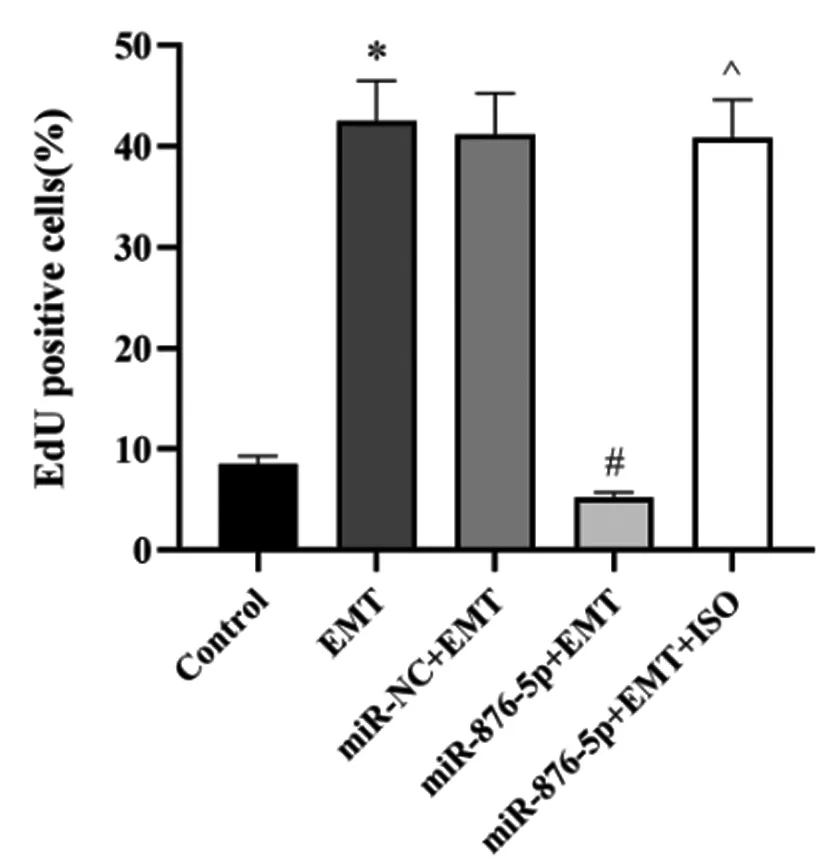
图5 各组胃癌细胞增殖水平比较(EdU染色,×100)注:与对照组比较,*P<0.05;与EMT组比较,#P<0.05;与miR-876-5p+EMT组比较,^P<0.05
2.4各组细胞迁移与侵袭能力比较:Transwell小室测定结果显示,与对照组比较,EMT组胃癌细胞迁移数目与侵袭数目显著增加,差异具有统计学意义(P<0.05);与EMT组比较,miR-876-5p+EMT组迁移数目与侵袭数目显著减少,差异具有统计学意义(P<0.05),miR-NC+EMT组迁移数目与侵袭数目均未发生显著变化(P>0.05);与miR-876-5p+EMT组比较,miR-876-5p+EMT+ISO组迁移数目与侵袭数目显著增加,差异具有统计学意义(P<0.05),见图6。
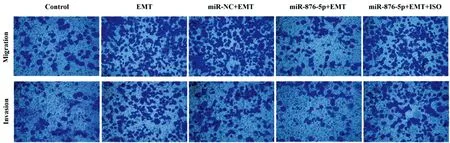
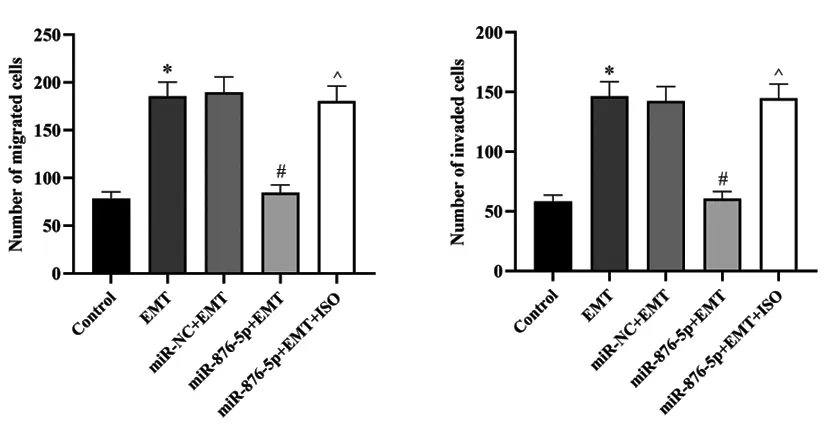
图6 各组胃癌细胞迁移与侵袭变化比较(结晶紫染色,×100)注:与对照组比较,*P<0.05;与EMT组比较,#P<0.05;与miR-876-5p+EMT组比较,^P<0.05
2.5各组细胞TGF-β1介导的ERK信号通路相关蛋白表达比较:经Western blot检测发现,与对照组比较,EMT组胃癌细胞中p-ERK1/2蛋白相对表达量显著上调,差异具有统计学意义(P<0.05);与EMT组比较,miR-876-5p+EMT组p-ERK1/2蛋白相对表达量显著下调,差异具有统计学意义(P<0.05);与miR-876-5p+EMT组比较,miR-876-5p+EMT+ISO组p-ERK1/2蛋白相对表达量则显著上调,差异具有统计学意义(P<0.05)。此外,各组细胞中ERK1/2蛋白相对表达量之间差异无统计学意义(P>0.05),见图7。

图7 各组胃癌细胞ERK信号通路相关蛋白表达比较注:1为对照组,2为EMT组,3为miR-NC+EMT组,4为miR-876-5p+EMT组,5为miR-876-5p+EMT+ISO组。与对照组比较,*P<0.05;与EMT组比较,#P<0.05;与miR-876-5p+EMT组比较,^P<0.05
3 讨 论
目前,已在胃癌中发现了多种异常表达的miRNA,miRNA可作为肿瘤抑制因子或肿瘤促进因子发挥作用。miRNA-149在胃癌组织和细胞中表达降低,将其过表达能够促进细胞凋亡,延缓细胞周期,并抑制胃癌细胞系AGS和MKN28的增殖和迁移; miR-181a-2-3p在尺寸较大(≥5cm)的胃癌组织、T分期较高以及化疗耐药细胞中表达升高,可作为预测胃癌患者总生存期的有效生物标志物,而抑制miR-181a-2-3p表达能够增加顺铂诱导下胃癌细胞的凋亡[7]。由此可见,miRNA不仅可以用作胃癌诊断的生物标志物,还可以作为潜在的治疗靶点,在临床上具有很广的应用前景。深入探究miRNA在胃癌中的作用及具体机制,对于延长胃癌患者生存期及改善预后意义重大。
胃癌的发生和发展与EMT的激活相关。间充质细胞倾向于去分化,以获得致瘤性和干细胞表型,导致细胞粘附能力的丧失,从而诱导细胞侵袭和转移。EMT中上皮细胞向间充质细胞的转化可以通过相关蛋白标志物表达变化来反映,即在肿瘤EMT过程中,肿瘤细胞获得迁移和侵袭能力,导致上皮细胞标志物E-cadherin表达下调,间充质细胞标志物Vimentin和N-cadherin表达上调[8]。当受到肿瘤微环境中不同信号分子的刺激,如缺氧、炎症因子和生长因子作用,胃癌细胞激活相关信号通路并刺激下游转录因子参与EMT过程,从而影响相关生物学特征如迁移和侵袭。TGF-β1是一种具有多种生物活性的细胞因子,在肿瘤进展阶段,由恶性上皮性肿瘤细胞和基质细胞分泌出来后,诱导并促进肿瘤细胞的EMT过程,进而加速肿瘤的浸润与扩散[9]。本研究结果显示,经过TGF-β1诱导胃癌细胞后,E-cadherin荧光表达减弱,Vimentin和N-cadherin荧光表达增强,细胞中E-cadherin蛋白相对表达量下调,Vimentin、N-cadherin、Snail、MMP-2及MMP-9蛋白相对表达量均上调,该结果说明TGF-β1成功诱导了胃癌细胞EMT过程。MMP是与肿瘤发生紧密相关的蛋白酶家族,作为一类锌依赖性内肽酶家族,MMP通过降解基底膜和细胞外基质促进转移环境中肿瘤细胞的侵袭和增殖,MMP-2和MMP-9是MMP家族的两个重要成员,在EMT过程中均上调表达,进而介导肿瘤的侵袭转移[10]。
越来越多的研究表明,miR-876-5p在多种肿瘤中发挥重要作用,Xie等[11]研究发现miR-876-5p在骨肉瘤组织中表达下调,其过表达能够通过靶向细胞间质上皮转换因子(cellular-mesenchymal epithelial transition factor,c-Met)来抑制骨肉瘤细胞增殖、迁移及侵袭;Li等[12]研究表明miR-876-5p通过靶向G蛋白亚基γ12(G protein subunit gamma 12,GNG12)抑制胶质瘤细胞增殖、迁移,并抑制磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号传导活性减缓胶质瘤的恶性发展;本研究结果显示,相较于TGF-β1单独诱导胃癌细胞,转染miR-876-5p后再经TGF-β1诱导的胃癌细胞,不仅E-cadherin表达升高,Vimentin、N-cadherin、Snail、MMP-2及MMP-9表达下降,而且细胞增殖能力下降,细胞迁移数目与侵袭数目也减少,由此推测,miR-876-5p能够抑制TGF-β1介导的EMT进程从而降低胃癌细胞增殖、迁移及侵袭能力,以此发挥抗肿瘤作用。
ERK途径属于丝裂原活化蛋白激酶家族,在级联信号传导中发挥重要作用,其激活后通过磷酸化调节各种转录因子的活性,从而调节细胞的新陈代谢和功能,影响细胞的特定生物学效应。ERK途径的功能障碍是大多数癌症发展的主要触发因素,其级联反应的激活发生在包括胃癌在内的大多数癌症类型中,并已在胃癌肿瘤中检测到ERK表达升高[13]。此外,ERK途径和胃癌细胞EMT过程密切相关,已有研究表明,纤维连接蛋白-C可通过抑制ERK磷酸化水平降低胃癌EMT能力,最终抑制胃癌细胞的增殖和迁移水平[14]。由此可见,靶向抑制ERK途径激活可能在胃癌治疗中具有广阔的前景。本研究结果显示,在TGF-β1诱导胃癌细胞EMT后,细胞中p-ERK1/2蛋白表达明显上调,表明ERK途径激活,而转染miR-876-5p后再经TGF-β1诱导的胃癌细胞中p-ERK1/2蛋白表达受到抑制,根据该结果推测,miR-876-5p抑制胃癌细胞EMT过程可能与抑制ERK途径的激活有关。
综上,本研究检测到miR-876-5p在胃癌组织中低表达,探索了其能够显著抑制TGF-β1诱导的胃癌细胞EMT,并抑制胃癌细胞增殖、迁移及侵袭,从而发挥了抗肿瘤作用,其机制可能与调控ERK途径有关,这为揭示胃癌转移的潜在分子机制提供了理论依据,并为研究胃癌侵袭转移的预防策略及靶向治疗提供了新思路。