外周血中性粒细胞与淋巴细胞比值、血小板与淋巴细胞比值与接受免疫检查点抑制剂治疗食管鳞状细胞癌患者预后的相关性
2023-07-04魏渼倬易善永
张 杰,魏渼倬,赵 玲,易善永
(1.新乡医学院,河南 新乡 453003;2.郑州大学附属郑州中心医院肿瘤内科,河南 郑州 450007)
食管癌由于早期症状隐匿、侵袭性高,多数患者确诊时已为晚期,每年有50多万人死于食管癌,食管癌的病死率居世界第6位[1]。我国是世界上食管癌高发地区之一,以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为主。随着肿瘤免疫学的发展,免疫检查点抑制剂(immune checkpoint inhibitors,ICI)已成为食管癌治疗的新手段;特别是程序性死亡受体1(programmed death-1,PD-1)抑制剂和程序性死亡受体配体1(programmed death-ligand 1,PD-L1)抑制剂已被应用于晚期食管癌的治疗。但是,仍有部分患者对ICI应答较差,这些患者不仅在治疗上难以获益,同时也面临着不必要的经济负担。为使食管癌患者从ICI治疗中获取最大的生存效益,寻找可以预测其预后的生物标志物至关重要。研究指出,炎症在肿瘤发生的各阶段都起着重要作用,其能通过基因突变和表观遗传修饰促进肿瘤的发生[2]。中性粒细胞、淋巴细胞、单核细胞和血小板等血液学指标可反映全身炎症反应状态。研究发现,中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)和血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)与食管癌等多种肿瘤预后相关[3-4],但其动态变化与食管癌ICI治疗后预后的关系研究较少。因此,本研究通过分析ESCC患者接受ICI治疗前后NLR和PLR水平变化,探讨NLR和PLR水平与ESCC患者预后的相关性,以期为食管癌患者的预后评估提供参考指标。
1 资料与方法
1.1 一般资料
选择2020年3月至2022年5月在郑州市中心医院接受ICI治疗的59例ESCC患者为研究对象,其中男43例,女16例;年龄 43~88(66.53±8.91)岁,<67岁28例,≥67岁31例;无手术史31例,有手术史28例;Ⅱ期、Ⅲ期患者共29例,Ⅳ期患者30例;无淋巴结转移28例,有淋巴结转移31例;无远处转移38例,有远处转移21例。病例纳入标准:(1)符合ESCC的诊断标准[5](除外食管胃交界部癌),且根据组织病理学确诊;(2)手术不可切除、不能耐受手术或晚期复发转移患者;(3)接受ICI单药治疗或联合治疗;(4)影像学检查至少有1个可测量的、符合实体瘤疗效评价标准1.1版(response evaluation criteria in solid tumors 1.1,RECIST 1.1)[6]的可供评价病灶;(5)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分 0~2分;(6)具有完整临床病历资料。排除标准:(1)对ICI过敏或ICI使用禁忌证者;(2)长期使用造血因子或激素的患者;(3)既往或现有自身免疫紊乱性疾病者;(4)合并其他原发恶性肿瘤者;(5)合并心脑血管疾病、肝肾功能不全等其他严重疾病者。本研究获得医院医学伦理委员会审核批准,患者或家属知情同意并签署知情同意书。
1.2 治疗方案
入组患者均给予ICI治疗或ICI联合化学治疗。(1)免疫联合化学治疗方案:帕博利珠单抗(默沙东制药有限公司,国药准字S20180019) 200 mg(第1天)、顺铂(江苏豪森药业集团有限公司,国药准字H20040813) 80 mg·m-2(第1天)、氟尿嘧啶(海南卓泰制药有限公司,国药准字H20051627) 800 mg·m-2(第1~5天);或卡瑞利珠单抗(苏州盛迪亚生物医药有限公司,国药准字S20190027) 200 mg (第1天)或特瑞普利单抗(苏州众合生物医药科技有限公司,国药准字S20180015) 240 mg (第1天)或信迪利单抗[信达生物制药(苏州)有限公司,国药准字S20180016] 200 mg (第1天)联合顺铂 75 mg·m-2(第1天)、紫杉醇(扬子江药业集团有限公司,国药准字H20053001) 175 mg·m-2(第1天);均采用静脉滴注治疗,每21 d为1个治疗周期。(2)免疫单药治疗方案:帕博利珠单抗200 mg,静脉滴注,每21 d为1个治疗周期;或卡瑞利珠单抗200 mg,静脉滴注,每14 d为1个治疗周期。应用一线治疗方案治疗48例(81.4%),应用二线治疗方案及以上治疗者11例(18.6%);应用ICI单药治疗方案19例(32.2%),应用ICI联合化学治疗方案40例(67.8%)。
1.3 观察指标
(1)一般临床资料:通过电子病历系统收集患者的年龄、性别、ECOG评分、既往治疗方案等一般临床资料。(2)肿瘤相关指标:收集患者病理类型、TNM分期、远处转移等肿瘤相关指标。(3)实验室指标:分别于ICI治疗前、治疗2个周期后采集患者的外周静脉血2 mL,应用BC-5180全自动血细胞分析仪(深圳迈瑞生物医疗电子股份有限公司)检测患者的中性粒细胞计数、淋巴细胞计数、血小板计数,并计算 NLR(外周血中性粒细胞计数绝对值/淋巴细胞计数绝对值)和PLR(外周血小板计数绝对值/淋巴细胞计数绝对值)。应用ICI治疗前NLR、PLR以NLR0、PLR0表示,ICI治疗2个周期后NLR、PLR以NLR2、PLR2表示。(4)临床疗效:每进行2个周期的治疗后,行实验室检查以及超声、CT、磁共振成像等影像学检查,参照RECIST 1.1标准[6]评价疗效。(5)无进展生存期(progression-free survival,PFS):定义为从初始治疗至患者病情进展或任何原因导致死亡的时间。随访截止至2022年6月30日。
1.4 统计学处理
应用SPSS 26.0软件进行数据统计与分析。计数资料以例数和百分率表示,组间比较采用χ2检验;将疾病进展情况作为状态变量,NLR0、NLR2、PLR0和PLR2作为检验变量,进行受试者操作特征(receiver operating characteristic,ROC)曲线分析,分析NLR0、NLR2、PLR0和PLR2对疾病进展的评估价值,利用约登指数分别确定NLR、PLR的最佳截断值。以PFS为主要研究终点,采用Kaplan-Meier法进行单因素生存分析,并绘制生存曲线图,Log-rank检验比较组间患者的生存差异;Cox回归模型进行多因素生存分析;P<0.05为差异有统计学意义。
2 结果
2.1 ESCC患者的疗效
59例ESCC患者中,完全缓解0例(0.0%),部分缓解13例(22.03%),疾病稳定15例(25.42%),疾病进展31例(52.55%)。
2.2 NLR和PLR对ESCC疾病进展的评估价值
NLR2预测ESCC疾病进展的曲线下面积(area under the curve,AUC)为0.610(P>0.05)。NLR0预测ESCC疾病进展的AUC为0.697[95%置信区间(confidence interval,CI):0.560~0.834,P=0.005],灵敏度为67.7%,特异度为75.0%,最佳截断值为3.00;PLR0预测ESCC疾病进展的AUC为0.740(95%CI:0.614~0.866,P<0.001),灵敏度为58.1%,特异度为 82.1%,最佳截断值为187.75;PLR2预测ESCC疾病进展的AUC为0.724(95%CI:0.592~0.855,P=0.001),灵敏度为83.9%,特异度为60.7%,最佳截断值为152.21。根据截断值将NLR0、PLR0和PLR2分别分为高、低2组,其中低 NLR0 组(NLR<3.00)31例、高NLR0组(NLR≥3.00)28例;低PLR0组(PLR<187.75)36例、高PLR0组(PLR≥187.75)23例;低PLR2组(PLR<152.21)22例、高PLR2组(PLR≥152.21)37例。结果见图1和图2。
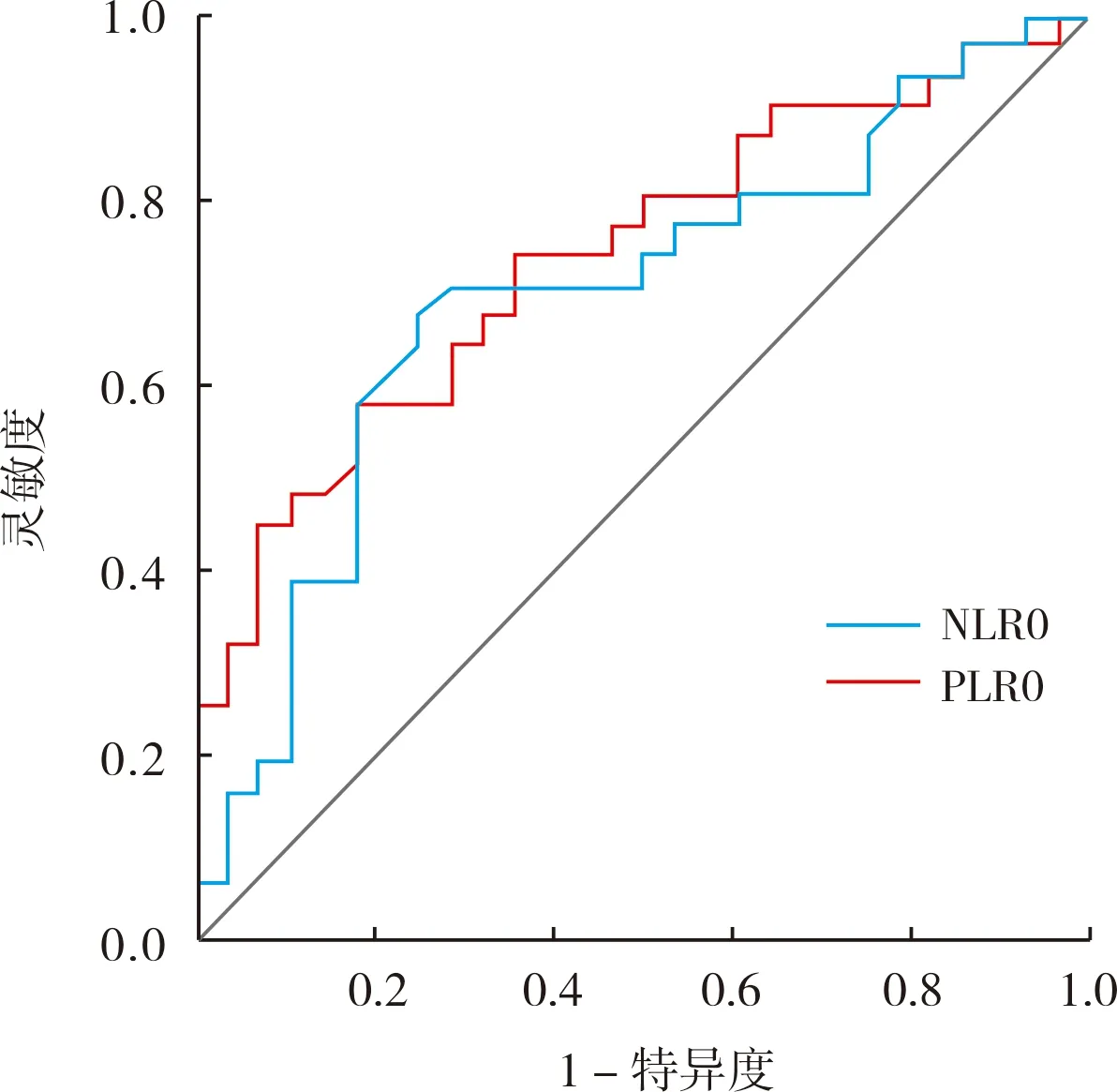
图1 NLR0、PLR0评估ESCC疾病进展的ROC曲线Fig.1 ROC curve of NLR0 and PLR0 for evaluating the progression of ESCC

图2 NLR2及PLR2评估ESCC疾病进展的ROC曲线Fig.2 ROC curve of NLR2 and PLR2 for evaluating the progression of ESCC
2.3 NLR、PLR与ESCC患者临床特征间的关系
高NLR0组Ⅳ期患者占比显著高于低NLR0组,高PLR0组Ⅳ期患者占比显著高于低PLR0组,高PLR2组Ⅳ期患者占比显著高于低PLR2组,差异有统计学意义(P<0.05);高NLR0组远处转移的比例显著高于低NLR0组,差异有统计学意义(P<0.05);不同水平NLR0、PLR0、PLR2组患者的年龄、性别、手术、淋巴结转移、治疗方式比较差异均无统计学意义(P>0.05)。 结果见表1、表2和表3。

表1 NLR0与ESCC患者临床特征间的关系Tab.1 Relationship between NLR0 and clinical characteristics of patients with ESCC 例(%)

表2 PLR0与ESCC患者临床特征的关系Tab.2 Relationship between PLR0 and clinical characteristics of patients with ESCC 例(%)

表3 PLR2与ESCC患者临床特征的关系Tab.3 Relationship between PLR2 and clinical characteristics of patients with ESCC 例(%)
2.4 ESCC患者PFS影响因素的单因素分析
59例患者的总体中位PFS为 9.33个月(95%CI:6.104~12.553)。低NLR0组患者的中位PFS显著长于高NLR0组,低PLR0组患者的中位PFS显著长于高PLR0组,低PLR2组患者的中位PFS显著长于高NLR2组,差异有统计学意义(P<0.05);Ⅱ期、Ⅲ期患者的中位PFS显著长于Ⅳ期患者,差异有统计学意义(P<0.05);无远处转移患者的中位PFS显著长于远处转移患者,差异有统计学意义(P<0.05)。患者的年龄、性别、手术、淋巴结转移及治疗方式与PFS无相关性(P>0.05)。 结果见表4和图3。

表4 ESCC患者PFS影响因素的单因素分析Tab.4 Univariate analysis of influencing factor for PFS of patients with ESCC

A:NLR0;B:PLR0;C:PLR2;D:远处转移;E:TNM分期。图3 不同NLR0、PLR0、PLR2、远处转移及TNM分期ESCC患者的生存曲线Fig.3 Survival curves of ESCC patients with different NLR0,PLR0,PLR2,distant metastasis and TNM stage
2.5 ESCC患者PFS影响因素的多因素分析
将NLR0、PLR0、PLR2、TNM分期及远处转移情况纳入Cox多因素回归,排除变量间的干扰因素后,NLR0、PLR2和远处转移是影响食管癌患者PFS的独立预测因素(P<0.05),而PLR0、TNM分期Ⅳ期对PFS无预测价值(P>0.05),见表5。

表5 ESCC患者PFS影响因素的多因素COX分析Tab.5 Multivariate COX analysis of influencing factor for PFS of patients with ESCC
3 讨论
近年来,食管癌的治疗策略发生了巨大变化,ICI的单药治疗或联合治疗已成为标准治疗方法之一。LUO等[7]研究发现,与单独化学治疗相比较,免疫治疗显著提高了食管癌患者的生存率,然而免疫治疗引发的严重不良事件和治疗中断率高于传统化学治疗。本研究结果显示,59例ESCC患者中,完全缓解0例(0.0%),部分缓解13例(22.03%),疾病稳定15例(25.42%),疾病进展31例(52.55%);说明,尽管ICI单药治疗或联合化学治疗已成为标准治疗方法之一,经 ICI 治疗后肿瘤可消退缓解,但仍有多数患者对ICI治疗不敏感。因此,考虑到免疫治疗的经济成本、存在的潜在不良反应和无效治疗导致疾病进展的可能,寻找预后判断的生物标志物以对患者进行精准免疫治疗至关重要。既往也有研究指出,TNM分期、淋巴结转移和远处转移等可评估食管癌患者的预后,但这些指标具有一定的滞后性[8-9]。
炎症是肿瘤微环境的重要特征之一,可为肿瘤微环境提供生物活性分子,是肿瘤进展的重要因素[10]。炎症细胞及其产生的细胞因子和趋化因子等可以影响整个肿瘤组织,参与调控肿瘤微环境中的肿瘤细胞、成纤维细胞和内皮细胞的生长、迁移和分化[11]。NLR、PLR作为中性粒细胞、血小板与淋巴细胞的比值,可以反映机体炎症平衡状态。本研究结果显示,高NLR0组Ⅳ期患者占比显著高于低NLR0组,高PLR0组Ⅳ期患者占比显著高于低PLR0组,高PLR2组Ⅳ期患者占比显著高于低PLR2组;说明,高NLR0、PLR0、PLR2的患者肿瘤临床分期较晚,高NLR、PLR患者处于较大肿瘤负荷状态或较长的慢性炎症过程。
目前,已有多项研究指出,NLR、PLR对食管癌、肺癌、胃癌、乳腺癌等多种肿瘤的预后具有重要的预测价值[12-15]。TEMPLETON等[16]通过荟萃分析得出,高基线NLR、PLR与实体瘤患者较短的PFS、OS相关。DIEM等[17]研究发现,免疫治疗前高NLR、PLR的非小细胞肺癌患者的PFS、OS较低NLR、PLR患者短。然而既往研究多是基于治疗前NLR、PLR进行分析,鲜有研究动态NLR、PLR变化与ICI治疗ESCC患者预后的关系。本研究结果显示,NLR0预测ESCC疾病进展的AUC为0.697(95%CI:0.560~0.834,P=0.005),灵敏度为67.7%,特异度为75.0%,最佳截断值为3.00;PLR0预测ESCC 疾病进展的AUC为0.740(95%CI:0.614~0.866,P<0.001),灵敏度为58.1%,特异度为82.1%,最佳截断值为187.75;PLR2预测ESCC疾病进展的AUC为0.724(95%CI:0.592~0.855,P=0.001),灵敏度为83.9%,特异度为60.7%,最佳截断值为152.21;说明,NLR0、PLR0、PLR2对ESCC患者疾病进展有一定预测价值。
此外,本研究通过单因素生存分析发现,低NLR0组患者的中位PFS显著长于高NLR0组,说明,ESCC患者的NLR0水平越高,预后越差。Cox多因素回归分析结果显示,与低NLR0水平相比,高NLR0水平显著增加了患者疾病进展的风险,NLR0是影响食管癌患者PFS的独立预测因素,其可作为评估ESCC患者预后的特异性生物标志物。这与KUTLU等[18]和GOU等[19]针对其他癌症的研究结果相近。同时,本研究结果显示,高NLR0组患者的远处转移率显著高于低NLR0组,与既往关于NLR与远处转移关系的结论一致[20];究其原因,可能是随着中性粒细胞增加,刺激白细胞介素-1和血管内皮生长因子的上调,促进肿瘤的进展与转移[21-22]。
血小板可通过激活信号通路,保护肿瘤细胞免受自然杀伤细胞介导的细胞裂解,并促进血管生成和远处转移,在肿瘤的发生发展中起重要作用[23-24]。PLR的升高在实体瘤患者中很常见,WU等[25]通过对比119例ESCC患者与818例无肿瘤患者的PLR水平发现,ESCC患者的PLR显著高于无肿瘤人群。PLR反映了机体炎症与抗肿瘤免疫之间的平衡状态,高PLR水平提示机体处于抗肿瘤免疫抑制状态,可促进肿瘤细胞的增殖,进而影响肿瘤患者的预后[2]。LIU等[26]研究发现,PLR水平是PD-1抑制剂治疗非小细胞肺癌患者的关键预后因素之一。此外,YODYING等[27]研究发现,高PLR水平食管癌患者的OS较短。本研究结果显示,低PLR0组和低PLR2组患者的中位PFS显著长于高PLR0组和高PLR2组,进一步多因素分析显示高PLR2是食管鳞状细胞癌患者PFS独立危险因素,提示低PLR0和低PLR2水平患者应用免疫治疗有更好的临床结局,且PLR2水平可作为评估ESCC患者预后的特异性生物标志物。
4 结论
NLR0、PLR0与PLR2是ICI治疗食管癌患者PFS的影响因素,高NLR0、PLR0、PLR2水平以及远处转移的患者可能较难从ICI治疗中获益,且NLR0与PLR2可作为ESCC患者免疫治疗预后的独立预测指标。但是,本研究为单中心研究,可能存在混杂因素和选择性偏倚,还需要更大样本量的前瞻性研究进一步验证。
