儿童髓母细胞瘤中基质Gla蛋白的表达及意义
2023-07-04李晶晶宋焕清冯晓霞霍志芳
李晶晶,宋焕清,冯晓霞,霍志芳
(郑州大学第二附属医院儿科,河南 郑州 450003)
髓母细胞瘤(medulloblastoma,MB)是儿童中枢神经系统最常见的、具有高度侵袭性的脑部恶性肿瘤,约占儿童颅内胚胎肿瘤的63%[1-2]。MB的肿瘤细胞易脱落并沿脑脊液循环途径扩散,导致患儿预后较差[3-7]。 目前,MB主要分为WNT、SHH、Group3 和 Group4 4种亚型,不同分型MB患儿的治疗方案和临床预后不同。基质Gla蛋白(matrix Gla protein,MGP)是一种相对分子质量为14 700的小蛋白,在软骨、动脉壁、心脏、肺、肾脏等组织中表达[8-10],MGP在肿瘤中的作用主要为促进血管生成及转移[11]。有研究发现,MGP在卵巢癌中低表达,MGP与免疫细胞浸润水平密切相关,MGP是影响卵巢癌患者预后的独立因子[12]。而其他肿瘤,如结肠癌、卵巢癌、胃癌[13]中也有MGP表达,MGP可能通过影响肿瘤细胞的增殖、迁移等参与肿瘤的发生发展,其有可能成为诊断肿瘤新的标志物或新的治疗靶点。但MGP在MB中的表达以及功能尚未有报道。本研究旨在观察MGP对MB细胞增殖、凋亡的影响,初步探讨MGP在儿童MB发病中的作用。
1 材料与方法
1.1 细胞、主要试剂与仪器
MB细胞Daoy购自中国科学院细胞库,MB细胞D341购自上海吉凯基因医学科技股份有限公司;达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、胎牛血清购自美国Gbico公司,双抗、放射免疫沉淀(radio-immunoprecipitation,RIPA)裂解液、细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自上海碧云天生物技术有限公司,RNA抽提试剂盒、反转录试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)试剂盒购自日本TaKaRa公司,Lipofectamine 3000转染试剂、增强型化学发光试剂盒购自美国Thermo Fisher公司,Western blot实验所用一抗及二抗购自美国CST公司,引物由上海生工生物工程有限公司合成;超净工作台、CO2培养箱、冷冻离心机购自美国Thermo Fisher公司,PCR仪购自美国ABI公司,流式细胞仪购自美国BD公司。
1.2 标本来源
收集2018年 1 月至2021年 12 月郑州大学第三附属医院手术切除并经病理学证实的14例MB患儿的肿瘤组织及配对癌旁正常组织。患者为首次入院未经过放化疗治疗,其中男10例,女4例;年龄2~15岁,中位年龄7岁。本研究经医院伦理委员会审核批准(人体组织批准号码:2018-015),患儿家属均知情同意。
1.3 方法
1.3.1 生物信息学分析
本研究通过高通量基因表达综合数据库(gene expression omnibus,GEO)筛选到2组MB基因芯片数据集GSE50161和GSE62600,然后分别筛选出2个数据集中差异表达基因,对2个数据集中表达上调的差异表达基因取交集,然后应用FunRich软件对差异基因进行富集分析,筛选出核心基因。
1.3.2 反转录PCR(reverse transcription PCR,RT-PCR)检测MB组织及癌旁正常组织中MGP、神经分化因子1(neurogenic differentiation factor 1,NEUROD1)、神经系统特异性转录因子(nescient helix-loop-helix 2,NHLH2) mRNA的表达
取14对MB癌组织和癌旁正常组织于液氮预冷的研钵中研磨成粉末,采用TRIzol法进行RNA提取和纯化。测量浓度后,将总RNA反转录为cDNA,以cDNA为模板进行扩增。以磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)为内参。MGP上游引物序列为 5′-CATCGTGCCCAGGAATCACA-3′, 下游引物序列为5′-GTGGACAGGCTTAGAGCGTT-3′;NEUROD1上游引物序列为 5′-GCTGCGAGATCCCCATAGAC-3′,下游引物序列为5′-AAATGGTGAAACTGGCGTGC-3′,NHLH2上游引物序列为 5′-CTCTTTGCTCTGGCTCTCCC-3′, 下游引物序列为5′-GTCAGTGGCTTGGAGATGCT-3′;GAPDH上游引物序列为5′-GTCAAGGCTGAGAACGGGAA-3′,下游引物序列为 5′-AAATGAGCCCCAGCCTTCTC-3′。扩增条件: 95 ℃ 变性 5 s,60 ℃ 退火30 s,连续进行40个循环。取5 μL PCR 扩增产物进行琼脂糖凝胶电泳,紫外线投射仪下观察电泳条带,采用2-△△Ct法计算MGP、NEUROD1、NHLH2 mRNA相对表达量。
1.3.3 Western blot法检测MB组织及癌旁正常组织中MGP蛋白表达
使用RIPA裂解液裂解14对MB癌组织和癌旁正常组织后检测MGP蛋白浓度,以Tubulin为内参。蛋白变性后进行聚丙烯酰胺蛋白电泳、常规转膜,再用体积分数5%脱脂奶粉室温封闭1 h,用含吐温-20的磷酸盐缓冲液洗膜3次后孵育一抗,4 ℃摇床过夜,第2天用含吐温-20的磷酸盐缓冲液洗膜3次后孵育二抗,室温摇床1 h,再次用含吐温-20的磷酸盐缓冲液洗膜3次,然后用化学发光液显影、定影,Image J软件分析条带的灰度值,并计算MGP蛋白相较于Tubulin的相对表达量。
1.3.4 细胞培养、转染及分组
将Doay和D341细胞复苏后,接种于含体积分数10%胎牛血清DMEM中,置于37 ℃、含体积分数5% CO2饱和湿度培养箱中培养,每2~3 d换液并传代培养。取对数生长期 Doay细胞和D341细胞,分别分为Doay空白组、Doay 小干扰RNA(small interfering RNA,siR)-MGP组和D341空白组、D341 siR-MGP组。然后接种于24孔板中继续培养,待细胞生长至融合度达到30%~50%时进行转染。用Lipofectamine 3000转染试剂和siR-MGP储存液配制成转染复合物,温室孵育15 min。将转染复合物逐滴加入Doay siR-MGP组和D341 siR-MGP组进行细胞转染。Doay siR-MGP组和D341 siR-MGP组细胞均转染siR-MGP,Doay空白组和D341空白组细胞不进行转染。转染6 h后更换新鲜培养液,继续培养细胞,24 h后收集4组MB细胞,进行后续实验。
1.3.5 CCK-8法检测4组细胞增殖情况
取各组转染后细胞,分别于转染24、48、72 h后,每孔加入10 μL的CCK-8试剂,在培养箱孵育 30 min,使用酶标仪检测波长450 nm 处吸光度值,以吸光度值表示细胞增殖能力,吸光度值越大表示细胞增殖能力越强。实验重复5次,取均值。
1.3.6 流式细胞术检测4组细胞凋亡情况
取各组转染后细胞,用预冷磷酸盐缓冲液(posphate buffered saline,PBS)洗涤1次,1 200 r·min-1离心5 min后重悬细胞,加入膜联蛋白V-异硫氰酸荧光素(Annexin V·fluorescein isothiocyanate,Annexin V-FITC)和碘化丙碇(propidium iodide,PI)各 5 μL,室温孵育15 min,1 200 r·min-1离心5 min后,再用PBS洗涤1次,4 h内用流式细胞仪检测细胞凋亡情况。
1.4 统计学处理

2 结果
2.1 生物信息学分析结果
GSE50161和GSE62600 2个数据集分别筛选出2 033个和18个差异表达基因(图1),其中表达上调基因分别为786个和9个(图2、图3),MGP、NEUROD1和NHLH2在2个数据集中均上调。RT-PCR检测结果显示,MGP mRNA在MB癌组织中上调最明显(图4),即MGP为相对核心基因。
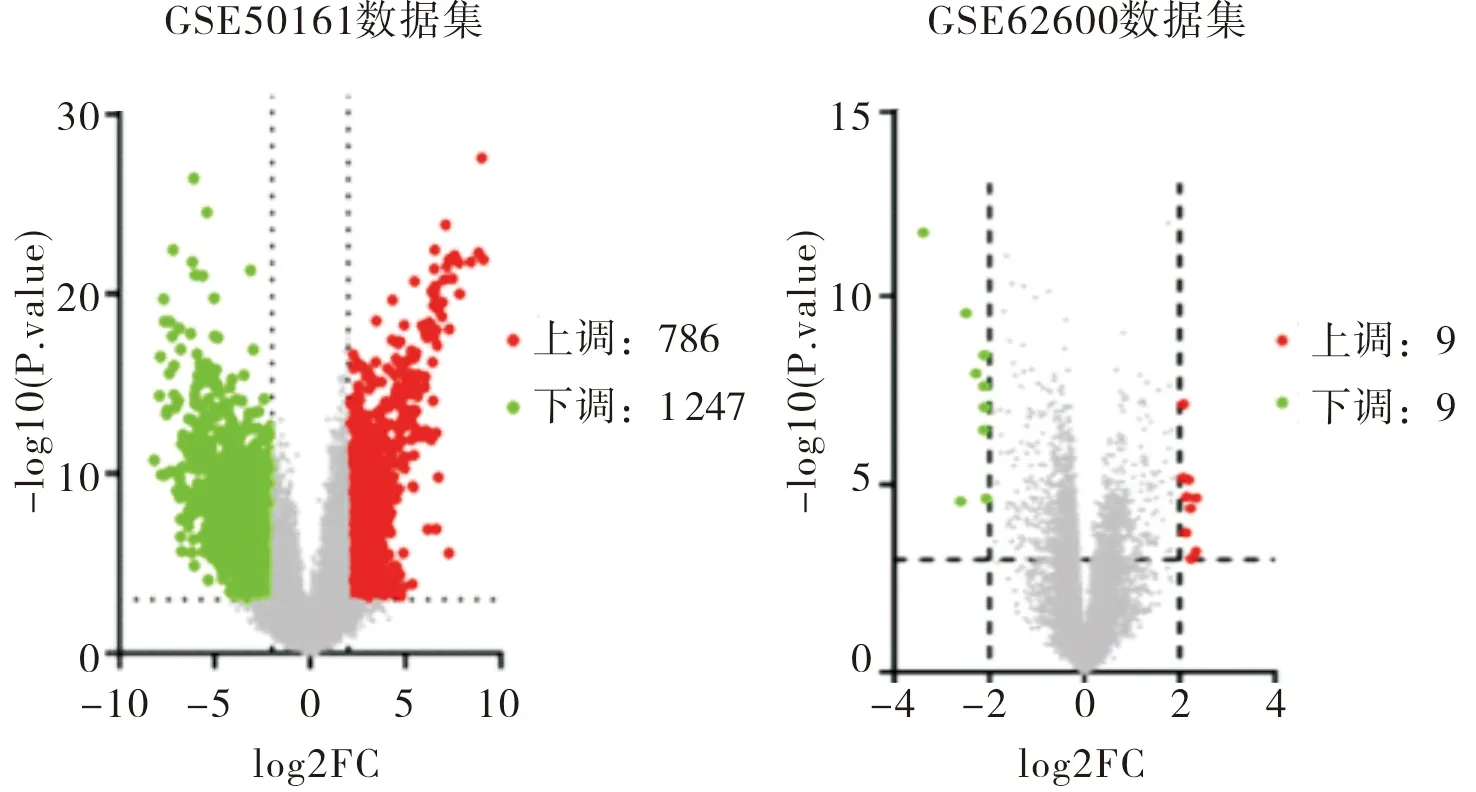
图1 GSE50161和 GSE62600数据集中mRNA的火山图Fig.1 Volcano plots of mRNA in GSE50161 and GSE62600 datasets

图2 GSE50161和 GSE62600数据集中上调的mRNA维恩图Fig.2 Venn diagram of upregulated mRNA in GSE50161 and GSE62600 datasets

图3 GSE50161和 GSE62600数据集中 MGP、NEUROD1、 NHLH2 mRNA的相对表达水平Fig.3 Relative expression levels of MGP,NEUROD1 and NHLH2 mRNA in the GSE50161 and GSE62600 datasets
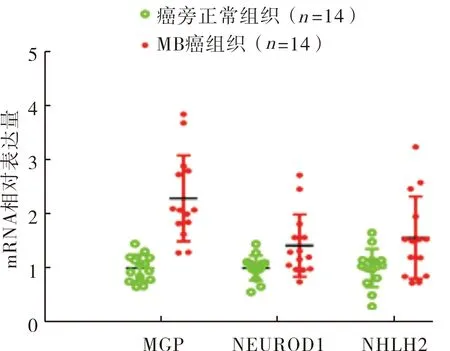
图4 14对MB癌组织和癌旁正常组织中MGP、NEUROD1、NHLH2 mRNA相对表达量Fig.4 Relative expression levels of MGP,NEUROD1 and NHLH2 mRNA in fourteen pairs of MB cancer tissues and adjacent normal tissues
2.2 MB癌组织和癌旁正常组织中MGP蛋白相对表达量比较
MB癌组织和癌旁正常组织中MGP蛋白的相对表达量分别为2.29±0.80、1.00±0.24,MB癌组织中MGP蛋白的相对表达量显著高于癌旁正常组织,差异有统计学意义(P<0.05),见图5。

N1~N14为14个癌旁正常组织,MB1~MB14为14个癌组织。图5 MB 癌组织和癌旁正常组织中MGP蛋白表达(Western blot)Fig.5 Expression of MGP protein in cancer tissues and adjacent normal tissues(Western blot)
2.3 4组MB细胞增殖能力比较
转染24、48、72 h时, Doay空白组细胞增殖能力显著高于Daoy siR-MGP组,差异有统计学意义(P<0.05),见表1;D341空白组细胞增殖能力显著高于D341 siR-MGP组,差异有统计学意义(P<0.05),见表2。
表1 Doay空白组与Doay siR-MGP组Doay细胞增殖能力比较Tab.1 Comparison of the proliferation of Doay cells between the Doay blank group and Doay siR-MGP group
表2 D341空白组与D341 siR-MGP组 D341细胞增殖能力比较Tab.2 Comparison of the proliferation of D341 cells between the D341 blank group and D341 siR-MGP group
2.4 4组MB细胞凋亡率比较
Doay siR-MGP组和Doay空白组细胞的凋亡率分别为(16.93±0.65)%、(7.04±0.51)%,D341 siR-MGP组和D341空白组细胞的凋亡率分别为(16.07±0.25)%、(7.24±0.53)%;Doay siR-MGP组细胞的凋亡率显著高于Doay空白组,D341 siR-MGP组细胞的凋亡率显著高于D341空白组,差异有统计学意义(P<0.05)。结果见图6。

A:Doay空白组;B:Doay siR-MGP组;C:D341空白组;D:D341 siR-MGP组。图6 4组细胞凋亡情况Fig.6 Apoptosis of cells in the four groups
3 讨论
MB是儿童中枢神经系统发病率较高的恶性肿瘤,其特点是生长迅速、易转移。MB 分为经典型和变异型(促纤维增生/结节型、弥散型结节型、间变型和大细胞型)[14]。目前,治疗MB的首选方法为手术切除,并辅以放化疗等综合性治疗。但过度放化疗对儿童听觉、认知、内分泌及血管系统造成的损害使得MB患儿的远期生存率较低。
MGP定位于12号染色体,是一种相对分子质量为14 700的小蛋白,MGP蛋白是维生素K依赖性蛋白家族成员。最早因其能抑制软骨和血管钙化而被人们所熟知。越来越多的研究表明,MGP在胶质细胞瘤、胃癌、骨肉瘤、结直肠癌等多种癌症中均呈异常表达,但其在各种癌症中的生物学功能并不一致[15-18]。研究发现,MGP的高表达提示骨肉瘤肺癌转移且预后不良[19],但TUO等[20]研究发现,MGP高表达乳腺癌患者的生存结局更好。MGP在MB细胞内的生物学功能及作用机制至今未见报道。
本研究从GEO高通量基因数据库中已报道的MB基因芯片数据集着手,从GSE50161和 GSE62600 2个数据集中共筛选出2 033和18个差异表达基因,在2个数据集中表达均上调的基因只有3个,分别为MGP、NEUROD1和NHLH2。通过RT-PCR检测14例MB癌组织及癌旁正常组织中上述3个基因的mRNA相对表达量,证实了MGP在MB癌组织中高表达。为了揭示 MGP 在 MB 细胞中的作用和机制,本研究通过细胞转染,敲低了MGP 在 MB 细胞系 DAOY 和 D341中的表达,结果发现,敲低MGP可抑制MB细胞的增殖;敲低MGP还可促进MB细胞早期凋亡的发生;提示MGP可能参与MB的发生和发展过程,但本研究样本量较小,尚不足以证明MGP可以作为MB的生物标志物,有待增加样本量进一步证实。
4 结论
本研究证实了MGP在MB中高表达,下调MGP可以抑制MB细胞增殖、促进其凋亡。但关于MGP下游调控机制,本研究未深入探讨,这将作为本课题组接下来继续研究的内容。
