酸体系下改良分散固相萃取用于茶叶农残快速检测的前处理技术
2023-07-03吴正浩郑芹芹郝振霞王晨陈红平鲁成银
吴正浩,郑芹芹,郝振霞,王晨,陈红平,鲁成银
1. 中国农业科学院茶叶研究所,浙江 杭州 310008;2. 农业农村部茶叶质量安全控制重点实验室,浙江 杭州 310008;3. 农业农村部茶叶产品质量安全风险评估实验室(杭州),浙江 杭州 310008;4. 中国农业科学院研究生院,北京 100081
农药残留是茶叶质量安全首要关注因子,亦是阻碍我国茶叶出口贸易的主要风险因子。灵敏可靠的农药残留快速检测是契合检测时效性、降低筛查成本和保障茶叶质量安全的有力手段。酶抑制农残速测卡、免疫分析试纸条等农残快速检测技术和产品已经广泛应用于农产品检测中。但是,这些方法和产品在茶叶实样检测中往往表现出极高的假阳性率,严重限制了其在茶叶检测中的应用。基质干扰是造成检测假阳性的最主要原因。茶叶中含有丰富的茶多酚、嘌呤碱、植物色素、芳香物质等基质成分[1]。这些成分不仅可以改变检测体系的颜色影响信号采集和结果辨别,更重要的是它们大多数具有生物活性,极易对快速检测中使用的生物试剂(如胆碱酯酶、抗体等)性能产生影响,造成检测失败,严重影响了快速检测方法的准确性与有效性[2-3]。以酶抑制法为例,茶叶中大量存在的咖啡碱和茶多酚会抑制乙酰胆碱酯酶的活性,导致检测时出现假阳性的结果[4-6]。另外,没食子酸和天冬氨酸等内源酸性物质通过破坏金属粒子-抗体复合物的稳定性,导致胶体金免疫分析试纸条无法用于检测茶叶样品[7]。
虽然目前分散固相萃取等前处理方法在茶样的色谱、色谱-质谱联用等仪器检测中应用已经较为成熟,但是这些方法对茶样基质的去除率普遍较低,处理后的待测样品中仍含有大量茶多酚、咖啡碱等基质成分,因而无法直接应用于对基质敏感的农药残留快速检测[8]。开发一种去除效率高、选择性好的茶叶基质去除方法,对提高农药残留快速检测结果的可靠性、保障茶叶质量安全具有重要意义。
前期研究发现,咖啡碱、茶多酚和氨基酸是茶叶农药残留残快速检测基质干扰的最主要来源[8],特别是咖啡碱和茶多酚对快速检测的干扰最为显著。由于咖啡碱在水与常见有机溶剂中均易溶解,且其难以被实验室常见净化材料吸附,咖啡碱干扰成为农药残留快速检测需要攻克的一大难题。分子印迹技术通过构建与咖啡碱分子匹配的作用位点,能够一定程度上特异性吸附咖啡碱[9-10]。然而,吸附容量小、模板构建复杂等短板因素限制了其在茶叶前处理中的应用。聚乙烯聚吡咯烷酮(PVPP)侧链羰基与多酚质子之间易成氢键,因而对多酚类物质具有较强的特异性吸附[11-14],是茶叶样品前处理开发的理想吸附剂。目前茶叶中氨基酸的分离大多采用阳离子树脂交换、超滤膜富集等方法[15],试验成本及操作难度相对较高。
本研究针对农药残留快速检测对茶叶基质高效去除的需求,拟根据目标基质成分的分子结构开发特异性去除方法,建立一种简单、高效、高选择性的茶叶样品前处理方法。该方法在酶抑制法农药残留快速检测中的成功应用,将实现茶叶中农药残留的快速、灵敏、可靠检测。
1 材料与方法
1.1 材料与试剂
表没食子儿茶素(EGC)、儿茶素(C)、表儿茶素(EC)、表没食子儿茶素没食子酸酯(EGCG)、表儿茶素没食子酸酯(ECG)均购自上海安谱实验科技股份有限公司,咖啡碱购自德国Dr.Ehrenstorfer 公司,PVPP、乙酰胆碱酯酶(AChE,电鳗鱼C3389,EC 3.1.1.7)均购自美国Sigma-Aldrich 公司,磷酸盐缓冲液(PBS)片剂、三羟甲基氨基甲烷(Tris)购自美国Amresco 公司,牛血清白蛋白(BSA)购自北京宝如亿生物技术有限公司,无水Na2HPO4、无水KH2PO4购自上海源叶生物科技有限公司,N-丙基乙二胺硅烷(PSA)购自美国安捷伦科技有限公司,石墨化炭黑(GCB)购自天津博纳艾尔杰公司。色谱级乙酸乙酯、乙腈、甲酸、甲酸铵均购自德国Merck 公司,NaCl 购自浙江华东医药有限公司。12 种农药标准品(纯度≥96%)分别购自德国Dr.Ehrenstorfer 公司、天津农业农村部环境保护科研检测所和天津阿尔塔科技有限公司。Whatman No.1 滤纸购自英国Maidstone 公司,高灵敏度农残速测卡购自广东达元绿洲食品安全科技股份有限公司,靛酚乙酸酯(IPA)根据文献[16]中方法于实验室合成。
1.2 仪器与设备
Waters 2695 高效液相色谱仪,美国Waters有限公司;API 3200 型串联三重四极杆质谱仪,美国AB SCIEX 公司;SYKNBM 氨基酸自动分析仪 S-433D,德国 Sykam 公司;ColorQube 8580 蜡印打印机,日本FujiXerox有限公司;Perfection V550 Photo 扫描仪,日本EPSON 有限公司。
1.3 茶叶样品
有机绿茶样品来自农业农村部茶叶产品质量安全风险评估实验室。
1.4 试验方法
1.4.1 茶叶样品前处理
茶叶样品经过粉碎后,称取0.5 g 样品加入2.5 mL 1.5 mol·L-1H2SO4和500 mg PVPP,混匀静置2 min 后加入2.5 mL 乙酸乙酯,涡旋2 min,以4 500 r·min-1离心5 min。取1 mL上清液加入5 mL PBS 缓冲液(400 mmol·L-1,pH 8.0)调节pH。移取0.5 mL 上清液至含有PSA、GCB 的离心管中,混匀静置后备用。前处理过程如图1 所示。
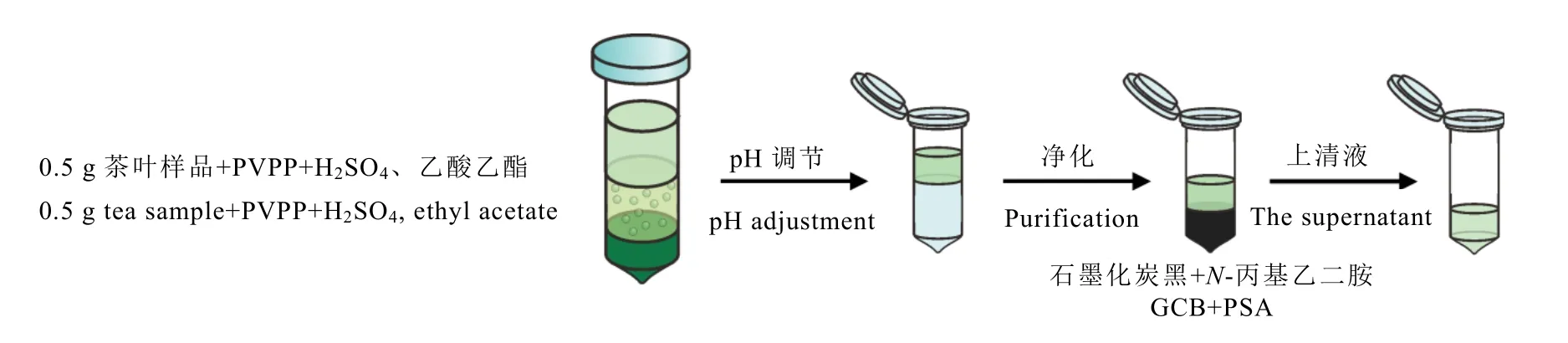
图1 前处理方法应用于茶叶基质成分特异性去除的方案Fig. 1 The scheme of tea matrix component removal by the established pretreatment method
1.4.2 提取液组分测定
采用液相色谱测定儿茶素和咖啡碱含量,色谱柱选择C18柱。流动相A 相为乙腈,B 相为含0.1%(V∶V)甲酸的水溶液。梯度洗脱程序:0~16.0 min,100% A;16.0~20.0 min,100%~25%A;20.0~25.0 min,25% A;25.0~25.5 min,25%~100% A。流速1 mL·min-1,进样体积10 μL。
采用氨基酸分析仪进行氨基酸含量的测定,树脂柱选择Na+型磺酸基强酸性阳离子交换树脂。仪器条件如下:显色剂为茚三酮,进样量10 μL,流速0.45 mL·min-1。
1.4.3 基于微流控纸芯片(μPADs)的克百威农药残留快速检测方法
采用本课题组前期制备的微流控纸芯片,并用于农残快速检测[17]。具体检测方法如下:将1.10 μL 样品溶液依次滴加在各检测区中央,室温条件下静置5 min 后在相同位置滴加1.10 μL 100 U·mL-1AChE(含有0.1% BSA)。37 ℃孵育10 min 后,在芯片中央加入25 μL 3 mmol·L-1IPA 溶液,从液体进入通道开始计时,7 min后扫描并保存结果。利用Photoshop 软件提取扫描文件中各检测区的颜色强度信号。
使用Origin 软件的Hill 1 方程拟合纸芯片信号强度与样品溶液中农药浓度的关系,建立对应农药的校正曲线,并计算半抑制浓度(IC50)。样品回收率计算公式如下:
式中,c1表示加标茶样中的农药检出浓度,c0表示相应样品中的加标浓度。
1.4.4 基于速测卡的灭多威农药残留快速检测方法
根据高灵敏度农药速测卡说明书开展试验,移取80 μL 氮吹复溶的提取液滴于白色酶片(即速测卡),将速测卡置于便捷式农药残留速测仪中孵育。10 min 后对折速测卡,反应3 min 后,根据颜色深浅判定结果。
1.4.5 UPLC-MS/MS 条件
色谱条件:色谱柱为 Waters ACQUITY HSS T3(100 mm×2.1 mm,1.8 μm)。流动相,A 相为含0.1%(V∶V)甲酸+1 mmol·L-1甲酸铵的水溶液,B 相为含0.1%(V∶V)甲酸+1 mmol·L-1甲酸铵的甲醇溶液。梯度洗脱程序:0~1.0 min,90% A;1.0~3.0 min,90%~0% A;3.0~10.0 min,0% A;10.0~10.1 min,0%~90%A;10.1~12.0 min,90% A。流速0.25 mL·min-1,柱温40 ℃,进样体积3.0 μL。质谱条件:采用电喷雾正离子扫描方式(ESI+),气帘气(Curtain gas)压力20 psi,碰撞气(Collision gas)压力5 psi,喷雾电压5 500 V,离子源温度500 ℃,雾化气(GS1)压力50 psi,辅助气(GS2)压力50 psi。碰撞能量(CE)、去簇电压(DP)、定性与定量离子对等参数见表1。
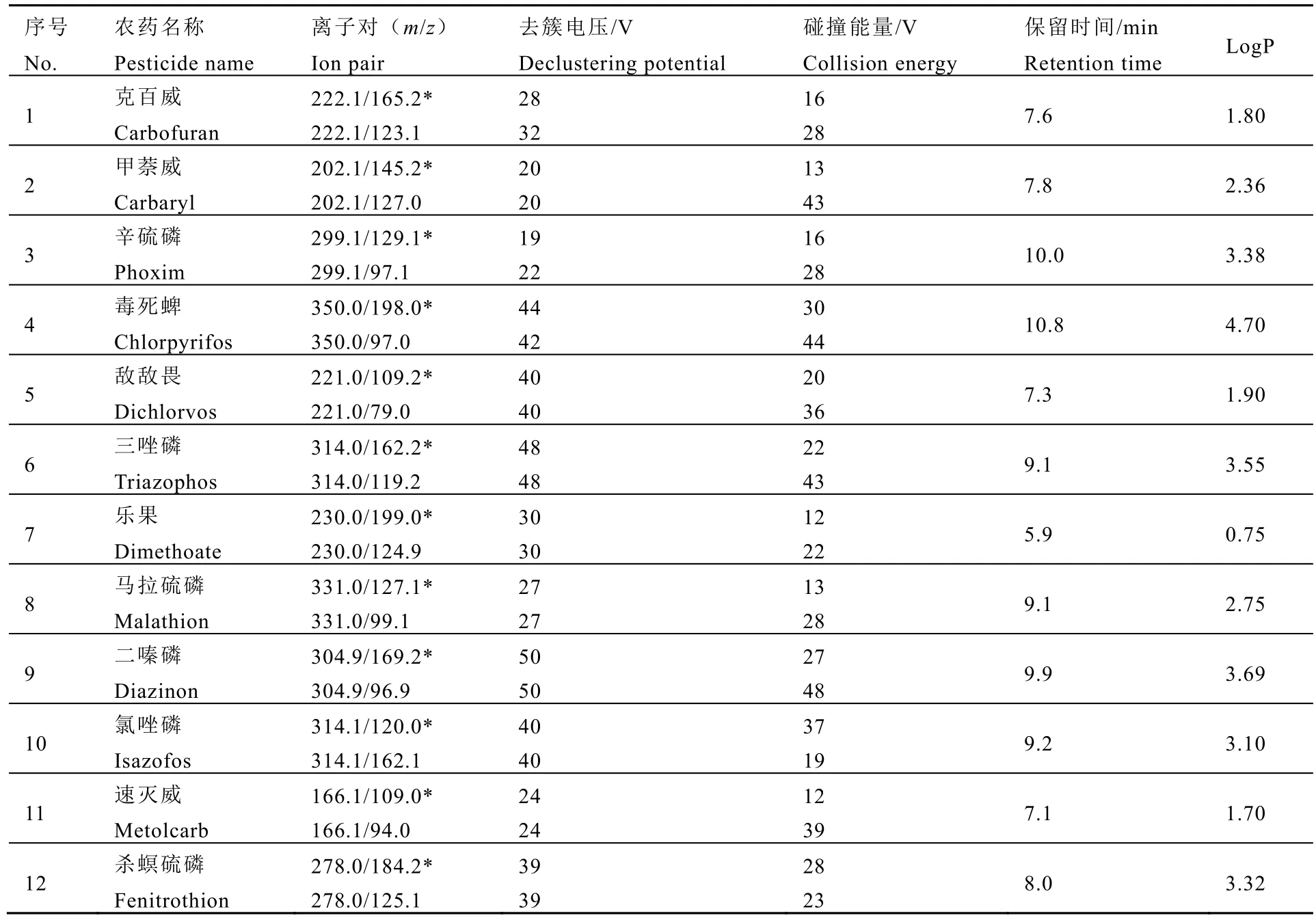
表1 12 种农药的质谱条件参数和LogP 值Table 1 The MS parameters and LogP of 12 pesticides
2 结果与分析
2.1 茶叶农药残留快速检测前处理方法优化
2.1.1 咖啡碱的特异性去除
咖啡碱是干扰农药残留快速检测结果的主要茶叶基质成分之一,本研究从其分子结构特征角度入手开发特异性去除方法。咖啡碱分子中存在2 个酰胺氮原子,其中1 个呈弱碱性,另1 个碱性极弱且接近弱酸性。由于弱碱性酰胺氮原子在酸性条件下易捕获质子而离子化,故尝试采用酸溶液处理并结合有机溶剂浸提的方式来减少提取液中的咖啡碱含量。
在H2SO4电离产生的H+作用下,咖啡碱中酰胺基团被离子化。在水相溶液中,带正电荷的离子型咖啡碱可在硫酸根阴离子的电荷相互作用下保持稳定。随着H2SO4浓度的提高,水相中咖啡碱的电离平衡逐渐向生成离子的方向移动,促使有机相中咖啡碱分子经重新分配后进入水相,进而实现乙酸乙酯层中咖啡碱含量降低。在当前提取条件(V酸液∶V乙酸乙酯=1∶1)下,与纯水浸提相比,H2SO4浓度达到1.5 mol·L-1时,乙酸乙酯中的咖啡碱含量下降95%以上。进一步增加酸液浓度,咖啡碱去除率无明显变化(图2)。考虑到高浓度硫酸对试验操作的潜在风险,选择 1.5 mol·L-1H2SO4溶液作为咖啡碱去除的最佳条件。

图2 不同浓度H2SO4 处理下茶叶样品中咖啡碱的去除率Fig. 2 Caffeine removal rate in tea samples after the addition of different H2SO4 concentrations
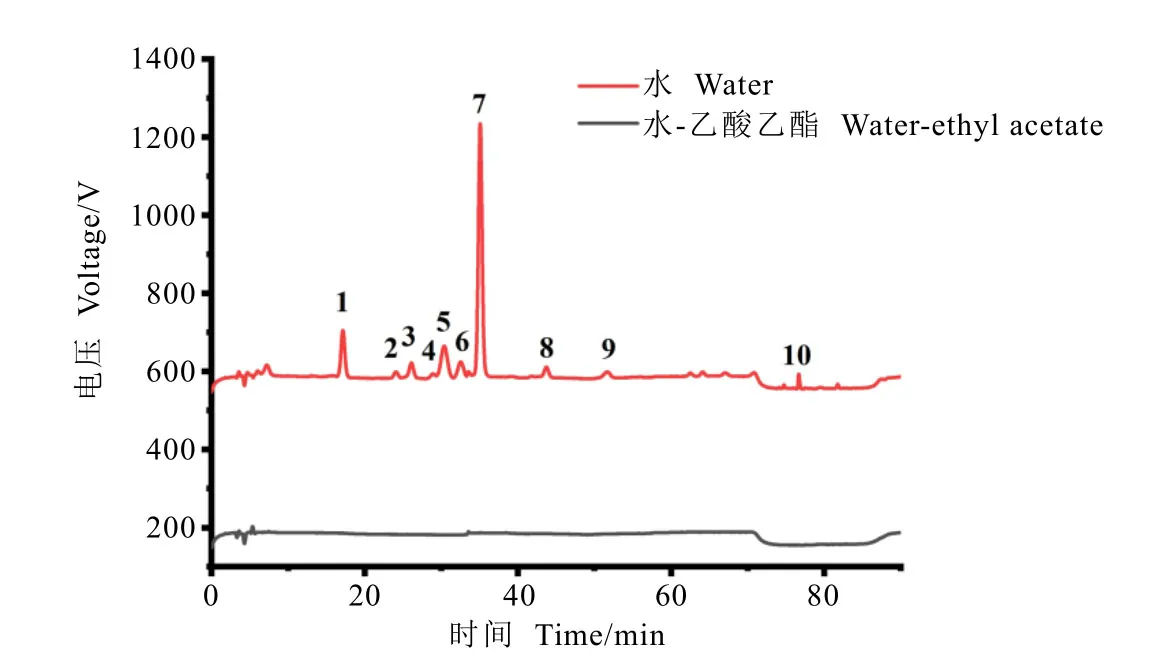
图3 不同提取方法对氨基酸去除效果的色谱图Fig. 3 Chromatography of amino acid removal by different extraction methods
2.1.2 氨基酸的特异性去除
茶叶中普遍存在的各种氨基酸成分对农药残留快速检测结果的影响不可忽视。目前开发的氨基酸分离方法大多基于水相溶液[18-19],不适合直接应用在以有机相为主的农残提取条件中。本研究借助氨基酸在水相中溶解度远高于有机相的特点,尝试运用2.1.1 章节中开发的酸液结合乙酸乙酯浸提的方法降低提取液中的氨基酸含量。
取干茶样品经乙酸乙酯提取前后的样品溶液,分析其氨基酸含量,结果如图3 所示。仅用水浸提时,提取液中检测到多种氨基酸组分,其中茶氨酸含量达到142.58 mg·L-1。经乙酸乙酯处理后,有机相中氨基酸含量在仪器检出限以下,表明应用前述开发的酸性水-乙酸乙酯提取方法可直接实现氨基酸的高效去除。
2.1.3 茶多酚的特异性去除
由于茶多酚与 PVPP 材料间容易形成分子间氢键,PVPP 可特异性去除提取液中的多酚类物质[13-14]。本研究将PVPP 作为去除茶叶内源性多酚的专一性吸附剂,优化其使用量。
试验中在茶叶样品前处理中加入吸附剂,分析 PVPP 用量与不同儿茶素组分去除率之间的关系。由表2 可知,与酯型儿茶素(EGCG和ECG)相比,相同用量条件下非酯型儿茶素(EGC、C、EC)的去除效果较好。以使用量50 mg·mL-1PVPP 为例,非酯型儿茶素去除率( 53.7%~61.4%) 约为酯型儿茶素(15.5%~28.3%)的2 倍。徐悦[20]分析经PVPP处理的茶汤(水相)后,认为羟基数量多的酯型儿茶素更容易被吸附去除。从分子结构角度分析,非酯型儿茶素的基团亲水性强,在两相分配中更倾向于水相。本研究以乙酸乙酯层(有机相)中儿茶素组分为分析对象,故检测到的非酯型儿茶素去除率较高。此外,非酯型儿茶素的分子量一般小于酯型儿茶素,符合PVPP 优先结合并去除较小分子量酚类物质这一特点[21]。

表2 PVPP 处理后茶叶样品中儿茶素的去除率Table 2 Removal rates of catechins from tea samples after PVPP addition
随着PVPP 使用量增多,儿茶素被吸附并去除的比例逐渐增加。尤其是使用量由 100 mg·mL-1增加到200 mg·mL-1时,酯型儿茶素去除率大幅提高,随之变化幅度趋缓。考虑处理成本、去除效率与操作难度等因素,确定200 mg·mL-1PVPP 使用量作为茶多酚类物质去除的最佳条件。
2.1.4 茶叶样品前处理方法开发与评价
在前述优化的特异性去除条件下,建立了适用于茶叶样品的前处理方法。茶叶样品经1.5 mol·L-1H2SO4浸泡,在200 mg·mL-1PVPP条件下采用乙酸乙酯提取,提取液经pH 调节后加入100 mg·mL-1GCB、200 mg·mL-1PSA,取出上清液用于检测(图1)。
选取直接浸提与前处理后的试液,利用色谱分析评估基质成分去除效果。由图4A 可知,样品经本方法前处理后咖啡碱和茶多酚(EGC、C、EC、EGCG、ECG)含量均接近或低于色谱仪器的检出限水平。与直接浸提相比,提取液中对应的基质成分去除率均大于99.99%,表明该前处理方法可有效降低目标基质成分含量。

图4 经前处理后茶叶样品中儿茶素和咖啡碱的去除效果Fig. 4 Removal of catechins and caffeine from tea samples after pretreatment
分别在空白茶叶样品中添加12 种有机磷与氨基甲酸酯类农药,通过加标回收试验,分别考察本方法对农药回收率的影响(图5)。在2.5 mg·kg-1的农药加标浓度下,目标农药的回收率均在64.5%~116.9%,相对标准偏差(RSD)在3.29%~19.38%(n=3)范围。因此,综合基质成分去除效果和农药加标回收结果两方面考虑,该前处理方法具有高效、高选择性净化茶叶基质的能力,有望满足茶叶农残快速检测的分析需求。

图5 12 种农药经前处理后的回收率Fig. 5 Recoveries of 12 pesticides by the current pretreatment method
2.2 前处理方法在茶叶农药残留快速检测中的应用
2.2.1 酶抑制法
茶叶基质成分会显著干扰μPADs 上酶抑制法的检测信号,即使痕量的EGCG、咖啡碱等基质也会导致严重的农残检测假阳性结果(图6)。氨基甲酸酯类农药在茶叶中检出与受关注程度较高,因此本研究选择克百威和灭多威两种典型的氨基甲酸酯类农药作为模型,分别采用酶抑制法与速测卡法进行检测,验证本方法的实用性。利用2.1 章节开发的方法进行空白茶样前处理,并用提取液配制克百威工作液测定工作曲线,结果如图7 所示。克百威浓度与芯片上感应区的颜色信号呈负相关,定量关系符合Hill 1 方程。利用建立的工作曲线,所有芯片的校正决定系数(Adj.R2)均大于0.93,以半抑制浓度计算该方法对茶提取液中克百威的检出限为(0.113±0.001)mg·L-1(n=3),即对应茶样中克百威的检出限为(0.565±0.005)mg·L-1(n=3)。在绿茶样品中添加0.75 mg·kg-1水平的克百威标准品,进行加标回收试验,回收率为(92.65±2.17)%(RSD=2.35%,n=3)。

图6 茶叶中典型基质成分对μPADs 上酶抑制法检测信号的影响Fig. 6 The effect of typical matrix components in tea on the signal of enzyme inhibition method based on μPADs
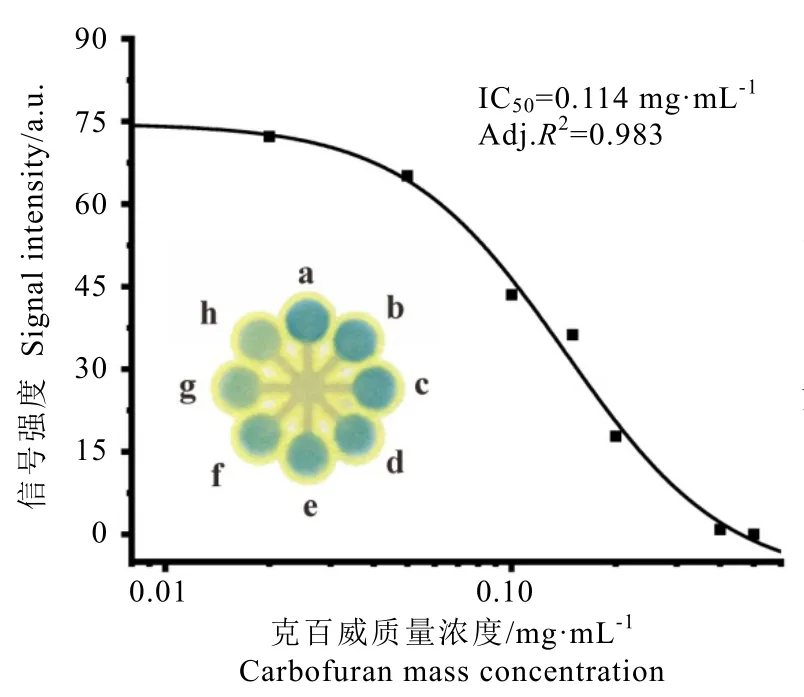
图7 克百威的基质标准工作曲线Fig. 7 Dose-response curves for carbofuran detected by the enzyme inhibition method
2.2.2 速测卡法
茶叶中内源性基质成分对农残速测卡的可靠检测提出了巨大的挑战。茶叶样品经水提取时,农药残留速测卡对其检测的结果呈现明显的假阳性。经前处理后,提取液中的茶叶基质成分得到有效去除,速测卡对空白提取液的检测结果表现为阴性。当茶样中灭多威的浓度提高至0.20 mg·kg-1时,检测结果可被肉眼识别为阳性(表3),表明前处理过程有效提高了农残速测卡在茶叶中应用的可靠性。

表3 基质去除前后与灭多威加标浓度的速测卡检测结果Table 3 The results of rapid test card with different methomyl spiked concentrations before and after pretreatment
3 结论
本研究以茶叶农药残留快速检测的实际需求为导向,针对样品典型基质成分的分子结构特征设计去除流程,开发了一套基质去除效率高、特异性强的茶叶前处理方法。与纯水浸提相比,该方法对茶样提取液中目标基质的去除率达到99.99%以上,结合酶抑制农药残留快速检测技术实现了对茶叶中以克百威、灭多威为代表的农药残留快速、灵敏、可靠检测。本方法基质去除效果好、适用性广、操作便捷,可以显著降低农药残留快速检测茶叶样品的基质干扰,满足对茶叶基质敏感的快速检测方法的需求。
