一种基于儿茶素的多酚氧化酶交联聚集体制备及其高效催化合成茶黄素-3,3′-双没食子酸酯研究
2023-07-03周晶辉刘昌伟张盛许岗胥伟黄建安刘仲华
周晶辉,刘昌伟,张盛,许岗,胥伟,黄建安,刘仲华*
1. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;3. 植物功能成分利用省部共建协同创新中心,湖南 长沙 410128;4. 农业农村部园艺作物基因资源评价利用重点实验室,湖南 长沙 410128;5. 医药工业用酶技术国家地方联合工程研究中心湖南福来格生物技术有限公司,湖南 长沙 410100;6. 精制川茶四川省重点实验室,四川 宜宾 644000
茶黄素(Theaflavin,TFs)是红茶中重要的色素,对红茶风味品质形成贡献巨大[1]。在红茶发酵过程中,不同类型的儿茶素(儿茶酚型和邻苯三酚型)被多酚氧化酶(PPO:儿茶酚氧化酶;酪氨酸酶;漆酶)氧化形成邻醌,邻醌不稳定,会自缩合和脱碳形成不同的 TFs(图1)[2]。红茶中主要的 TFs 是茶黄素(Theaflavin,TF1)、茶黄素-3-没食子酸酯(Theaflavin 3-O-gallate,TF-3-G)、茶黄素-3′-没食子酸酯(Theaflavin-3′-O-gallate,TF-3′-G)和茶黄素-3,3′-没食子酸酯(Theaflavine-3,3'-digallate,TFDG)。
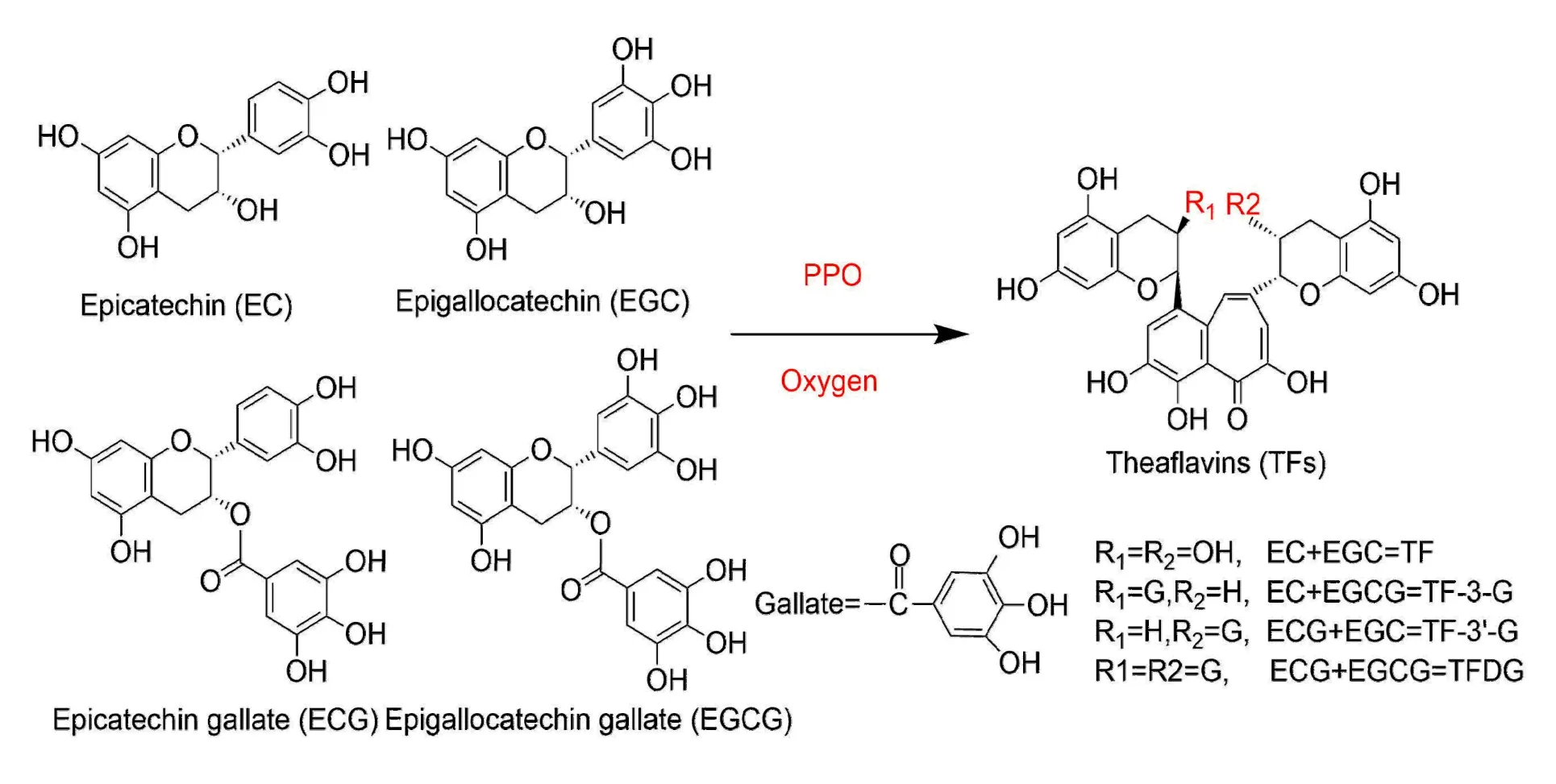
图1 茶黄素的形成过程Fig. 1 Theaflavin formation process
大量研究表明,TFs 特别是TFDG,对人体许多方面具有健康功效。其中包括保护心肌细胞[3],抑制癌细胞增殖[4-5],发挥抗炎作用[6],抗氧化作用[7],预防骨质疏松症等[8]。由于TFs存在的药用特性和健康益处,开发TFs 及其衍生物具有非常广阔的商业前景。由于TFs 仅占红茶干重的2%~6%[9],直接从红茶中提取成本高昂,而采用当代生物技术,开发固定化的多酚氧化酶重复多批次的酶促合成TFDG 是一种高效、经济且最具工业化应用前景的方法[10]。
交联酶聚集体(CLEAs)是荷兰 Roger Shelldon 教授在2000 年提出的一种新型无载体固定化技术[11]。CLEAs 的制备分为以下几步:首先,通过微生物发酵或组织提取获得液态粗酶蛋白;其次,将沉淀剂(如硫酸铵、有机溶剂、非离子聚合物和其他沉淀剂)添加到含有酶的水溶液中,使酶蛋白通过非共价键形成超分子结构-不可溶的物理聚集体,从而产生粗酶聚合[12];第三步,以戊二醛为交联剂,将酶物理聚合体共价连接,形成CLEAs(图2A),酶聚集体通过游离氨基与戊二醛的两个醛基之间的共价键不可逆结合。
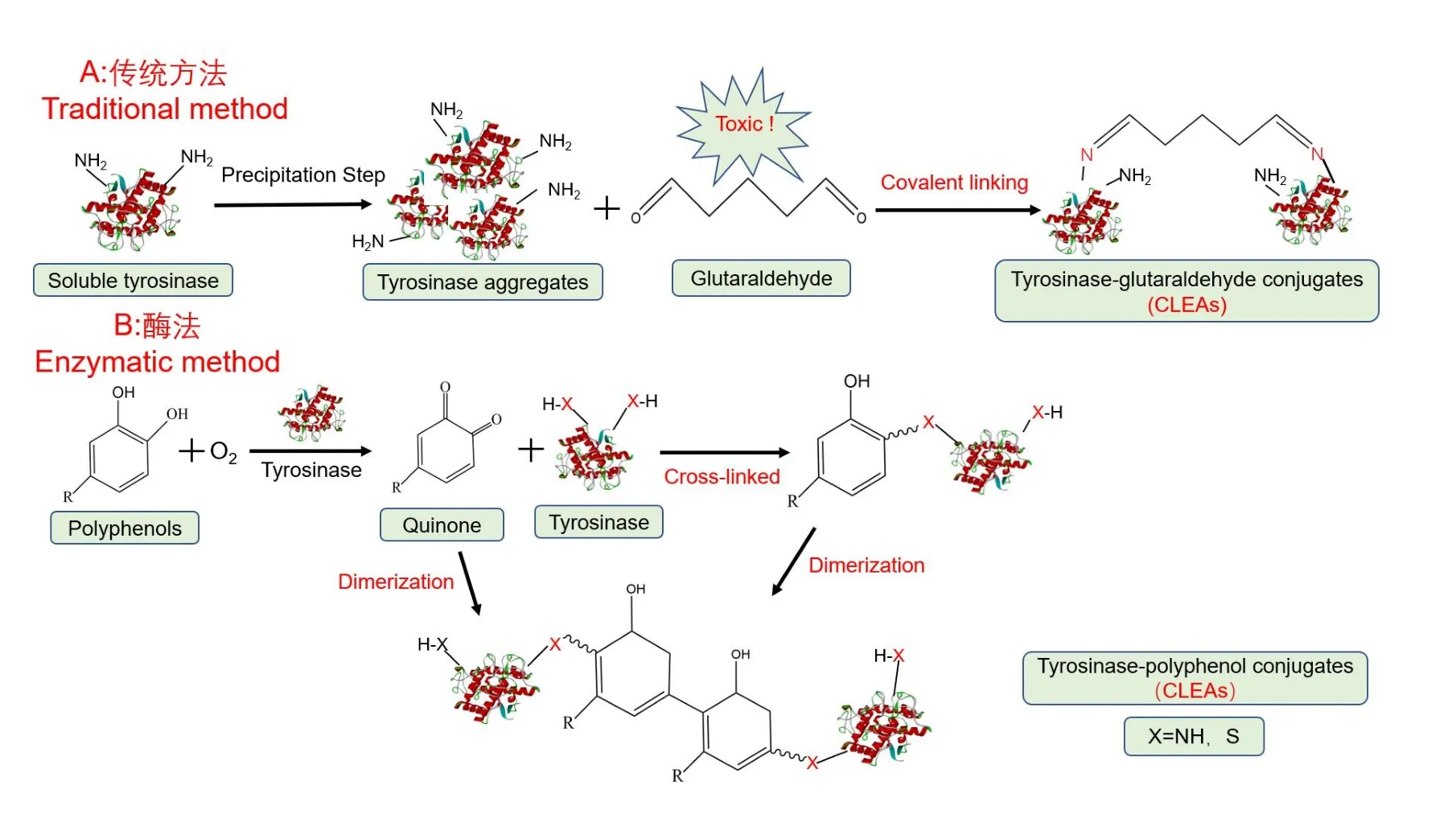
图2 传统交联方法和酶交联方法示意图Fig. 2 Schematic diagram of traditional and enzymatic cross-linking methods
诸多研究表明,CLEAs 与游离酶相比具有更好的性能,如更高的催化活性,更好的热稳定性和可回收性等[13]。使用这种方法,已经开发了多种CLEAs 的固定化酶,如用漆酶和酪氨酸酶结合形成CLEAs,能将废水中的对乙酰氨基酚转化为酚类化合物[14];脂肪酶B的CLEAs 可以高效合成奥伐尼[15];黑曲霉脂肪酶CLEAs 的制备,可增强其在有机溶剂和水溶剂中的活性[16];酪氨酸酶CLEAs 在有机溶剂和离子液体中的活性和稳定性都有明显的提升[17];此外,蘑菇酪氨酸酶CLEAs 被用作催化剂,可以以L-酪氨酸为底物制备L-3,4-二羟基苯丙氨酸(L-Dopa)[18]。上述传统的CLEAs 制备方法都需要用到交联试剂戊二醛,该化学试剂有毒且对环境不友好。儿茶素是茶叶中的一类天然产物,可与蛋白质形成非共价和共价相互作用[14,19](图2B)。非共价相互作用包括氢键、疏水相互作用、范德华力和离子相互作用[20]。这些相互作用通常是可逆的,并且比共价相互作用弱[21]。共价键是指多酚在碱性条件下(pH>9.0)或有氧存在的酶催化下容易氧化形成醌或半醌自由基。这些醌或半醌中间体很容易与蛋白质的亲核基团(如赖氨酸、半胱氨酸和色氨酸)发生反应[22],并能在蛋白质和多酚氧化产物之间形成共价交联(C-N 或C-S)络合物聚集体[19]。茶多酚与蛋白质之间形成的共价键是通过席夫碱和迈克尔加成反应进行。因此,我们认为儿茶素可以作为天然交联剂用于CLEAs 的制备。
本研究采用儿茶素作为蛋白交联试剂,对CLEAs 制备的条件进行了优化,并对CLEAs和游离酶的性质进行了研究,以及对TFDG 的催化验证,以期为茶黄素的工业化生产提供低成本和更高效的制备方法。
1 材料与方法
1.1 材料与试剂
含有巨大芽孢杆菌来源的酪氨酸酶突变体[基因登录号:MN509467.1,载体pET30a-Bmtyrc/BL21(DE3)]工程菌株为本实验室前期构建保存[23]。本试验中所用试剂均(分析纯)采购自中国国药集团有限公司。蛋白分离纯化用试剂盒购买于QIAGEN 公司。儿茶素单体为湖南三福生物技术有限公司馈赠,纯度98%以上的TFDG 标准品采购于阿拉丁试剂有限公司(上海)。
1.2 液态酶的制备与活性分析
从-80 ℃冰箱中取出酪氨酸酶突变体重组菌株划线活化,按照文献[23]中所述方法进行菌株的发酵、目的蛋白的表达与分离纯化、蛋白浓度及其活性测定。其中酪氨酸酶的活性检测参考文献[24]方法并做了适当的修改,具体的反应体系如下:反应底物用 0.1 mol·L-1pH 7.0 的磷酸缓冲液充分溶解1 mmol·L-1的L-Dopa(添加0.1 mmol·L-1Cu2+),在1.5 mL的EP 管中分别加入450 μL 的底物溶液和50 μL的酶溶液,轻微混匀后,于30 ℃反应5 min,然后加入 50 μL 20%的三氯乙酸溶液终止反应,12 000 r·min-1离心5 min,取适量上清液于475 nm 处进行OD 值检测,以未加酶液的样品作为空白对照。在上述条件下,以每分钟吸光值变化为0.01 的数值定义为1 个单位。TFDG 的检测方法参考文献[23]中方法执行。
1.3 酪氨酸酶交联聚集体(CLEAs)的制备与参数优化
选择不同质量浓度(0、0.2、0.5、1、2、4、6、8、10 mg·mL-1)的儿茶素(EC、ECG、EGC、EGCG)作为交联剂进行CLEAs 的制备,酪氨酸酶的交联反应在1.5 mL 的EP 管中进行,依次加入不同浓度的儿茶素溶液450 μL(pH 7.0 0.1 mol·L-1磷酸盐配制),酪氨酸酶溶液50 μL(蛋白质量浓度为2 mg·mL-1,酶活力单位为100 U),迅速置于30 ℃条件下的摇床中,以转速为120 r·min-1进行交联反应60 min 后,12 000 r·min-1离心5 min,收集沉淀,即得酪氨酸酶与多酚氧化产物交联聚集体,用适量缓冲液洗涤2~3 次,以终质量浓度为1 mg·mL-1的L-Dopa 溶液为底物测定活力并进行SDS-PAGE 电泳分析。选择不同pH、温度、交联时间进行CLEAs 制备参数优化,与传统的蛋白沉淀试剂如硫酸铵,聚乙二醇进行对比,计算酶活回收率。
1.4 酶动力学参数分析
用0.1 mol·L-1pH 4.0 的柠檬酸-磷酸盐缓冲液配制不同质量浓度的儿茶素底物溶液(ECG 为0~8 mg·mL-1,EGCG 为0~16 mg·mL-1),添加相同酶活的CLEAs 和游离酪氨酸酶,于30 ℃反应5 min,测定相关数据,所有试验设置3 个平行样,利用Lineweaver-Burk 的方法作图,计算出酶动力学常数。
1.5 CLEAs 的结构与催化性能
为了研究CLEAs 的形态结构特点,选择EGCG 为对照样品,以及在此基础上制备的CLEAs 样品为研究对象,将二者干燥后制备成粉末,在粉末上添加一层导电涂层,厚度约为2~3 nm,利用扫描电镜(ZEISS Sigma 300德国)对CLEAs 进行形态学结构的观察和分析,以未加酶的交联剂EGCG 作为对照;进一步对CLEAs 进行傅立叶变换红外吸收光谱FTIR 分析,考察交联前后官能团的差异,利用红外吸收光谱仪(Thermo Scientific Nicolet iS20 FT-IR)进行了光谱扫描分析(波长范围:500~4 000 cm-1),以未加酶的交联剂作为对照样品。对CLEAs 和游离酶的催化特性进行研究,以L-Dopa 为底物,测定在不同条件下(乙醇耐受性、pH、热稳定性、底物耐受性)二者的催化性能。
1.6 CLEAs 与游离酶催化合成茶黄素TFDG
分别利用CLEAs 和游离酶进行催化合成茶黄素,底物EGCG 和ECG用15 mL 0.1 mol·L-1pH 4.0 的柠檬酸-磷酸盐缓冲液溶解,EGCG 和ECG 用量比为2∶1(4 mmol·L-1∶2 mmol·L-1),反应温度30 ℃、pH 4.0、时间30 min,酪氨酸酶的活力为100 U。待反应结束后,离心取上清液进行TFDG 浓度测定,过滤后的固体重新加入底物溶液进行下一批次反应。反应以游离液态酶作为阴性对照。
2 结果与分析
2.1 酶交联聚集体的最适条件
选择不同儿茶素作为交联试剂对酶的交联情况进行测试,以酶交联产率作为参考指标,从图3 中可以看出,与传统的固定化方法相比,利用EGCG 作为交联反应的底物时,能获得最大的酶活回收率(84.65%),其次为EC(84.55%),而采用传统的硫酸铵沉淀和聚乙二醇(PEG)的方法,其酶活回收率分别为65.00%和74.41%(表1)。由此说明,选择以儿茶素为底物进行酪氨酸酶的交联比传统沉淀(交联)试剂方法具有优越性,一方面省略了蛋白沉淀的步骤,另一方面儿茶素交联的酶活回收率高。

表1 不同沉淀剂的酶活回收率对比Table 1 Comparison of enzyme activity recovery with different precipitators

图3 不同儿茶素对酶交联产率的影响Fig. 3 Effects of different catechins on enzyme cross-linking yield
通过对酪氨酸酶交联的时间、pH、温度条件的优化,结果表明(图4),交联反应最佳条件为40 ℃,pH 7.0,反应时间50 min。
SDS-PAGE 电泳检测结果表明(图5),酪氨酸酶交联前单体分子量为 35 kDa 左右(图5A 和图5B 泳道1),随着交联反应的进行,酪氨酸酶的分子量逐渐变大,且呈现不同大小的分子量表现出弥散的条带,说明经过交联,酪氨酸酶形成了大小不一的复合物(图5A 泳道2~7,图5B 泳道2~3),且交联后的蛋白大多数以不可溶的沉淀形式存在(图5A泳道3)。

图4 酪氨酸交联酶聚集体制备参数条件优化Fig. 4 Optimization of preparation parameters of tyrosine cross-linked enzyme aggregates
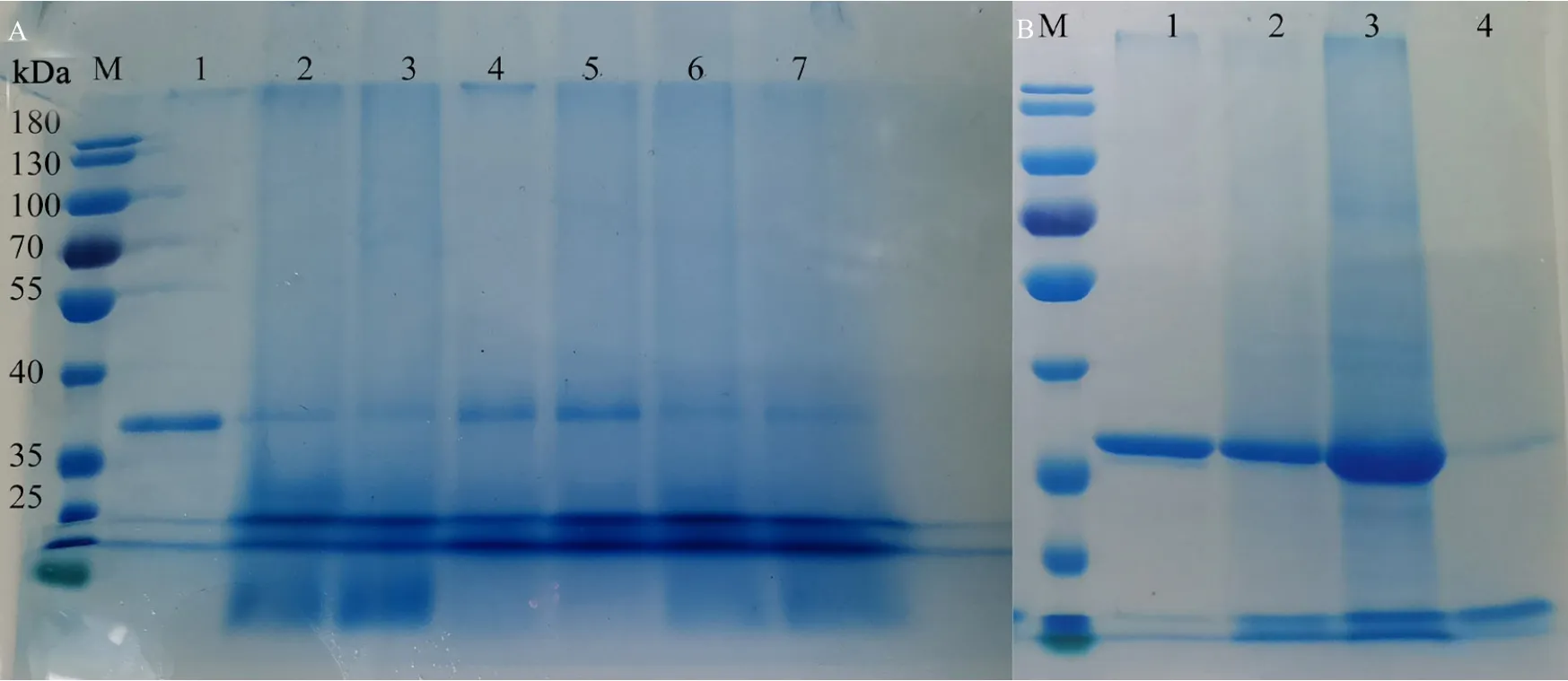
图5 酶交联产物的SDS-PAGE 电泳分析Fig. 5 Analysis of enzyme crosslinking products by SDS-PAGE electrophoresis
2.2 催化性能分析
通过对游离酶和CLEAs 的催化性能进行对比分析,从图6A 中可看出,在偏酸性pH条件(pH<6.0),交联酶的催化活性相对游离酶而言,略有提升,更有利于茶黄素TFDG 的形成;温度耐受性分析结果表明(图6B),交联酶和游离酶在温度55 ℃以下表现稳定,当温度>60 ℃时,游离酶的稳定性急剧下降,65 ℃活力完全丢失,而交联酶此时仍然保持有95%以上的催化活性,由此说明交联酶相比游离酶具有较好的热稳定性,更适合于工业化应用;在有机溶剂耐受性方面(图6C),可以看出当体系中乙醇体积浓度为60%左右时会对酶的催化性能有明显提升,且交联酶的催化性能提升要优于游离酶,提升了约180%;在底物耐受性方面(图6D),可以看出当反应体系中多酚溶液质量浓度为1 mg·mL-1时,会对游离酶和交联酶的催化活性有明显抑制作用,其对游离酶的活性抑制最大,残留活性仅为25%左右,而此时交联酶的残留活性为60%以上,说明了交联酶相比游离酶具有较好的底物耐受性。

图6 游离酶和交联酶的催化性能对比Fig. 6 Comparison of catalytic performance of free and cross-linked enzymes
游离酶和CLEAs 的动力学参数测定分析可以看出(表2),二者对底物EGCG 的km值相差不大,说明二者对底物EGCG 的亲和性接近,而以ECG 为底物,游离酶的km值明显高于交联酶,说明交联酶对底物ECG 具有较高的亲和性,Vmax/km的分析表明CLEAs 的比值明显高于游离酶,说明其具有较好的催化性能。
2.3 交联酶的物理化学结构
为了研究交联酶的物理化学结构的差异,以EGCG 和EGCG+酪氨酸酶交联产物为研究对象,对二者分别进行了电镜扫描(SEM)和傅里叶变换光谱(FTIR)分析。从交联前EGCG的电镜扫描图可以看出,EGCG 的结构较为平滑(图7A-C),而EGCG+酪氨酸酶交联后产物结合能与EGCG 紧密结合形成交联复合物,这可能是CLEAs 相比游离酶具有更好的热稳定性和更高的催化性能的原因。

图7 EGCG 和EGCG+酪氨酸酶复合物的扫描电镜图Fig. 7 SEM view of EGCG and EGCG + tyrosinase complex

表2 游离酶和交联酶的动力学参数Table 2 Kinetic parameters of free and cross-linked enzymes
为了进一步研究底物EGCG 与酪氨酸酶交联前后官能团的变化,分别对 EGCG 和EGCG+酪氨酸酶复合物进行傅里叶变换光谱分析,从图8A 可以分析看出,EGCG 在3 500~3 750 cm-1,1 650~1 700 cm-1和1 600~1 650 cm-1处都有明显的吸收峰,分别代表着-OH 的伸缩振动、-C=O 的伸缩振动,以及-C=C 的伸缩振动;当EGCG 与酪氨酸酶形成交联复合物后,吸收峰的强度明显减少,尤其是-OH 的伸缩振动变弱,说明交联酶复合物的形成,导致EGCG 底物上的酚羟基明显减少,交联形成了更复杂的大分子结构(图8B)。
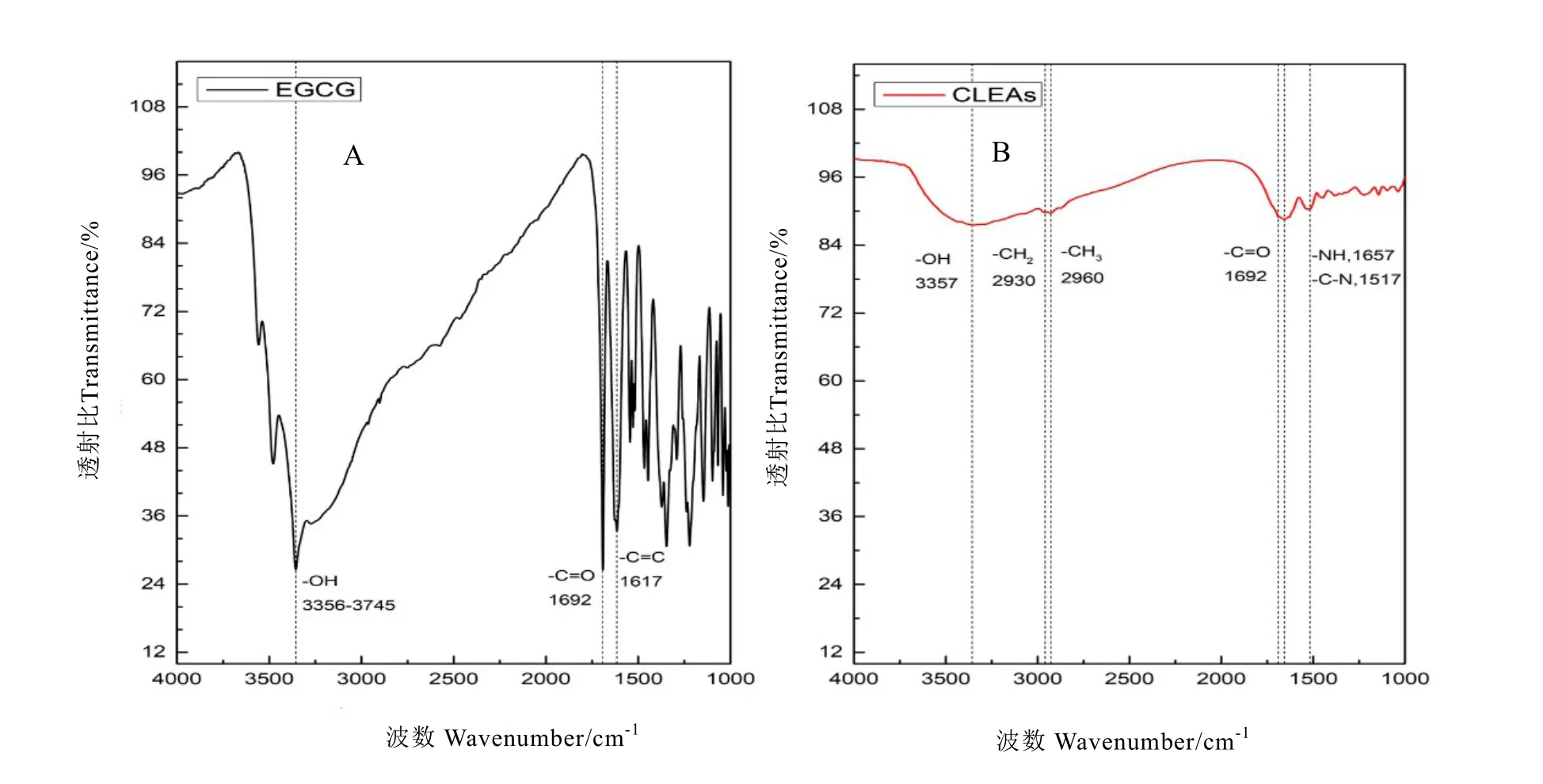
图8 EGCG 和EGCG+酪氨酸酶复合物(CLEAs)的FTIR 光谱分析Fig. 8 Analysis of EGCG and EGCG + tyrosinase complexes(CLEAs)by FTIR spectroscopy
2.4 交联酶催化合成TFDG
通过对CLEAs 与游离酶的催化性能对比分析可知,交联酶相比游离酶在热稳定性、底物耐受性、有机溶剂的耐受性等方面具有较好的优势,同时CLEAs 可以通过简单地离心洗涤即可回收重复利用,降低工业化应用的成本。对CLEAs 催化合成TFDG 的能力进行评估,从图9A 可以看出,CLEAs 催化合成TFDG具有较好的效果,第1 批次反应,体系中TFDG的质量浓度可达800 μg·mL-1左右,且连续3个批次反应产物质量浓度都>700 μg·mL-1,说明前3 个批次的稳定性非常好,随着反应批次的增加,产物浓度呈逐渐下降的趋势,分析原因一方面可能是由于多酚对酶具有抑制作用,另一方面可能是多酚、产物也容易与TFDG 形成更复杂的复合物,导致底物与酶的结合困难,活性降低。由图9B 中可知,不同批次反应,体系中的颜色由深变浅,与TFDG 的产量具有相对应的关系。
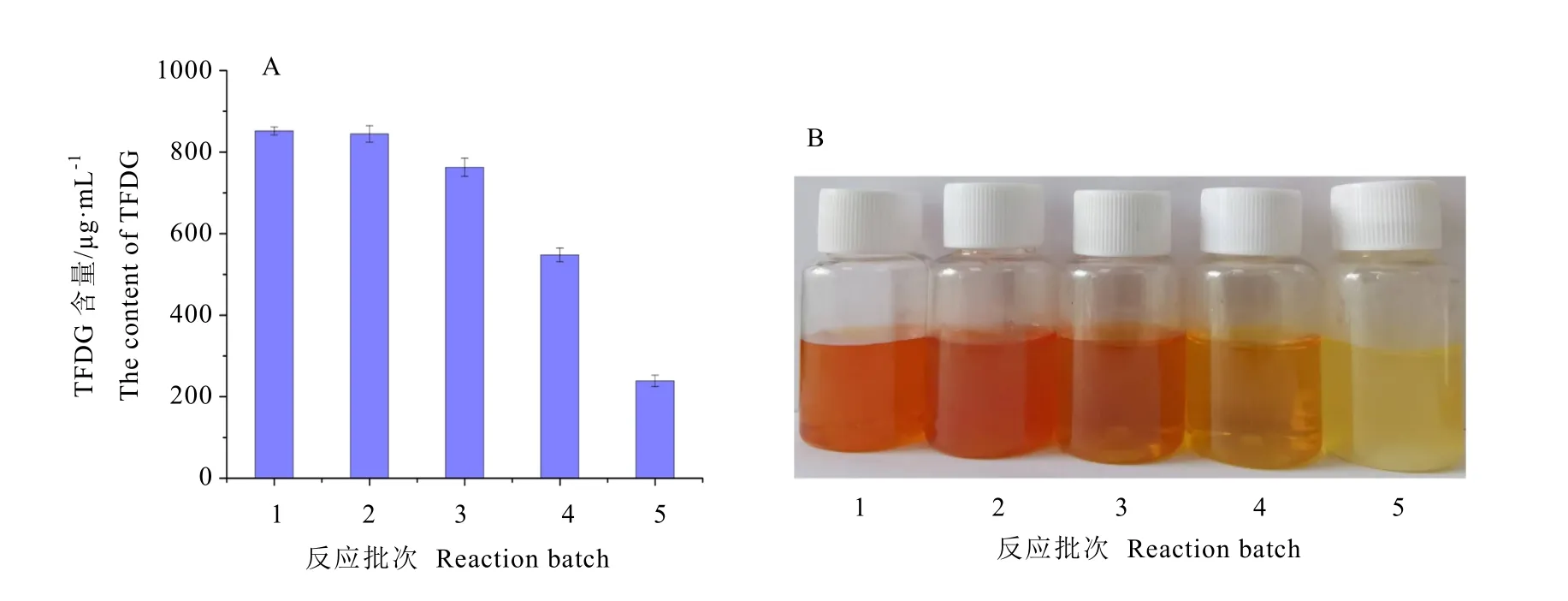
图9 酪氨酸酶交联聚集体催化合成TFDG 产量Fig. 9 Yield of TFDG synthesis catalyzed by tyrosinase cross-linked aggregates
3 讨论
游离酶应用于工业化主要的限制因素在于其只能使用1 批次,成本过高,通过技术改进实现酶的多批次重复利用是减少酶成本的重要途径。固定化酶由于具有稳定性好、回收率高可重复使用、催化活性高等优点而被广泛应用于工业生物催化中。在前期研究中,我们选择了丙烯酸树脂Eupergit C 作为酪氨酸酶的固定化载体进行了固定化研究,结果表明,用该树脂可以成功将酪氨酸酶进行固定化,并进行了TFDG 的合成,但是该固定化酶使用1批次就丢失了大部分的活性,分析原因在于一方面产物茶黄素能与固定化酶颗粒形成紧密结合,形成了有颜色的复合物,阻塞了固定化酶的孔径,影响了底物的进入导致了酶活性的丢失;另一方面固定化酪氨酶的活性可能会受到底物多酚的抑制作用,导致活性丢失。因此,该固定化方式制备的酪氨酸酶无法实现工业规模化应用,酶的多批次使用问题仍未得到有效解决。酶交联聚集体是一种无载体的固定化技术,该技术路线可以分为两个步骤,即酶的浓缩沉淀和酶的交联。现有报道中几乎所有酶交联聚集体的制备所用的交联剂都需要戊二醛,且易被带入下游产物,而戊二醛对人体具有毒性。因此开发环保、便捷、高效的酶交联聚集体应用于茶黄素的合成具有十分重要的意义。
多酚化合物广泛存在于植物中,可以通过共价和非共价的结合方式与蛋白质进行结合从而改变蛋白结构,同时多酚与蛋白结合形成蛋白多酚复合物也可以影响蛋白的功能,如蛋白多酚结合复合物可以影响蛋白的二维和三维结构,导致氨基酸亲水和疏水性的变化从而增加蛋白的可溶性;蛋白多酚复合物还能增加溶液的乳化作用,如研究表明大豆分离的蛋白和花青素形成的复合物能显著提高溶液的乳化性能;此外,研究还表明没食子酸对蛋白质凝胶的性质也有一定的影响,一定浓度的没食子酸可以诱导蛋白质聚集形成不溶性聚合物。由于酪氨酸酶是一种同时具有单酚酶和二酚酶活性的加氧酶,可以将茶多酚氧化成醌,然后自聚合形成络合物。基于此,本研究选择茶多酚作为酶蛋白交联的底物。采用不同浓度、不同类型的多酚作为酪氨酸酶的交联试剂。结果表明,底物EGCG 氧化产物具有较高的交联回收率。这可能是因为EGCG 含有更多的酚羟基,可以更好地与酶蛋白分子交联。通过交联反应形成的CLEAs 在各种失活条件(有机溶剂、温度、pH 和底物浓度)下表现出更高的稳定性。采用CLEAs 和游离酶(活性相同)催化合成TFDG,CLEAs 的产率明显高于游离酶,且CLEAs 可连续5 批次反应,显著降低了TFDG 的生产成本。
但是,用多酚作为交联反应的底物也有一定的局限性。一方面,多酚能与蛋白质形成络合物,使蛋白质结构发生变化,影响催化活性;另一方面,一定浓度的多酚对酶蛋白有较强的抑制作用,会导致酶活性的丧失。因此,利用多酚(氧化产物)进行酶蛋白交联需要考虑以下因素:首先,需要针对特定的酶蛋白开发相应的交联方法,不同酶蛋白与不同底物多酚的交联效果可能不同,最佳反应条件有待探索;其次,有些酶蛋白可能不适合多酚作为交联剂,因为多酚的存在会严重影响酶的活性;再次,多酚氧化产物的浓度需要定量检测和分析,由于多酚氧化产物不稳定,目前还没有方便的检测分析方法对其进行检测和监测。
基于此,未来可以从以下几个方面进一步提升酶的使用效率:(1)可以选择与载体共固定的CLEAs 制备,EGCG 作为交联剂进行酶的交联其机械稳定性不高,多批次使用后容易被外界压力或机械剪切力所破坏,导致活性损失,这也是多批次反应后TFDG 产率下降的原因,因此选择稳定的载体和CLEAs 相互结合的方法有望进一步提升酶的稳定性和催化性能;(2)继续对多酚氧化酶进行改造和筛选,进行以多酚为底物的酶耐受性、催化活性的筛选,提升酶的催化性能,最终获得满足工业化应用属性的CLEAs。
本研究针对底物儿茶素的特性,创新性的利用儿茶素作为交联试剂对酪氨酸酶进行了固定化,制备获得了CLEAs,并应用于茶黄素-3,3′-双没食子酸酯的合成。交联酶较游离酶表现出更优异的催化性能(热稳定性、有机溶剂耐受性、底物耐受性)。交联酶被用于合成茶黄素-3,3′-双没食子酸酯时,产物质量浓度可达800 μg·mL-1,且交联酶能被重复循环使用至少3 个批次,利用该方法制备茶黄素,可以显著降低酶的应用成本,具有潜在工业化应用价值。
