橄榄种质资源遗传多样性分析及指纹图谱构建
2023-06-30邵雪花刘传滨匡石滋赖多刘传和贺涵肖维强
邵雪花 刘传滨 匡石滋 赖多 刘传和 贺涵 肖维强


摘要:利用ISSR分子标记技术,对101份橄榄种质资源进行遗传多样性分析,并绘制指纹图谱。从96条ISSR引物中筛选出10条引物,对广东省农业科学院果树研究所橄榄资源圃和潮州市果树所资源圃内101份资源进行分子标记,使用UPGMA聚类分析橄榄种质资源遗传多样性,从10对引物中挑选扩增条带清晰、多态性好的核心引物进行遗传多样性分析,并构建橄榄DNA指纹图谱。分析结果显示,10条ISSR引物对101份橄榄样品进行扩增,共得到136条条带,其中多态性条带135条,多态率为99.26%,平均每条引物扩增得到条带13.60条,平均每条引物扩增得到多态性条带13.50条,表明供试材料间遗传多样性较高。通过UPGMA聚类分析可知,101份橄榄种质资源样品间的遗传相似性系数为0.58~0.97,表明品种间亲缘关系较近。在遗传相似性系数为0.68时,可将101份橄榄种质资源分为5组,第1组包含种质48份,第2组包含种质45份,第3组包含种质5份,第4组包含种质2份,编号C74的大纳甜橄榄单独为第5组,说明该品种与其他样品相比发生了明显的遗传变异。利用筛选得来的6条核心引物组合成功构建了橄榄DNA指纹图谱,为供试的101份橄榄品种编写了一套唯一的指纹图谱编码。研究结果成功构建了101份橄榄种质的指纹图谱,为橄榄种质资源的挖掘、利用和创制新品种等提供理论依据。
关键词:橄榄;ISSR分子标记;指纹图谱;种质资源;遗传多样性
中图分类号:S667.502.4文献标志码:A
文章编号:1002-1302(2023)05-0094-09
橄榄(Canarium album),橄榄科橄榄属乔木,别称黄榄、青果、橄榄子等,原产于我国南方,主要分布在我国福建省、广东省、四川省、广西壮族自治区、重庆市和浙江省等南部省份(市)和地区,尤以广东省和福建省栽培最多[1]。橄榄是传统的药食同源水果,其味甘酸,性平,有清热解毒、利咽化痰、除烦醒酒的功效[2],其果实富含丰富的多酚类物质[3-4]、黄酮类化合物[5],可加工制成果酒、果汁、茶叶等[6-8],还能用于抗病毒[9]、抗氧化[10-11]、保护肝脏[12]、提高免疫和调节血脂血糖[13]等方面。
目前,橄榄的新品种选育快速发展,由于不同地区的橄榄品种相互引种、杂交,导致了各个地区橄榄品种遗传背景复杂,但目前品种鉴定工作大多依靠形态特征鉴别[14-16],橄榄遗传背景不明确、缺乏科学系统的检测方法和权威的分类系统[17],致使同名异物或同物异名的现象时常发生。ISSR是一种研究物种遗传多样性的常见方法,结合了RAPD和SSR 2种技术的优点,具有不受环境影响、结合位点丰富和灵敏度准确性高等特点,在品种鉴定方面,DNA分子标记技术比传统技术更加方便、快捷[17-18]。
李婷利用ISSR分子标记技术对福建莆田24份不同品种的枇杷叶进行鉴定与分析,使用14条核心引物对其进行扩增,共扩增出150条条带,其中有79条多态性条带,多态率为 52.67%[19]。崔学强等利用ISSR技術对22种石斛兰的亲缘关系及遗传多样性进行了分析,共扩增出241条条带,其中有241条多态性条带,多态性条带比例为100%,遗传相似系数为0.70~0.88[20]。杨培奎等采用ISSR技术对粤东和潮汕地区的64个橄榄品种进行鉴定,结果表明,粤东地区与潮汕地区的橄榄遗传多样性水平较低,且来源地与品种名关系不大[21]。赖瑞联等通过ISSR和RAPD联用技术对福建地区的86份橄榄资源进行了遗传多样性分析,发现橄榄种质资源具有丰富的遗传多样性,且这种遗传多样性存在明显的地域性差异[22]。陈海云等对云南的59份油橄榄进行了ISSR鉴定分析,发现云南地区的橄榄资源同样具有较高的遗传多态性[23]。在种质资源科学研究中,品种鉴定的原则是选用较少的引物区分较多的品种。
以上研究结果充分说明:(1)ISSR技术可有效鉴别出橄榄种质资源的遗传多样性;(2)橄榄种质资源的遗传多样性大多具有明显的地区差异。广东省农业科学院果树研究所橄榄资源圃从2010年开始大量收集国内外橄榄种质资源,包括濒临淘汰的地方品种及国内外的主栽品种,目前已有资源60余份,而潮州市果树研究所橄榄资源圃主要集中了广东省内的橄榄资源,为阐明这2个资源圃内橄榄资源的同名异物或同物异名现象与品种间的遗传分化和变异情况,本研究拟通过ISSR技术对广东省农业科学院果树研究所橄榄资源圃和潮州市果树研究所橄榄资源圃中的101个橄榄品种进行遗传多样性分析,以期通过改善ISSR扩增条件筛选出核心引物,开发一种能够运用在大规模样本筛查且具备较高多态率的橄榄品种鉴定方法,并构建分子指纹图谱,为ISSR 分子标记在橄榄分类方面的应用提供借鉴,以期为橄榄资源的品种鉴定和种质创制奠定理论基础。
1 材料与方法
1.1 试验材料与试验方案
试验在广东省农业科学院果树研究所果树资源与环境实验室进行,于2021年9月在广东省农业科学院果树研究所和潮州市果树研究所橄榄资源圃进行供试101份橄榄样品的采集(种质资源品种信息见表1)。将采摘后的新鲜橄榄嫩叶迅速置于干冰中保存,置于-20 ℃冰箱备用。
1.2 试验方法
1.2.1 DNA提取
使用北京聚合美生物科技公司的植物基因组DNA提取试剂盒提取101份橄榄样品的DNA[24](2021年10月)。将提取的DNA样品使用1.5%的琼脂糖凝胶进行电泳检测,通过凝胶成像系统检测其DNA纯度,使用Nano Drop 2000分光光度计检测DNA浓度,合格DNA样品置于 -20 ℃ 冰箱内保存备用[25]。
1.2.2 ISSR分析
在加拿大哥伦比亚大学公布的通用引物序列中筛选出10条多态性好、条带清晰的引物对101份橄榄种质资源的DNA样品进行扩增[26](2021年12月至2022年2月)。PCR反应总体系为30 μL,其中包含15 μL 2X Master Mix,1 μL引物(10 μmol/L),2 μL DNA模板,12 μL去离子水。PCR反应程序:95 ℃预变性5 min;95 ℃变性 30 s,50 ℃复性45 s,72 ℃延伸2 min,共40个循环;72 ℃ 延伸10 min,于4 ℃保存[27]。
使用8 μL PCR扩增产物经1.5%琼脂糖凝胶电泳检测,置于凝胶成像系统中观察条带,拍照并记录[25]。
1.3 数据分析
使用人工读带的方式统计扩增产物的条带数。将电泳图谱上同一水平有条带的记为“1”,无条带的记为“0”,以此构建0、1数据矩阵[27]。通过NT-SYSpc 2.0软件计算橄榄样品间的亲缘相似性系数,用以分析橄榄样品间亲缘性关系。使用UPGMA法制作聚类图,绘制出101份橄榄样品间的遗传关系图谱。利用POPGENE软件对101份橄榄进行遗传多样性分析,计算总扩增条带数、多态性条带数与多态率,根据以上数据构建橄榄种质的指纹图谱。
2 结果与分析
2.1 ISSR扩增多态性分析
使用从加拿大哥伦比亚大学设计的通用引物序列中筛选出的10条引物对48份橄榄样品进行扩增,部分扩增图谱见图1-A、图1-B。
由表2可见,10对引物总共扩增出136条条带,其中有135条多态性条带,多态率为99.26%。平均每条引物扩增条带数为13.6条,平均每条引物扩增得到多态性条带13.5条。在10条引物中,有9条引物的多态率为100%,分别是UBC808、UBC812、UBC835、UBC836、UBC880、UBC884、UBC886、UBC888和UBC889。多态性最差的引物为UBC890,其多态率91.67%。引物扩增结果显示,以上10条引物多态性丰富,其多态率均高于80%,均可用于后续遗传多样性分析及指纹图谱构建工作。
2.2 聚类结果
UPGMA聚类结果见图2。结果显示:101份供试橄榄种质资源样品间遗传相似系数为0.58~0.97,平均遗传相似系数为0.78,品种间有一定的遗传差异。101份样品中,品种C54乌榄与C55云旨1号遗传距离最近, 遗传系数为0.97。品种C56高州大坡02和C77东酸遗传距离最远,遗传系数为0.58,说明这2个品种遗传分化程度高。
在遗传系数0.68处,可将101份种质资源分成5组。第1组包含种质48份,编号为C1~C48。第2组包含种质45份,编号为C49~C52、C54~C55、C57~C73、C75~C96。第3组包含种质5份,编号为C97~C101。第4组包含种质2份,编号为C53、C56。编号C74大纳甜样品单独为第5组,说明该样品与其他样品相比,发生了明显的遗传变异。
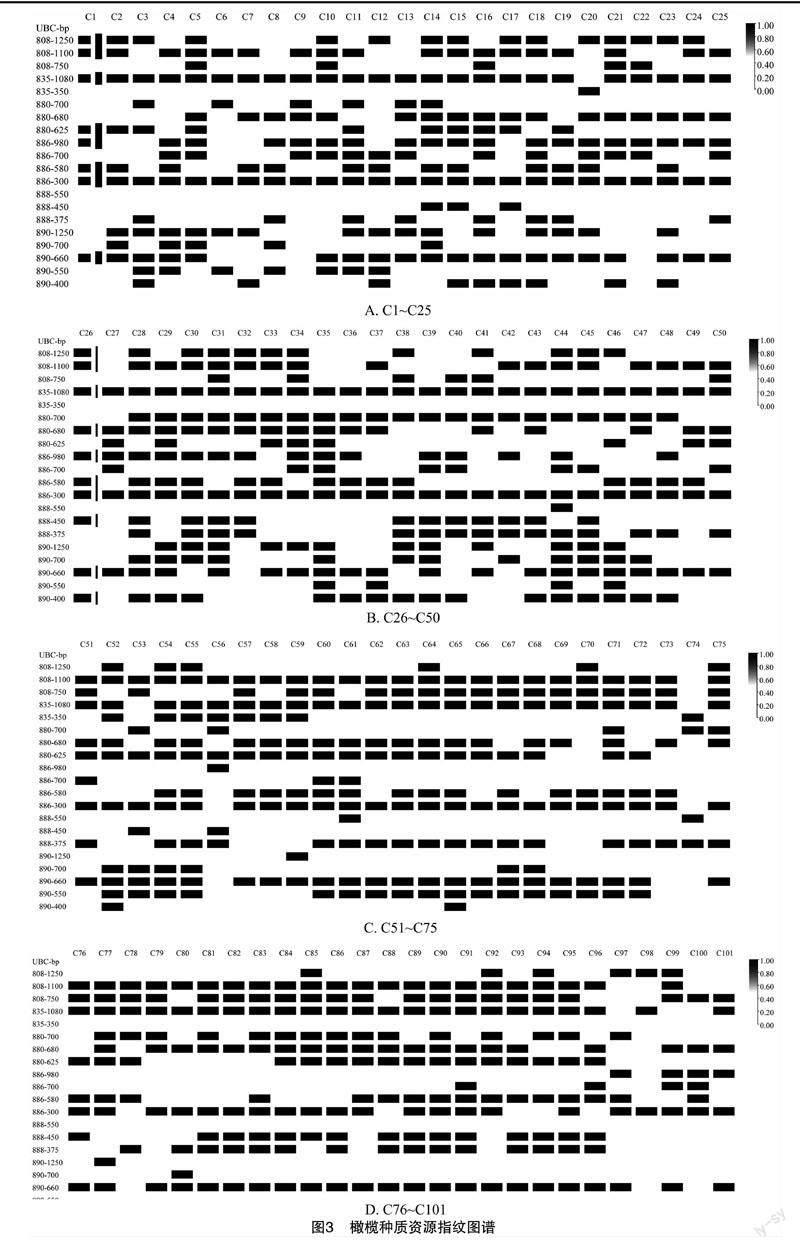
2.3 橄榄DNA指纹图谱构建
本研究从表2所列的10条引物中筛选出了6条条带清晰、多态性高、重复性好的引物用于橄榄DNA指纹图谱的编写,分别是UBC808、UBC835、UBC880、UBC886、UBC888、UBC890。选择这6条引物中清晰、典型、多态性丰富的条带进行赋值,引物典型条带赋值信息见表3。其中条带UBC835-1 080 bp、UBC835-350 bp、UBC886-580 bp 与UBC888-550 bp为品种特征条带,利用UBC835-350 bp这一位点或同时通过UBC835-1 080 bp、UBC886-580 bp与UBC888-550 bp这3个位点,可以鉴别出品种C74大纳甜。
根据表3多态性条带赋值标准对101份橄榄供试样品进行DNA指纹编码,结果见表4。其中品种C7呐种的指纹编码为23-1-2-345-—-15,表示该品种的PCR扩增产物在引物UBC808的1 100、750 bp处、引物UBC835的1 080 bp处、引物UBC880的680 bp处、引物UBC886的700、580、300 bp 处,引物UBC890的1 250、400 bp处均有条带;在引物UBC888给予赋值的典型条带位点无条带。在品种C14长穗赤的指纹编码为12-1-123-1345-2-123,表示该品种的PCR扩增产物在引物UBC808的1 250、1 100 bp处,在引物UBC835的1 080 bp处,在引物UBC880的750、680、625 bp处,在引物UBC886的1 250、700、580、300 bp处,引物UBC888的450 bp处,引物UBC890的1 250、700、660 bp处均有条带。
6条引物中的每一条引物都不能单独用以鉴定101份种质,但将6条引物结合使用,便可以准确、高效地鉴定所有种质资源。图3-A、图3-B、图 3-C、图3-D为101份橄榄种质资源DNA指纹编码对应的标准指纹图谱。通过图3-A、图3-B、图3-C、图3-D能够更加清晰、直观地看出101份橄榄种质资源的多态性扩增情况,且每个品种都拥有一套唯一的指纹编码。
3 讨论与结论
ISSR 是一种利用微卫星序列作为 PCR 引物来生成多位点标记的技术[27]。目前,ISSR技术不仅已经广泛应用于各种野生种与栽培品种的鉴定中[28-29],还可应用在常规表型分类以及细胞学分类的鉴定上[30]。近年来的研究表明,ISSR技术可有效鉴别出橄榄种质资源的遗传多样性[31],单独运用ISSR技术扩增的多态性近90%[23],ISSR和RAPD技术相结合扩增的多态性达95%[32],多态性虽然较高, 但引物的需求量大或需借助其他技术手段进行联合分析,鉴定工作较复杂。在种质资源科学研究中,品种鉴定的原则是选用较少的引物区分较多的品种。本研究从96条ISSR多态性引物中筛选出10条核心引物用于101份橄榄种质亲缘关系、遗传多样性分析和DNA指纹图谱构建,10条核心引物扩增的多态率为99.26%,进一步分析发现,最少可利用3对(UBC808、UBC835和UBC886)多态性引物即可全部区分101份橄榄资源。
通过UPGMA聚类分析橄榄种质资源的遗传多样性发现,供试的橄榄种质资源具有较高的遗传多样性,且品种间存在较丰富的遗传变异,在遗传系數0.68处,可将101份种质资源分成5组。第1组包含种质48份,编号为C1~C48。第2组包含种质45份,编号为C49~C52、C54~C55、C57~C73、C75~C96。第3组包含种质5份,编号为C97~C101。第4组包含种质2份,编号为C53、C56。编号C74的大纳甜样品单独为第5组。说明供试的橄榄品种之间没有地域性差异,相同出处、相似命名的品种间亲缘关系并不一定最近,如思贺香榄1号和思贺香榄2号、高山大坡01和高山大坡02,这一现象也与前人的研究结果相吻合[17,21,33]。亲缘关系揭示,同一资源圃的橄榄样品遗传相似性较高,这可能是因为材料的来源地相对集中,品种存在交叉引种或不同嫁接组合导致;命名相似的品种并不一定聚为一类,这也许是在常年定向选育中,由于不同的实生母树通过嫁接繁衍,出现了某些果实形态特征相似,从而使用了相近的命名,如思贺香榄1号和思贺香榄2号。受橄榄品种资源限制和农业生产习惯、技术的影响,在品种选育上具有一定的盲目性和随意性,因而出现了品种遗传背景混乱的现象。
本研究利用了ISSR分子标记技术对广东省农业科学院果树研究所和潮州市果树研究所的101份橄榄种质资源进行了品种鉴定与分析,通过分子标记技术建立了橄榄种质资源的指纹图谱,为品种资源编写了一套独一无二的“分子身份证”,可避免重复性的收集和保存,剔除同名异物和同物异名的橄榄种质资源,为橄榄的分子育种提供理论依据。
参考文献:
[1]王成章,陈 强,罗建军,等. 中国油橄榄发展历程与产业展望[J]. 生物质化学工程,2013,47(2):41-46.
[2]常 强,苏明华,陈清西. 橄榄化学成分与药理活性研究进展[J]. 热带作物学报,2013,34(8):1610-1616.
[3]赖瑞联,陈 瑾,冯 新,等. 橄榄多酚类物质研究进展[J]. 热带作物学报,2018,39(12):2532-2541.
[4]程子良,祁惠芳,黄鹏飞,等. 橄榄多酚的化学组成、药理作用及提取技术研究进展[J]. 中国油脂,2020,45(11):26-31,45.
[5]吴如健,陈 瑾,胡菡青,等. 橄榄黄酮类化合物研究进展[J]. 福建农业学报,2015,30(1):106-110.
[6]陈 婕. 橄榄浓缩汁加工技术的研究[D]. 福州:福建农林大学,2012.
[7]吴 兵,李正涛,姚 昕. 保健橄榄茶的加工与调配[J]. 现代食品科技,2008,24(4):349-351.
[8]Zeng H L,Miao S,Zheng B D,et al. Molecular structural characteristics of polysaccharide fractions from Canarium album (Lour.) Raeusch and their antioxidant activities[J]. Journal of Food Science,2015,80(11):2585-2596.
[9]卫春会,郑自强,郭 燕,等. 橄榄果酒的研制及其风味物质分析[J]. 现代食品科技,2020,36(12):234-242,313.
[10]Xiang Z B,Wu X L,Liu X Y.Chemical composition and antioxidant activity of petroleum ether extract of Canarium album[J]. Pharmaceutical Chemistry Journal,2017,51(7):606-611.
[11]Zhao B X,Hai Q M,Zhong T Q,et al . Ellagic acid from the dried fruits of Canarium album with antihepatitis B activity[J]. Asian Journal of Chemistry,2011,23(8):3759-3760.
[12]候 丹,刘铜华. 橄榄苦苷对糖尿病小鼠肝脏糖代谢的作用及机制[J]. 中国实验方剂学杂志,2018,24(23):134-139.
[13]Zhang N N,Guo W H,Hu H,et al. Effect of a polyphenol-rich Canarium album extract on the composition of the gut microbiota of mice fed a high-fat diet[J]. Molecules,2018,23(9):2188.
[14]韦晓霞,赖瑞联,陈 瑾,等. 橄榄种质资源花序表型性状遗传多样性研究[J]. 热带亚热带植物学报,2019,27(1):1-10.
[15]吴如健,万继锋,韦晓霞,等. 橄榄种质资源果实表型性状多样性分析及其数量分类研究[J]. 果树学报,2015,32(5):797-805.
[16]杨培奎. 粤东地区橄榄种质资源遗传多样性ISSR分析及核心种质初步构建[D]. 汕头:汕头大学,2010.
[17]赖瑞联,陈 瑾,韦晓霞,等. 中国橄榄研究40年[J]. 热带作物学报,2020,41(10):2045-2054.
[18]Mei Z L,Zhang X Q,Liu X Y,et al. Genetic analysis of Canarium album in different areas of China by improved RAPD and ISSR[J]. Comptes Rendus Biologies,2017,340(11/12):558-564.
[19]李 婷. 枇杷叶的ISSR遗传差异分析及化学成分含量相关性研究[D]. 福州:福建中医药大学,2011.
[20]崔学强,唐 璇,黃昌艳,等. 22种石斛兰遗传多样性分析及DNA指纹图谱构建[J]. 分子植物育种,2021,19(9):3005-3014.
[21]杨培奎,郑道序,马瑞君,等. 潮汕橄榄地方品种(系)遗传多样性的ISSR分析[J]. 广东农业科学,2013,40(23):129-132.
[22]赖瑞联,陈 瑾,冯 新,等. 橄榄ISSR和RAPD遗传多样性分析和核心种质构建[J]. 热带亚热带植物学报,2022,30(1):41-53.
[23]陈海云,宁德鲁,李勇杰,等. 59个油橄榄种质的ISSR分子鉴定[J]. 东北林业大学学报,2013,41(3):13-17.
[24]魏 杰,姚瑞红,金梦然,等. 31份樱属材料亲缘关系的ISSR分析[J]. 河北农业大学学报,2021,44(5):57-63.
[25]邵雪花,刘 牛,赖 多,等. 28份余甘子品种遗传多样性的ISSR分析及指纹图谱构建[J]. 西北农林科技大学学报(自然科学版),2020,48(8):129-136.
[26]邓吉良,孙言博,吴 跃,等. 基于SSR分子标记分析海南地区甘薯种质材料的亲缘关系[J]. 南方农业学报,2018,49(10):1924-1932.
[27]赵雅姣,田新会,杜文华. 饲草型小黑麦遗传多样性的ISSR分析[J]. 草地学报,2017,25(3):574-581.
[28]曾昭清,高慧新,朱 華,等. 基于ISSR的野生和栽培的褐苞薯蓣遗传多样性分析[J]. 世界科学技术-中医药现代化,2020,22(10):3781-3787.
[29]张彬彬,王 震,刘保卫,等. 30个野生灵芝菌株遗传多样性及农艺性状评价[J]. 江苏农业科学,2022,50(2):108-114.
[30]Shahi-Gharahlar A,Zamani Z,Fatahi R,et al. Estimation of genetic diversity in some Iranian wild Prunus subgenus Cerasus accessions using inter-simple sequence repeat (ISSR) markers[J]. Biochemical Systematics and Ecology,2011,39(4/5/6):826-833.
[31]刘 旸,付开赟,吐尔逊·阿合买提,等. 不同地理种群马铃薯甲虫SSR、RAPD遗传多样性分析[J]. 新疆农业科学,2016,53(9):1608-1617.
[32]刘林娅,党选民,曹振木,等. 黄灯笼辣椒种质资源遗传多样性ISSR分析[J]. 热带作物学报,2013,34(2):211-217.
[33]郭春芳,唐玉海,孙 云,等. 茶树种质资源遗传多样性的ISSR分析[J]. 热带作物学报,2008,29(2):181-186.
收稿日期:2022-04-19
基金项目:广东省科技厅驻镇帮镇扶村农村科技特别员项目(编号:KTP20210112);广东省农业科学院汕尾分院科技合作专项(编号:2020汕尾分院专项-02);广东省优稀水果现代农业产业技术体系创新团队项目(编号:2019KJ116);广东省潮州市重大科技专项(编号:20210106)。
作者简介:邵雪花(1983—),女,宁夏石嘴山人,博士,助理研究员,主要从事果树栽培与新品种育种研究。E-mail:sxh19831017@163.com。
通信作者:肖维强,硕士,副研究员,主要从事果树栽培与新品种育种研究。E-mail: xwq6817@126.com。
