云南独龙鸡和红原鸡卵巢组织转录组水平的比较分析
2023-06-30丁玥竹任宇扈孟雪燕文荃郭爱伟周杰珑吴培福陈粉粉刘莉莉
丁玥竹 任宇 扈孟雪 燕文荃 郭爱伟 周杰珑 吴培福 陈粉粉 刘莉莉
摘要:为明确独龙鸡的基因功能和种质特性,试验采集3羽健康状况良好的独龙鸡卵巢组织进行转录组测序,并与饲养条件基本相似并且同周龄的红原鸡卵巢组织进行比较。结果表明,与红原鸡相比,独龙鸡中差异表达基因共有7 404个。KEGG和GO富集分析表明,差异表达基因主要富集在GTP酶激活剂活性、膜结构、泛素蛋白连接酶活性和ATP结合等过程,并参与Ras信号通路、硒化合物的代谢通路、SNARE因子在囊泡运输中的相互作用等通路。对显著性通路分析发现,独龙鸡在蛋品质和免疫抗性上具有一定优势,但在产蛋性能上与红原鸡还存在一定差距。说明NCBP1、NCBP2、TXNRD1、PTEN、ENOX1基因主要富集在抗性、产蛋性能和蛋品质相关通路中,可进一步深入研究。
关键词:独龙鸡;红原鸡;卵巢组织;转录组测序;差异表达基因
中图分类号:S831.2文献标志码:A
文章编号:1002-1302(2023)05-0038-06
独龙鸡是我国怒江傈僳族自治州贡山县独龙族的一种特有的地方家禽,仅在高山河谷地区出现,于2010年入选全国畜禽遗传资源名录[1]。独龙蛋品质好,蛋质鲜美,且有较强的捕食力,会飞翔,抗病力极强,且肉质鲜美,特别适合中高海拔、高温潮湿等不良环境,是云南地区特有的优良家禽品种,适宜在山地饲养[2]。目前,独龙鸡主要是由山区人民自行繁殖饲养的,由贡山县畜牧兽医站承担疾病防治工作,但是由于地理位置特殊、交通不便、疾病防治设备陈旧、药品短缺、繁育水平较低、养殖效益较差,导致独龙鸡在种质资源开发和利用等方面发展缓慢[3],因此深入研究独龙鸡的种质资源特点迫在眉睫。
卵巢是鸡蛋形成的主要部位之一,是雌性家禽动物调控生殖的主要器官,卵巢所产生的雌二醇、孕酮等类固醇激素对卵泡发育成熟和排卵具有促进作用。目前,转录组测序(RNA sequencing,RNA-seq)在鸡重要经济性状的候选基因鉴定方面已逐步成熟了[4],但是对独龙鸡的生产性状研究较少。因此,本研究拟通过RNA-seq技术比较独龙鸡和红原鸡卵巢组织的基因表达水平,以分析独龙鸡和红原鸡的种质差异,为以后独龙鸡重要生产性状候选功能基因筛选、品种改良、种质特性以及基因功能验证等研究奠定基础,为保护云南独龙鸡品种和开展分子育种改善独龙鸡鸡蛋品质提供理论基础。
1 材料与方法
1.1 样本采集
试验所需的雌性独龙鸡种蛋,由云南省贡山县神山农产品发展公司生产供应,在西南林业大学基地培育,在与养殖要求相似的环境下,自然采食和饮水。随机挑选43周龄健康的独龙鸡3羽,解剖收集卵巢组织,编号为LC1、LC2、LC3,并立即超低温保存备用。
1.2 总RNA提取和RNA质量检测
应用 TRIzol RNA技术,从卵巢中分离出全部 RNA。利用Nanodrop 2000和Agilent 2100等先进仪器设备,对RNA的含量、纯化程度和完整性等进行测定,以确定转录组检测工作是采用了符合要求的样品完成的。得到的RNA样品浓度≥500 ng/μL,RIN值≥8且28S ∶18S≥1。
1.3 cDNA文库的构建及测序
mRNA利用Oligo (dT)的磁性微粒加以富集,而后添加分离缓冲剂(fragmentation buffer),将mRNA随机中断。首先用mRNA作为模版,通过六碱基随机引物(random hexamers)加以制备,之后再添加缓冲液、dNTPs、RNase H、DNA Polymerase Ⅰ,最后再用AMPure XP beads对cDNA加以提纯。对纯化后的cDNA经过末端修饰,加A尾,并与测序接头进行相连。最后,再使用AMPure XP beads,对文库中插入的片段加以筛选,然后用 PCR技术对其进行扩增。利用q-PCR方法对新构建的文库实现更准确的定量分析,因而保证了在文库中的有效含量>2 nm。库检通过后,可以利用Illumina的高通量测序平台,完成排序解析。
1.4 测序数据及其质量控制
应用 Illumina HiSeq TM 2000软件,通过对序列进行高通量测序,以及采用将序列中较低质量的序列切除、去连接等方式,得到了高质量的 Clean reads序列。
1.5 差异表达分析
采用饲养条件基本相似并且周龄较相近的红原鸡卵巢组织测序,结果设为对照组,本研究中的独龙鸡卵巢组织样本设为试验组,进行差异表达分析。并采用FPKM(fragments per kilobase of transcript per million fragments mapped)值表示对应Unigene 的表达丰度。筛选标准为差异倍数(fold change,FC)≥2且错误发现率(false discover date,FDR)<0.01,并使用DESeq2软件分析样品间的差异表达,获得总差异表达基因。试验组中差异表达基因的表达高于对照组中差异表达基因的表达,表现为上调基因(up-regulated gene),反之为下调基因(down-regulated gene)。
1.6 差异表达基因富集与互作分析
应用DAVID(http://david.ncifcrf.gov/)网络软件,对数据分析得到的差异表达基因采用KEGG(kyoto encyclopedia of genes and genomes)通路分析方法及GO(gene ontology)富集的研究。P<0.05的GO條目和KEGG通路的显著富集。应用STRING(https://www.string-bd.org/)网络软件对差异表达基因开展了互作分析,提取的蛋白质-蛋白质的相互作用对的互作得分>0.9。
2 结果与分析
2.1 测序数据统计
以43周龄独龙鸡、红原鸡为例,对其基因序列进行检测,经测序获得39.29 Gb高质量数据,各样本高质量数据均达到9.48 Gb,每个样品Q30的碱基百分数都不低于82.06%,测得的数据总量和质量都均满足后续试验分析(表1)。
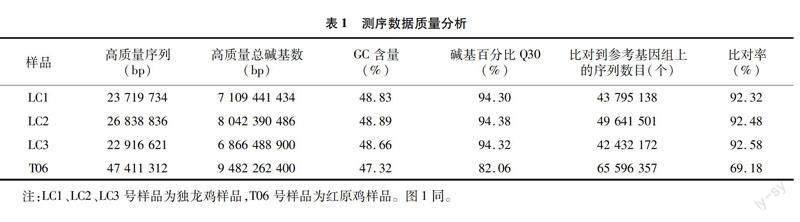
2.2 样品间的相关性评估
FPKM是一种用于预测转录组序列基因表达水平的方法,它是通过比较每个千碱基长度的基因读出数量。皮尔逊相关因子(r)是衡量生物重复关系的一个重要指标,r2与1越接近,证明2个样品的关系愈密切,则2个样本间的关联度愈高。同一条件下每对生物重复样本的基因表达相关性分析见图1,独龙鸡LC1、LC2、LC3号样品间相关系数大于0.9,说明各样品间相关性较好,与红原鸡T06号样品的相关系数均小于0.7,说明与红原鸡样品差异较大,表明试验可靠性较高。
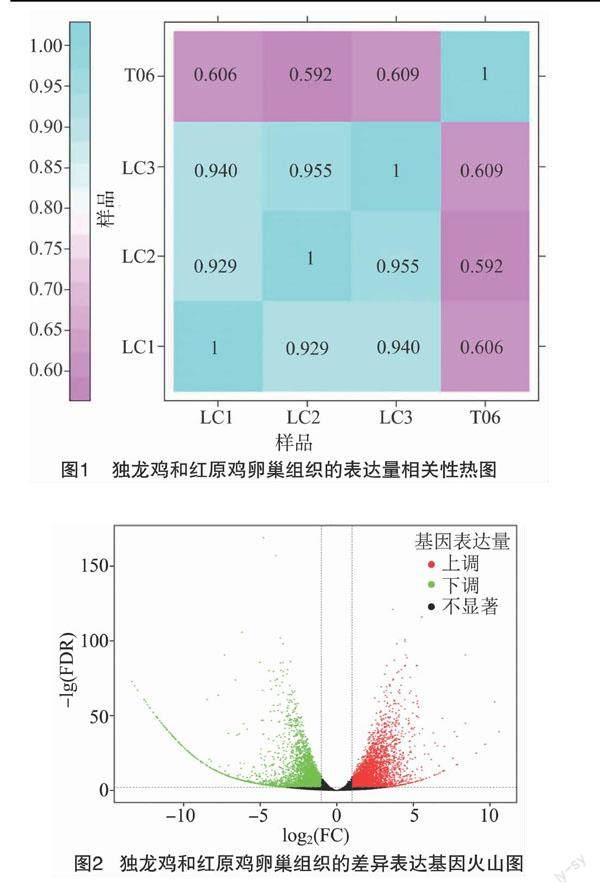
2.3 差异表达基因筛选
以红原鸡为对照组,并以|log2 Fold Change |≥1,FDR值<0.01为条件,一共筛选出差异表达基因7 404个,包括3 853个上调基因,以及3 546个下调基因。这2组样品基因表达水平的差别,以及不同的统计学显著性通过火山图显示(图2)。
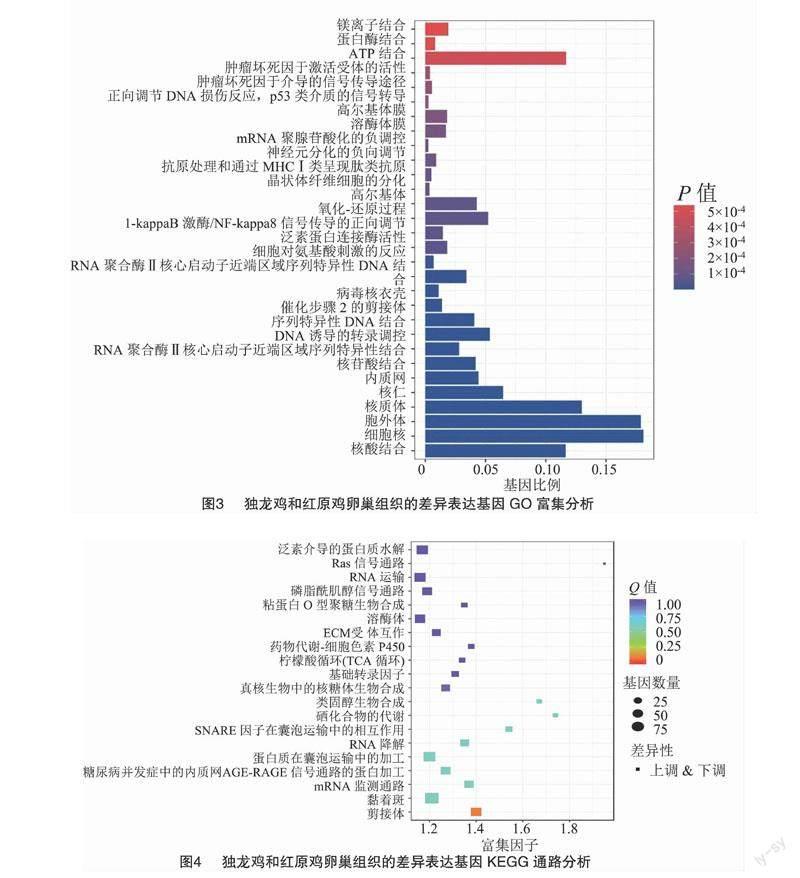
2.4 差异表达基因富集分析
用GO分析法研究红原鸡与独龙鸡的差异表达基因, 研究结果显示, 在生物学过程(BP)中上调基因多注释到细胞对氨基酸刺激的反应(GO:0071230)、氧化-还原过程(GO:0055114)、I-kappaB激酶/NF-kappaB信号传导的正向调节(GO:0043123)、肿瘤坏死因子介导的信号传导途径(GO:0033209)、正向调节DNA损伤反应,p53类介质的信号转导(GO:0043517),而下调基因主要与DNA诱导的转录调控(GO:0006355)、晶状体纤维细胞的分化(GO:0070306)、抗原处理和通过MHC Ⅰ类呈现肽类抗原(GO:0002474)、对神经元分化的负向调节(GO:0045665)、mRNA聚腺苷酸化的负调控(GO:1900364)等有关;在细胞组分(CC)中,上调基因多与胞外区有关,如胞外体(GO:0070062)、内质网(GO:0005783)、高尔基体(GO:0005794),还与细胞膜结构有关,如溶酶体膜(GO:0005765)、高尔基体膜(GO:0000139),而下调基因多与细胞物质相关,如细胞核(GO:0005634)、核质体(GO:0005654)、核仁(GO:0005730)、催化步骤2的剪接体(GO:0071013)、还与病毒核衣壳(GO:0019013);在分子功能(MF)中,上调基因可显著注释到泛素蛋白连接酶活性(GO:0061630)、肿瘤坏死因子激活受体的活性(GO:0005031),还注释到ATP结合(GO:0005524)、蛋白酶结合(GO:0002020)、镁离子结合(GO:0000287)、核苷酸结合(GO:0000166)、核酸结合(GO:0003676),而下调基因主要与RNA聚合酶Ⅱ核心启动子近端区域序列特异性DNA结合(GO:0000978)、RNA结合(GO:0044822)、转录激活剂活性(GO:0001077)、核苷酸结合(GO:0000166)、序列特异性DNA结合(GO:0043565)、RNA聚合酶II核心启动子近端区域序列特异性结合(GO:0001077)有关,上调基因和下调基因共同注释了核苷酸的调节,于此相关的ENOX1基因[5]与蛋品质密切相关。具体结果如图3所示。GO分析表明,独龙鸡中上调差异基因主要参与了免疫相关的生理生化过程,下调差异基因多与基因表达调控、蛋白质合成有关。
使用KEGG富集分析法可以确定差异表现基因的主要生物化学代谢路线和信息通道。差异表达基因KEGG的通道富集分析结果见图4,并展示了显著性Q值最小的前20个通道。其中7条通道最显著富集(P<0.05),分别是剪接体(ko03040)、Ras信号(Ras蛋白是ras基因表达产物)通路(ko04014)、硒化合物的代谢(ko00450)、SNARE因子在囊泡运输中的相互作用(ko04130)、类固醇生物合成(ko00100)、RNA降解(ko03018)、mRNA监测通路(ko03015)。
通过对差异基因的富集分析和文献检索,发现FoxO3、CTH、TXNRD1、ENOX1涉及4个GO条目和1个KEGG通路,且与蛋白质合成有关,因此这些基因可能与蛋白品质相关;CTH、TXNRD1、TXNRD2、TXNRD3参与硒化合物的代谢信号通路。
2.5 差异蛋白互作网络分析
差异表达基因的相互关系采用 STRING数据库分析,发现互作网络共有1 879个节点和11 035个相互作用(图5),其中,差异表达基因互作主要集中在NCBP1、NCBP2、PTEN、TXNRD1等组装调控上。
3 讨论与结论
独龙鸡来自怒江傈僳族自治州贡山县,为当地的特色地方禽类种类,对独龙鸡习性和种质特性的相关研究相对较少。鸡蛋是人类消费营养食品中优质动物蛋白源之一,具有很大的经济价值。在优质蛋鸡的选育中,通常把产蛋和蛋质性状作为两大指标[6]。因此,本研究采用转录组测序技术对红原鸡和独龙鸡卵巢组织中的差异表达基因进行筛选,并应用生物资料库对不同表达基因参与的生物学过程和信号途径进行研究,在RNA水平上研究独龙鸡种质特性,为以后独龙鸡生产性状的研究,包括优良性状基因的探索以及研究提供了理论依据。
对不同表达基因 GO功能进行分析,结果表明,这些上调基因在细胞膜结构、ATP结合、GTP酶激活以及泛素结合酶等方面具有重要的生物作用。在生物体中,ATP存在于组织细胞内,储存能量以备机体需要[7],ATP酶能够将大量代谢需要的物质输入到细胞中,并将毒素、代谢废物和其他会妨碍细胞过程的物质輸出;GTP类似于ATP,为生物蛋白的合成直接供能[8];生物膜是一种重要的细胞结构[9],它与能量、信息、物质的运输[10]有关,尤其是与膜相关的基因ACPP、APOO、ADGRA2等显著上调有关。基于以上结果,本研究推测相较于红原鸡,独龙鸡有较强的适应能力和抗性,更能够适应高海拔地区的恶劣条件,这为独龙鸡的抗病育种奠定了理论基础。
KEGG通路富集分析显著性最可靠的是Ras信号通路、硒化合物的代谢通路、类固醇生物合成通路、SNARE因子在囊泡运输中的相互作用和剪接体通路。研究表明Ras信号通路与胰岛素和葡萄糖转运蛋白有关[11],葡萄糖运输蛋白是控制葡萄糖代谢的重要载体[12]。葡萄糖可以提高代谢,对肝脏有保护功能,对鸡群尽快恢复体力有很大帮助。SNARE因子是囊泡表面细胞转运的介质,是转运途径中的核心蛋白[5]。SNARE因子在囊泡和靶向细胞的膜之间形成复合物,导致膜融合并且允许囊泡内容物递送到靶细胞中。通过这种方式,SNARE因子在生物合成通路中发挥重要作用,并且在内吞循环通路和受调节的膜运输中同样起着重要作用,如神经分泌或胰岛素的释放[13]。虽然人们对某些系统中SNARE因子介导的膜运输研究较少,但近年来对癌细胞背景下膜运输的研究显著增加[14]。SNARE 介导的侵袭性蛋白质膜的运输有助于膜的重塑以及信号传导成分、黏附受体和 ECM 降解酶的形成[15]。Williams等研究表明,特定的SNARE因子在运输侵入性腺苷酸相关蛋白以促进恶性癌细胞的细胞入侵和迁移中阐明了重要的作用[16]。研究结果表明,独龙鸡相较于红原鸡,具有良好的抗性和耐高压环境,与SNARE因子合成通路有密不可分的关系。
硒作为维持家禽生长所必需的微量元素,具有广泛的作用。鸡体内缺少硒会引起多种疾病,甚至造成死亡。其机制表现为:一是人体内抗氧化酶的形成,可保护细胞膜免遭氧化破坏,并维持其通透性;二是与硒蛋白产生螯合作用,降低有毒物质的毒性。硒被生物学家们称为体内微量元素中的“防癌之王”。硒能提高免疫力,有抗氧化和解毒排毒等作用。硒的最重要的生理功能是构成硒谷胱甘肽过氧化物酶,它将人体细胞代谢产生的无机和有机氧化物转化為水和羟基化合物[17],有效地清除自由基[5],因此硒在人体内参与了抗氧化作用,对机体的抗氧化起到了重要的作用[17]。并且硒可以分解组织中脂质氧化产生的过氧化物的影响,在保护细胞、细胞器和细胞膜结构的完整性和稳定性方面发挥着重要作用[18]。硒能加强身体的免疫系统,并能预防许多疾病,并且对抗衰老和抗肿瘤有比较重要的作用。最新研究表明,硒还与鸡的含硫氨基酸代谢有关,硒与鸡的生长、产蛋率和孵化率也都密切相关[18]。本研究发现,差异基因主要富集在硒化合物的代谢通路中,尤其是大部分富集基因显著上调,如TXNRP1基因显著上调,表明相较于红原鸡,独龙鸡更能够适应高海拔和低温的环境,有较好的免疫能力,并有较强的产蛋能力和较高的蛋品质,且其肉质和蛋中可能富含硒元素,具有较高的肉品质和蛋品质。
独龙鸡与红原鸡均属地方肉蛋兼用型种类,觅食力极强,就巢性好强[2],但独龙鸡生活在高海拔、高寒地区,个体较小,而红原鸡生活于热带森林、次生竹林,海拔1 000 m以上的地方,个体较大。在显著差异表达基因中,本研究发现PTEN和NCBP1显著上调。卵巢是鸡蛋形成的主要部位之一,蛋鸡卵巢的生长发育水平与产蛋水平密切相关。PTEN参与了剪接体通路,该通路中BMP15基因已有研究表明其可调控蛋品质性状[19]。本研究发现PTEN基因在独龙鸡卵巢中高表达,表明其可能通过剪接体通路参与了独龙鸡蛋品质的调控。
鸡蛋的品质可以分为鸡蛋的外在质量和鸡蛋的内部质量[20]。外在质量包含蛋壳硬度、蛋质量、蛋形指数等指标;内在质量一般包含蛋黄品质(蛋黄色泽、蛋黄比重等),蛋清质量(蛋清高度、哈氏单位等)及其余技术指标(结构、味道和香气、健康指数、血斑和肉斑、鸡蛋的功用特点等)。Zhang等研究结果表明,NCBP1的缺失解除了许多基因的表达调控,降低了细胞增殖率[21]。NCBP1对于维持mRNA的表达至关重要,但其功能部分依赖于NCBP3,表明NCBP3可能在mRNA生物过程中充当RNA结合蛋白之间的桥梁,在mRNA输出的上游起作用,RNA免疫沉淀试验表明,NCBP2和NCBP3结合的RNA类型具有特异性[22]。mRNA和核糖体之间有多种结合位点,因此mRNA的转录和翻译、蛋白质的生物合成都和核糖体密不可分。核糖体结构是蛋白质组成的最主要部分[23]。膨大部的核糖体首先组装在mRNA上,然后沿着mRNA链翻译,合成的蛋白质包裹在卵黄的外面,由于输卵管的蠕动,包有蛋白质的卵也跟着旋转前进,逐渐形成卵黄外的浓、稀蛋白层,浓蛋白层越高,对应的哈氏单位值越大,蛋品质就越好。在评价蛋品质高低的诸多性状中,哈氏单位是非常关键的性状之一。本研究发现NCBP1、NCBP2和NCBP3的表达显著上调,这可能提示了独龙鸡与红原鸡相比,具有较高的蛋白比例、蛋白高度等。
本研究利用RNA测序技术分析独龙鸡和红原鸡的基因表达差异,并对独龙鸡和红原鸡卵巢组织的差异表达基因通过GO、KEGG、STRING等进行了富集分析,并筛选得到NCBP1、NCBP2、TXNRD1、PTEN、ENOX1等5个与抗性、产蛋性能和蛋品质相关的重要差异表达基因作为重要性状候选基因。本研究为独龙鸡品种改良、后续基因功能选择和种质特性等研究奠定了基础。
参考文献:
[1]李青青,李沫沫,陈粉粉,等. 独龙鸡生独龙鸡生长曲线拟合分析[J]. 中国家禽,2017,39(24):59-61.
[2]杨国强. 独龙鸡资源保护与开发利用的探索[J]. 云南畜牧兽医,2017(4):16-18.
[3]张 勇,冯冬仙,李 贵. 独龙江乡独龙鸡的生产现状及发展对策[J]. 安徽农业科学,2016,44(14):131-132.
[4]Haunshi S,Burramsetty A K,Kannaki T R,et al. Survivability,immunity,growth and production traits in indigenous and White Leghorn breeds of chicken[J]. British Poultry Science,2019,60(6):683-690.
[5]Gorshtein G,Grafinger O,Coppolino M G. Targeting SNARE-mediated vesicle transport to block invadopodium-based cancer cell invasion[J]. Frontiers in Oncology,2021,11:679955.
[6]贾保中. 硒对鸡的营养作用[J]. 当代畜禽养殖业,2001(5):35-36.
[7]Bonora M,Patergnani S,Rimessi A,et al. ATP synthesis and storage[J]. Purinergic Signalling,2012,8(3):343-357.
[8]Wallin G,Kamerlin S C L,Aqvist J. Energetics of activation of GTP hydrolysis on the ribosome[J]. Nature Communications,2013,4:1733.
[9]李双阳. 生物膜的结构与性质关系的模拟研究[D]. 北京:北京化工大学,2010:136.
[10]Weiss S,Jakobs J,Reemtsma T. Discharge of three benzotriazole corrosion inhibitors with municipal wastewater and improvements by membrane bioreactor treatment and ozonation[J]. Environmental Science & Technology,2006,40(23):7193-7199.
[11]Kozma L,Baltensperger K,Klarlund J,et al. The ras signaling pathway mimics insulin action on glucose transporter translocation[J]. Proceedings of the National Academy of Sciences of the United States of America,1993,90(10):4460-4464.[HJ2mm]
[12]匡鼎偉,吴永贵,陆福明. 葡萄糖转运蛋白与糖尿病肾病[J]. 国外医学:泌尿系统分册,2000(3):109-112.
[13]Steffen A,Le Dez G,Poincloux R,et al. MT1-MMP-dependent invasion is regulated by TI-VAMP/VAMP7[J]. Current Biology,2008,18(12):926-931.
[14]Kean M J,Williams K C,Skalski M,et al. VAMP3,syntaxin-13 and SNAP23 are involved in secretion of matrix metalloproteinases,degradation of the extracellular matrix and cell invasion[J]. Journal of Cell Science,2009,122(22):4089-4098.
[15]Williams K C,Coppolino M G. SNARE-dependent interaction of Src,EGFR and β1 integrin regulates invadopodia formation and tumor cell invasion[J]. Journal of Cell Science,2014,127(Pt 8):1712-1725.
[16]Williams K C,McNeilly R E,Coppolino M G. SNAP23,Syntaxin4,and [JP+2]vesicle-associated membrane protein 7 (VAMP7) mediatetrafficking of membrane type 1-matrix metalloproteinase (MT1-MMP) during invadopodium formation and tumor cell invasion[J]. Molecular Biology of the Cell,2014,25(13):2061-2070.
[17]Gan L P,Zhao Y Z,Mahmood T,et al. Effects of dietary vitamins supplementation level on the production performance and intestinal microbiota of aged laying hens[J]. Poultry Science,2020,99(7):3594-3605.
[18]黄 晶,林伯全. 富硒酵母的营养生理作用及其在鸡生产中的应用[J]. 广东饲料,2013,22(8):32-34.
[19]李洪林,李 维,张福平,等. 思州鸡BMP15基因第1外显子多态性及其与蛋品质的关联分析[J]. 中国畜牧兽医,2019,46(12):3690-3697.
[20]夏佳豪. 汶上芦花鸡蛋品质及其候选基因遗传效应分析[D]. 泰安:山东农业大学,2018:88.
[21]Zhang H J,Wang A,Tan Y L,et al. NCBP1 promotes the development of lung adenocarcinoma through up-regulation of CUL4B[J]. Journal of Cellular and Molecular Medicine,2019,23(10):6965-6977.
[22]Miura P,Coriati A,Bélanger G,et al. The utrophin A 5′-UTR drives cap-independent translation exclusively in skeletal muscles of transgenic mice and interacts with eEF1A2[J]. Human Molecular Genetics,2010,19(7):1211-1220.
[23]Zhao H Y,Wang J S,Qu Y F,et al. Transcriptomic and proteomic analyses of a new cytoplasmic male sterile line with a wild Gossypium bickii genetic background[J]. BMC Genomics,2020,21(1):859.
收稿日期:2022-02-23
基金项目:国家自然科学基金(编号:31902152);云南省教育厅科学研究基金项目(研究生类)(编号:2021Y267);云南省教育厅科学研究基金教师项目(编号:2018JS333);西南林业大学博士科研启动基金(编号:112119);云南省科技厅基础研究项目(编号:2019FD06)。
作者简介:丁玥竹(1997—),女,黑龙江鸡西人,硕士研究生,主要研究方向为动物遗传育种。E-mail:752958200 @qq.com。
通信作者:刘莉莉,博士,副教授,硕士生导师,研究方向为动物遗传育种研究。E-mail:liulily0518@163.com。
