重寄生枝孢菌的鉴定及转录组学分析
2023-06-30梅超余进德隋文静张梦秋杨俊聪陈玉惠李靖
梅超 余进德 隋文静 张梦秋 杨俊聪 陈玉惠 李靖

摘要:从感石楠叶锈病病菌的球花石楠叶片上获得的3株重寄生菌SYC4、SYC23和SYC63,为确定其分类地位及在锈菌孢子诱导下菌丝体基因的表达情况,采用形态学特征结合分子序列分析将菌株鉴定到种,并对重寄生效果较好的菌株SYC63进行转录组测序。结果表明,经鉴定SYC4、SYC23为Cladosporium anthropophilum,SYC63为枝状枝孢菌(C. cladosporioides)。对菌株SYC63获得的转录组数据与不同数据库进行比对,在Nr数据库中有11 002个基因被注释到,除其他物种外,枝孢菌SYC63与南极枝孢菌(Rachicladosporium antarcticum)有2 130个基因相似,所占物种匹配最高;在GO数据库中注释到8 088个基因,基因数量最多的是生物学过程,其次是分子功能和细胞组分。在差异表达基因中发现,与重寄生相关的凝集素、丝裂原活化蛋白激酶(MAPK)信号通路及抗性次级代谢物有关的基因经锈菌孢子诱导后显著上调表达。以上研究为重寄生枝孢菌在植物病害的生物防治应用中提供了菌株来源,并为其重寄生机制的深入研究提供了理论基础。
关键词:重寄生;分子鉴定;石楠锈孢锈菌;枝孢菌;转录组
中图分类号:S476.1;S182文献标志码:A
文章编号:1002-1302(2023)05-0019-11
在自然界中,重寄生(mycoparasitism)在锈病中普遍存在,通过营养关系使寄主植物、病原菌与重寄生菌形成一条完整的食物链[1]。因而利用重寄生菌防治寄主植物的病原菌,是保护生物多样性和植物病害生物防治方面的新途径[2]。目前,已有大量研究利用重寄生菌防治锈病,例如从花棒锈病菌[Uromyces onobrychidis (Desm.) Lev.][3]、樟子松疱锈病病原菌松芍柱锈菌[Cronartium flaccidum (Alb.et Schw.) Wint.][4]、小驳骨锈病[5]和茶藨生柱锈菌(Cronartium ribicola J.C.Fischer)[6]等中分离得到的重寄生菌株在锈病中表现出显著的抑制作用。
园林绿化树种石楠的叶锈病是因石楠锈孢锈菌(Aecidium pourthiaea)[现被更正为文山春孢锈菌(Aecidium wenshanese)]寄生而致病的,其重寄生菌主要包括拟盘多毛孢属(Pestalotiopsis sp.)、枝孢属(Cladosporium sp.)、镰刀菌属(Fusarium sp.)及木霉属(Trichoderma sp.)等多种真菌[7-9]。1815年,Link建立和描述了枝孢属,现在它主要分为三大复合体,即枝状枝孢(C. cladosporioides)、多主枝孢(C. herbarum)和球孢枝孢(C. sphaerospermum),已知的枝孢菌有一半以上属于C. cladosporioides复合体[10]。高度寄生的枝孢菌形态特征主要体现在无性形态上,由于形态鉴定是一个难点,但使用形态及分子联合的方法,200个物种被重新定义,具有较清晰的形态和系统发育界限[10]。分子分析已成为鉴定枝孢属种的有效方法。
近几年,对于重寄生作用机制已经从生理生化及分子水平上展开了相关研究。多数学者认为,重寄生作用机制主要包括酶和毒素2个方面,其中酶方面指的是重寄生菌可产生降解寄主真菌细胞壁的酶,而毒素是重寄生菌与寄主菌相互作用产生的抗菌次级代谢物,能杀死寄主真菌[7,11-13]。随着测序技术的飞速发展,基因组、转录组及代谢组学测序等已被广泛应用于对重寄生菌的研究之中。转录组是指一个细胞在不同生长时期或生长环境下,自身基因的表达情况不完全相同,具有特定的时间性和空间性特征[14]。范海娟通过不同诱导物对哈茨木霉ACC30317进行诱导并转录组测序,分析发现有311条Unigene基因与重寄生机制相关,认为该菌的生防机制是以重寄生为主[15]。Reithner等同样利用转录组测序手段,分析发现重寄生菌木霉IMI206040与立枯丝核菌(Rhizoctonia solani)相互作用后参与细胞壁降解的各类基因协同转录[16]。
实际上多种重寄生菌,特别是枝孢属和锈生座孢属(Tuberculina sp.)的真菌已经克服寄主障碍,显示出寄生物的进化,这将有利于生防菌的开发与利用[17]。笔者所在课题组前期从患石楠锈孢锈菌的球花石楠叶片上分离得到3株重寄生菌,其具有破坏锈孢子壁,导致细胞质外溢而使锈孢子死亡的重寄生能力,而对寄主植物是安全的[7]。对重寄生效果最好的菌株SYC63进行了基因组测序并初步分析了重寄生机制,发现其真菌细胞壁降解酶类中的几丁质酶(GH18、GH20家族)基因、β-1,3-葡聚糖酶(GH17、GH64和GH81家族)基因在经锈菌孢子壁诱导后表达量显著上调[18]。本研究拟将3株枝孢菌鉴定到种,同时利用课题组前期获得的枝孢菌SYC63转录组数据进行生物信息学分析,以期为促进枝孢菌SYC63重寄生作用机制的研究提供理论依据。
1 材料与方法
1.1 试验材料
试验时间为2020年9月至2021年12月。试验地点位于云南省西南林业大学生命科学学院。
试验菌株为编号是SYC4、SYC23和SYC63的3株重寄生菌,于2012年9月分离自患石楠叶锈病的球花石楠叶片上,并保存于4 ℃[7]。
1.2 試验方法
1.2.1 枝孢菌的鉴定
对分离得到的3株重寄生菌采用PDA培养基[6]进行培养。通过常规形态学方法并结合分子生物学方法进行重寄生菌的种鉴定。通过查阅相关文献进行形态学鉴定,主要是记录菌株培养性状、分生孢子的形态及大小等。分子鉴定参照隋国强等的方法[19],提取菌株DNA,于-20 ℃保存备用。以ITS5(5′-GGAAGTAAAAGTCGTAACAAG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)为引物扩增内转录间隔区基因;以EF-1-F(5′-CATCGAGAAGTTCGAGAAGG-3′)/EF-1-R(5′-TACTTGAAGGAACCCTTACC-3′)为引物扩增翻译延伸因子1-α基因;以ACT-F(5′-ATGTGCAAGGCCGGTTTCGC-3′)/ACT-R(5′-TACGAGTCCTTCTGGCCCAT-3′)为引物扩增肌动蛋白基因[20-22]。扩增产物纯化和测序由生工生物工程(上海)股份有限公司完成。
1.2.2 系统发育树的构建
对测序所得的3个序列在NCBI数据库中进行BLAST搜索,确定最可能的近缘类群。然后进行基因序列查找及多序列拼接,再查阅文献下载已报道的近缘种基因序列片段,将基因序列数据集通过MAFFT(https://mafft.cbrc.jp/alignment/software/)网站进行比对,再利用BioEdit手工编辑并将联合基因序列校正,以fasta格式的组合数据集在ClustalX中存为nexus格式。利用PAUP4.0b10软件,输入程序,以非加权最大简约(MP)法构建系统发育树[20-21]。最后结合形态观察的菌落形状、颜色和分生孢子形态特征等,对比Bensch等研究[23]中菌株形态特征,通过分子鉴定结合形态鉴定将3株重寄生菌鉴定到种。
1.2.3 转录组测序及分析
在前期研究中参照周航等的锈菌孢子壁诱导方法[24],采集西南林业大学树木园内的石楠叶锈病病菌锈孢子,对重寄生效果较好的菌株SYC63进行诱导后提取菌丝体RNA,检测合格的RNA用于文库构建,利用Illumina平台进行测序获得转录组数据。将下机数据进行过滤得到整洁数据(Clean Data),与指定的参考基因组(枝孢菌SYC63:GCA_022457075.1)进行序列比对,得到映射数据(Mapped Data),进行插入片段长度检验、随机性检验等文库质量评估;根据基因在不同样品中的表达量进行差异表达分析、差异表达基因功能注释和功能富集等表达水平分析。
2 结果与分析
2.1 重寄生菌的鉴定
对分离得到的3株重寄生菌内转录间隔区、翻译延伸因子(EF)-1和肌动蛋白(ACT)基因片段进行扩增并测序,利用单基因及多基因序列联合构建系统发育树。用内转录间隔区(ITS)序列构建系统发育树结果(图1)显示:3株重寄生菌SYC4、SYC23和SYC63聚在同一个分支上,支持率为66%,其中SYC4和SYC23在分支上的距离相对较近,SYC63与两者相距较远,同时三者还与枝孢属的已知物种C. anthropophilum、C. cladosporioides、角枝孢菌(C. angustisporum)、黑星病菌(C. cucumerinum)等聚在一支,不能够说明其亲缘关系,无法单以此系统发育树来作为鉴定种的依据,还需进一步证明。
基于3个基因片段联合构建的系统发育树(图2)显示,SYC4与SYC23聚在同一个分支,支持率为97%,又与C. anthropophilum在同一个大支上,支持率为100%,表明SYC4与SYC23亲缘关系较近,且两者与C. anthropophilum的亲缘关系较近;SYC63与C. cladosporioides的2个菌株(CPC 14021和CPC 14024)在同一个大分支上,支持率为97%,而C. cladosporioides的2个菌株又聚在同一支,支持率为96%,说明SYC63与 C. cladosporioides 的亲缘关系较近。再根据菌株的菌落形态、分生孢子的大小、孢子颜色等形态特征进行对比,最终鉴定SYC4、SYC23为C. anthropophilum,SYC63为枝状枝孢霉(C. cladosporioides)。
2.2 转录组分析
2.2.1 RNA提取与测序数据统计
分别对对照组(SYC63-C)和锈孢子壁处理组(SYC63-S)的6个菌丝体提取RNA进行质量检测, 其D260 nm/D280 nm分别为1.76、1.77、1.90、2.19、2.03、2.07,说明所提取的RNA纯度高,杂质污染较少,样品质量能满足建库要求,可进行上机测序。利用Illumina平台对本研究的6个样品进行转录组测序,共获得41.78 GB测序数据,各样品总碱基数(Clean Reads)均达到 6.48 GB,Q30碱基百分比在94.18%及以上。分别将各样品的Clean Reads与枝孢菌SYC3的基因组进行序列比对,发现比对效率为92.06%~95.93%(表1),说明测序数据可靠。
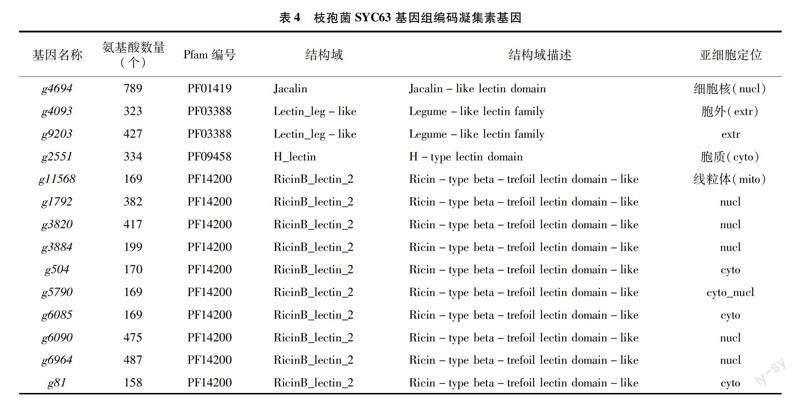
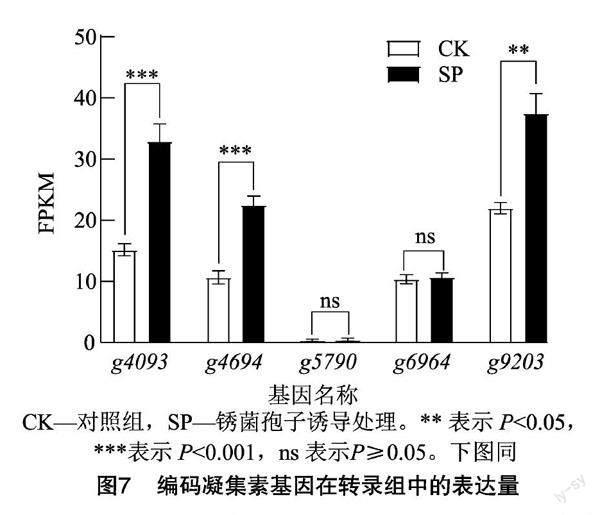
将参考基因组的12 327个基因比对到转录组表达量中,结果(表2)显示,经锈孢子壁诱导处理后,有95.80%的基因表达,表达丰度分布在中高表达(10 2.2.2 Nr数据库比对分析 通过Nr数据库比对注释,共有11 002个基因被注释到,统计比对最多的前 9 个物种,其余划分到其他(Other)类,物种分布如图3所示,枝孢菌SYC63与南极枝孢菌(Rachicladosporium antarcticum)的相似基因最多,有2 130个基因,占19.36%,除其他物种外,所占物种相似性最高;其次与Rachicladosporium sp.有13%的相似基因。此外,与病原真菌Hortaea werneckii、Zasmidium cellare及Venturia nashicola等也有2%~8%[CM(20*2]的相似基因。 值得關注的是, 有41%的序列属于其他物种,可能包含了枝孢菌SYC63与大多数物种不同的、自身特有的基因序列。 2.2.3 KOG数据库比对分析 在KOG数据库中枝孢菌SYC63共比对到4 948个基因,占总基因的38.4%,可被划分到25类相应的功能中。由图4可知,数量最多的功能类别是一般功能预测(general function prediction only),其次是翻译后修饰,蛋白质转换,伴侣(posttranslational modification,protein turnover,chaperones)441个基因、碳水化合物的运输和代谢(carbohydrate transport and metabolism)370个基因及信号转导机制(signal transduction mechanisms)342个基因。 2.2.4 GO分类 GO数据库是一个结构化的标准生物学注释系统,旨在建立基因及其产物知识的标准词汇体系,适用于各个物种。对枝孢菌SYC63转录组进行GO功能注释,共8 088个基因被注释到。将基因的功能从细胞组分、分子功能、生物学过程等3个方面进行汇总统计后,结果如表3所示。枝孢菌SYC63编码的基因主要富集在生物调节、细胞过程和代谢过程等生物过程;其次是在催化活性、结合和转运活性等分子功能中;较少的基因被注释到细胞组分中的细胞主体、胞内区和含有蛋白质的复合体。 2.2.5 差异基因筛选与功能注释 将差异倍数(fold change)≥2且错误发现率(FDR)<0.01作为差异表达基因(DEGs)筛选标准,共得到3 196个DEGs,其中有1 674个上调基因、1 522个下调基因。对差异表达基因进行GO分类注释,结果表明注释数量最多的生物过程主要是代谢过程、细胞过程、单一生物体过程及定位;其次是催化活性、结合和转运活性等分子功能组成;以及膜(membrane)和膜成分(membrane part)等细胞组分。这与枝孢菌SYC63的GO注釋结果在整体上是一致的,但经锈菌孢子壁诱导后细胞组分则是富集到细胞器、膜和膜成分等类别(图5)。 进一步对1 674个上调基因的GO注释进行分析,结果表明,在生物学过程中,主要富集在几丁质生物合成过程(chitin biosynthetic process)、肌动蛋白丝的过程(actin filament-based process)及肌动蛋白丝的调节过程(regulation of actin filament-based process)等; 而细胞组分主要是膜,比如高尔基体相关囊泡(Golgi-associated vesicle)、囊泡外套(vesicle coat)、囊泡膜(vesicle membrane)等类型的基因富集;分子功能也显示基因主要在几丁质合成酶活性(chitin synthase activity)、铁结合(ferric iron binding)及氧化还原酶活性(oxidoreductase activity)等的类别富集。 分析差异表达基因在某一通路上是否发生显著差异即为差异表达基因的通路富集分析,选取显著性Q值最小的前20个通路进行作图,结果如图6所示,可以看出,差异表达基因KEGG通路(pathway)数量最多的是碳水化合物(carbon metabolism),其次是色氨酸代谢(tryptophan metabolism)、缬氨酸、亮氨酸和异亮氨酸的降解(valine,leucine and isoleucine degradation)及氨基酸糖和核苷酸糖的代谢(amino sugar and nucleotide sugar metabolism)。表明经锈菌孢子壁诱导后差异基因在碳水化合物代谢途径存在显著差异,其可能是枝孢菌SYC63重寄生作用的一个重要组成部分。 2.2.6 重寄生相关的差异基因分析 凝集素是一种糖结合蛋白,可以特异地结合某种单糖或复杂的糖链结构,真菌凝集素是一类主要的凝集素,可以结合宿主的特定碳水化合物结构,起到识别和黏附的作用,或作为一种毒性因子在真菌对捕食者和寄生虫的防御中发挥作用[25]。枝孢菌SYC63基因组编码14个凝集素基因,包括10个蓖麻毒素B类的凝集素、 2个类似于伴刀豆蛋白的凝集素、1个甘露糖结合凝集素和1个H型凝集素(表4)。在经锈菌孢子诱导后,检测到5个凝集素基因上调表达,其中类似于伴刀豆蛋白的凝集素(g4093、g9203)和甘露糖结合凝集素(g4694)的基因显著上调,2个蓖麻毒素B类的凝集素(g5790、g6964)基因上调不显著(图7)。 其他重寄生或生物防治功能相关的基因,主要涉及到转录因子、细胞壁修复信号通路(MAPK singal pathway)及与抗生素代谢产物合成有关的细胞色素P450等。枝孢菌SYC63转录组数据中注释到了87个P450基因,此外,还有71个基因在KEGG pathway中注释为MAPK信号途径(ko04011),在经锈孢子诱导后分别检测到22及15个上调表达的差异基因,大部分基因都表现出极显著(P<0.000 1)上调(图8)。 3 讨论与结论 枝孢菌具内生、人类致病、植物致病、腐生营养和极端环境生长等多种生态适应性[10]。已知的大多数枝孢菌物种是与植物相关的,常在植物叶片上产生危害且形成病斑。利用重寄生菌专性寄生而减少寄主植物受到的伤害特性,防治植物病害是生物防治的新措施[11,26]。近期的研究也表明,枝孢菌分泌的次生代谢产物在提高植物适应新生境能力,免受生物和非生物胁迫方面具有保护作用,因而作为植物生物刺激剂在农业应用中具有指导意义[27]。 将分子生物学的方法用于枝孢菌的分类鉴定,利用多基因复合序列构建系统发育树并结合形态学,解决了形态特征分类上的难题。目前,枝孢属真菌的物种鉴定主要基于3种遗传标记,即rDNA的内部转录间隔区、肌动蛋白和翻译延伸因子(EF-1α)基因的部分片段,前者不能提供良好的物种分辨率,后两者却表现出物种间高度的差异[28]。Bensch等利用三者组合对三大复合体中的其他类群进行了分子系统发育研究,来解释枝孢属的多样性和进化趋势[29]。Iturrieta-González等也利用此系统鉴定了不同环境来源中的枝孢菌,并报道其中发现的新物种,扩大了枝孢菌物种资源[30-31]。此外,也有学者用ITS和核糖体小亚基(SSU)编码SSU序列鉴定了香蕉煤污病病原菌为枝状枝孢霉[32],为枝孢属的分子鉴定提供了可供选择的多个基因片段。 重寄生是微生物微观世界中一个重要现象,了解其发生机制可以有效提高对植物病原体的生物防治。在对广谱生防真菌木霉的重寄生机制研究中发现,其主要是通过分泌一系列胞壁降解酶如葡聚糖酶、几丁质酶和壳聚糖等参与重寄生作用[33]。本研究对重寄生枝孢菌SYC63利用锈菌孢子壁诱导后进行转录组测序,分析发现,其在KOG功能中有370个基因注释到碳水化合物的转运与代谢,且受锈菌孢子壁的诱导后差异基因的KEGG通路也显著富集到该方面,说明该菌有较好的碳水化合物代谢能力,其可能是重寄生作用中重要的一部分。 研究表明,木霉的重寄生过程是复杂的,除胞壁降解酶外,次级代谢物、转运蛋白、热激蛋白及效应因子等也参与了重寄生过程[34]。凝集素具有独特的识别和可逆结合特定碳水化合物配体的能力,无需任何化学修饰,这一特征使凝集素有别于其他碳水化合物结合蛋白和酶[35]。通过对轮枝菌凝集素(SRL)及其推定的内源性受体的研究结果表明,细胞壁相关的凝集素在真菌发育过程中发挥着重要的生物学功能[36]。据报道,一种具有生物活性的向日葵甘露糖结合凝集素(Helja)参与了植物对真菌的识别和防御,其与真菌孢子表面的相互作用穿透质膜,也可内化到细胞内诱导氧化应激,最终导致细胞死亡。Del Rio等提出它最初是与真菌细胞壁碳水化合物相互作用,并进一步内化,通过被定位到不同的细胞器,从而激活与细胞死亡相关的信号通路的抗菌机制[35]。从Parkia platycephala种子中分离纯化得到一个凝集素PPL2,能水解几丁质中连接 2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖单元的β-1,4糖苷键,通过N末端测序、基因克隆全长及X射线结晶学建立三维结构,结果表明,该凝集素與GH18家族的内切几丁质酶同源,具有 N-乙酰氨基葡萄糖结合和几丁质水解酶活性[37]。在本研究中,重寄生枝孢菌SCY63基因组中有14个凝集素编码基因,在锈菌孢子诱导后,检测到5个基因上调表达,其中1个甘露糖结合凝集素显著上调表达。推测在重寄生过程中其可能与真菌细胞壁表面的碳水化合物结合产生间接的影响,从而引起细胞损伤,造成寄主死亡。 MAPK信号通路对细胞的糖基化状态敏感,可调控胞壁蛋白的表达并修复极端环境下细胞壁的损伤,保持细胞壁完整,是胁迫环境下菌丝体正常生长的必要信号途径,并在生防菌对病原菌的攻击以及菌丝形成中起着重要作用[38]。几丁质是许多真菌细胞壁的主要结构成分,它是由尿苷二磷酸 N-乙酰氨基葡萄糖(UDP-GlcNAc)经几丁质合成酶生物合成的,真菌中的细胞壁应激反应通常可能导致几丁质生物合成途径的激活[39]。细胞色素P450可催化某些具有重要生理功能的内源性物质的生物合成,并在次级代谢产物的修饰中起重要作用,其含量高表明可能存在更多类型的次级代谢产物[40]。本研究中,枝孢菌SYC63在经锈菌孢子诱导后差异基因中上调表达数量明显多于下调表达基因数量,进一步分析显示上调表达的基因功能主要富集在质膜成分和几丁质合成酶活性等功能,同时MAPK信号通路基因也显著上调表达。推测可能是枝孢菌SYC63在接触病原菌后启动应激反应,调动重寄生功能相关基因或存在不利环境相关基因上调表达,而MAPK信号和几丁质合成酶参与合成的几丁质都保持了细胞壁的完整性,从而有利于寄生菌成功进入寄主,完成利于自身的侵染过程,即重寄生过程。 本研究利用形态学观察结合分子鉴定,构建系统发育树,最终将SYC4、SYC23鉴定为C. anthropophilum,将SYC63鉴定为C. cladosporioide,明确了菌株分类地位;对菌株SYC63的转录组测序数据进行了生物信息学分析,发现与重寄生相关的基因受锈菌孢子壁诱导而显著上调表达,推测其可能参与了菌株SYC63重寄生的过程,为后续深入研究该菌的重寄生机制提供了理论基础与基因数据资源。 参考文献: [1]黄丽丹. 茶藨生柱锈重寄生菌(Pestalotiopsis sp.)的生物学特性及毒素研究[D]. 昆明:西南林学院,2006. [2]李 利. 白粉菌重寄生真菌的分离鉴定及生物学特性研究[D]. 杨凌:西北农林科技大学,2016. [3]袁秀英,白玉明,袁登胜. 重寄生菌对花棒锈病的抑制作用[J]. 中国沙漠,2006,26(6):1020-1023. [4]邓 勋,张素华,宋小双,等. 樟子松疱锈病重寄生菌的分离鉴定[J]. 中国森林病虫,2012,31(2):4-6,10. [5]廖咏梅,熊 英,罗荡平,等. 小驳骨锈病的重寄生现象及重寄生菌鉴定(英文)[J]. 中国生物防治学报,2008,24(增刊1):85-89. [6]李 靖,刘风路,陈玉惠. 茶麃生柱锈菌重寄生拟盘多毛孢产毒培养条件的筛选[J]. 江西农业大学学报,2017,39(2):395-401. [7]李梦婕,谢 津,李向楠,等. 石楠锈孢锈菌重寄生现象及其重寄生菌的种类鉴定[J]. 东北林业大学学报,2016,44(5):92-96. [8]蔡 灿,伍建榕. 球花石楠锈病病原物的初步研究[J]. 北方园艺,2008(1):208-210. [9]庄剑云,魏淑霞. 中国无性型锈菌新资料 Ⅰ. 春孢子阶段的几个式样种[J]. 菌物学报,2016,35(12):1468-1474. [10]Ma R,Chen Q,Fan Y L,et al. Six new soil-inhabiting Cladosporium species from plateaus in China[J]. Mycologia,2017,109(2):244-260. [11]杨艳红,陈玉惠. 植物病原菌重寄生菌作用机理的研究进展[J]. 西南林学院学报,2004,24(2):70-75. [12]尤佳琪,吴明德,李国庆. 木霉在植物病害生物防治中的应用及作用机制[J]. 中国生物防治学报,2019,35(6):966-976. [13]童晓茹,王学翠,温学森,等. 植物叶片真菌病害生物防治的研究进展[J]. 山东科学,2008,21(1):41-46. [14]Velculescu V E,Zhang L,Zhou W,et al. Characterization of the yeast transcriptome[J]. Cell,1997,88(2):243-251. [15]范海娟. 哈茨木霉ACCC30371菌株转录组构建及生防相关基因功能研究[D]. 哈尔滨:东北林业大学,2013. [16]Reithner B,Ibarra-Laclette E,Mach R L,et al. Identification of mycoparasitism-related genes in Trichoderma atroviride[J]. Applied and Environmental Microbiology,2011,77(13):4361-4370. [17]趙桂华,管 斌,刘国华. 林木锈病生物防治的研究进展[J]. 江苏农业科学,2010,38(4):115-116,192. [18]梅 超,范世昌,艾小满,等. 一株重寄生枝孢菌的基因组测序及重寄生机制分析[J]. 微生物学通报,2022,49(8):3310-3323. [19]隋国强,张登云,孔 磊,等. 石楠锈孢锈菌重寄生菌的鉴定及产毒培养基筛选[J]. 生物技术通报,2020,36(7):104-111. [20]吕靖雯,刘 蕊,李国华,等. 柚果面枝孢菌斑点病病原鉴定[J]. 浙江大学学报(农业与生命科学版),2018,44(6):687-694. [21]Tibpromma S,Mortimer P E,Karunarathna S C,et al. Morphology and multi-gene phylogeny reveal Pestalotiopsis pinicola sp.nov.and a new host record of Cladosporium anthropophilum from edible pine (Pinus armandii) seeds in Yunnan Province,China[J]. Pathogens (Basel,Switzerland),2019,8(4):285. [22]Carbone I,Kohn L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia,1999,91(3):553-556. [23]Bensch K,Braun U,Groenewald J Z,et al. The genus Cladosporium[J]. Studies in Mycology,2012,72:1-401. [24]周 航,鲍泽然,施玉玲,等. 4种木霉对松疱锈病菌细胞壁的破坏作用[J]. 西南林业大学学报(自然科学),2017,37(4):120-125. [25]Liu M J,Cheng X W,Wang J C,et al. Structural insights into the fungi-nematodes interaction mediated by fucose-specific lectin AofleA from Arthrobotrys oligospora[J]. International Journal of Biological Macromolecules,2020,164:783-793. [26]陈广艳.国内研究植物锈菌重寄生菌的现状[J]. 安徽农业科学,2006,34(8):1531-1532. [27]Rǎut I,Cǎlin M,Caprǎ L,et al. Cladosporium sp. Isolate as fungal plant growth promoting agent[J]. Agronomy,2021,11(2):392. [28]Torres D E,Rojas-Martínez R I,Zavaleta-Mejía E,et al. Cladosporium cladosporioides and Cladosporium pseudocladosporioides as potential new fungal antagonists of Puccinia horiana Henn.,the causal agent of chrysanthemum white rust[J]. PLoS One,2017,12(1):e0170782. [29]Bensch K,Groenewald J Z,Meijer M,et al. Cladosporium species in indoor environments[J]. Studies in Mycology,2018,89:177-301. [30]Iturrieta-González I,García D,Gené J. Novel species of Cladosporium from environmental sources in Spain[J]. MycoKeys,2021,77:1-25. [31]马 锐. 土壤枝孢菌的分离鉴定及极端木聚糖酶的功能验证[D]. 北京:中国农业大学,2017. [32]杨 迪,杜婵娟,叶云峰,等. 广西香蕉煤污病病原菌的分离鉴定及其生物学特性[J]. 植物病理学报,2021,51(4):507-514. [33]Naher L,Yusuf U K,Habib S,et al. Mycoparasitism activity of Trichoderma harzianum associated with chitinase expression against Ganoderma boninense[J]. Pakistan Journal of Botany,2018,50(3):1241-1245. [34]赵会长. 盾壳霉基因组学及其重寄生机制研究[D]. 武汉:华中农业大学,2020. [35]Del Rio M,de la Canal L,Pinedo M,et al. Internalization of a sunflower mannose-binding lectin into phytopathogenic fungal cells induces cytotoxicity[J]. Journal of Plant Physiology,2018,221:22-31. [36]Swamy B M,Bhat A G,Hegde G V,et al. Immunolocalization and functional role of Sclerotium rolfsii lectin in development of fungus by interaction with its endogenous receptor[J]. Glycobiology,2004,14(11):951-957. [37]Cavada B S,Moreno F B B,da Rocha B A M,et al. cDNA cloning and 1.75 crystal structure determination of PPL2,an endochitinase and N-acetylglucosamine-binding hemagglutinin from Parkia platycephala seeds[J]. The FEBS Journal,2006,273(17):3962-3974. [38]劉 青.哈茨木霉菌拮抗辣椒疫霉的转录组学研究[D]. 贵阳:贵州大学,2019. [39]Obi K,Uda J I,Iwase K,et al. Novel nikkomycin analogues:inhibitors of the fungal cell wall biosynthesis enzyme chitin synthase[J]. Bioorganic & Medicinal Chemistry Letters,2000,10(13):1451-1454. [40]Cˇrenar B,Petricˇ . Cytochrome P450 enzymes in the fungal kingdom[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics,2011,1814(1):29-35. 收稿日期:2022-03-09 基金项目:云南省农业基础研究联合专项面上项目[编号:2017FG001(-043)];中央引领地方科技发展专项资金(编号:219001);云南省教育厅科学研究基金(编号:2021Y270)。 作者简介:梅 超(1996—),女,云南昭通人,硕士研究生,主要从事资源微生物的开发与利用研究。E-mail:1498789618@qq.com。 通信作者:李 靖,博士,副教授,硕士生导师,主要从事微生物生理生化研究。E-mail:lijingcas@163.com。
