人参皂苷Re通过TRPC介导的钙信号通路改善自发性高血压大鼠左心室肥厚
2023-06-30李孟婷杨丹莉
王 晶,李孟婷,邓 江,杨丹莉,高 杨
(遵义医科大学 1.药学院;2.基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099)
高血压是最常见的心血管疾病之一,全世界约有25%成年人患有高血压,且患病率随年龄的增加而增长[1]。在中国,约有2.45亿成年人深受高血压困扰[2]。高血压是心脏相关疾病发病率的重要风险因素之一,左心室是高血压的主要损害靶点[3]。高血压使左心室压力和室壁张力增加,后负荷增加,最初左心室为了适应这种压力超负荷状态,心肌细胞通过增加肌节生长以维持心脏的正常功能,表现为心肌细胞体积的增加,但随着时间的推移,长期的刺激会导致这种适应性生长失代偿,并导致细胞核内基因转录的改变,发展成为病理性左心室肥厚(left ventricular hypertrophy,LVH)[4]。LVH是心脏事件的独立危险因素,也是左心室重构及心脏损伤的主要表现之一[4],会增加心力衰竭的风险。及时减轻LVH能够改善心室重构及心脏损伤的发生,维持心脏功能,降低心力衰竭的发病率及死亡率,因此对LVH治疗的研究具有重要意义。
Ca2+是心肌细胞兴奋-收缩偶联的基础,也是细胞内多种钙信号相关通路转导的核心调控因子,调控下游基因表达,参与调节不同的细胞功能[5]。经典瞬时受体电位通道(transient receptor potential canonical channel,TRPC)是一种非选择性阳离子通道,其过度表达会导致细胞内Ca2+浓度(intracellular calcium ion concentration,[Ca2+]i)的上升[6],并且能通过激活钙调神经磷酸酶(calcineurin,CaN)/活化T细胞核因子(nuclear factor of activating T cell,NFAT)[7]和(或)钙调蛋白依赖性蛋白激酶Ⅱ(cam-dependent protein kinase Ⅱ,CaMKⅡ)/组蛋白脱乙酰酶(histone deacetylase,HDAC)2种钙信号转导途径参与心功能的调节[8]。有大量的研究表明TRPC在多种体内外模型中参与心肌肥厚的调节,并被确定为心肌肥厚的重要调节因子。如Zou等[7]研究表明自发性高血压大鼠(spontaneously hypertensive rats,SHR)LVH的发生发展与TRPC1/CaN/NFATc3信号通路的上调有关。还有研究表明TRPC3表达在主动脉弓缩窄(transverse aortic constriction,TAC)诱导的大鼠左心室肥厚中上调[9]。此外,TRPC1/C4介导成年大鼠心肌细胞中的背景Ca2+进入,作为神经体液和压力超负荷诱导的心肌肥厚的关键介导物[10]。
人参皂苷Re(Ginsenoside Re,GS-Re)属于三醇类皂苷,是中药人参的主要活性成分之一,具有多种药理作用[11],常用于心脏相关疾病的治疗中。此前曾有研究表明GS-Re能通过AMPK/TGF-β1/Smad2/3和FAK/PI3K p110a/Akt信号通路改善心肌梗死引起的心功能障碍及左心室重构[12],也能通过抑制缺氧诱导因子1(hypoxia-inducing factor 1,HIF-1α)的泛素化避免心脏因缺氧/复氧(hypoxia/reoxygenation,H/R)而导致的损伤[13]。Kim等[14]研究则表明GS-Re能够通过抑制[Ca2+]i发挥抗缺血,保护心脏的作用。而GS-Re对左心室肥厚是否也有改善作用以及其对LVH的影响是否与TRPC介导的钙信号转导有关仍需要探究。
1 材料与方法
1.1 主要药品与试剂 人参皂苷Re(纯度≥98%,南京泽朗生物科技有限公司);高效RIPA组织/细胞快速裂解液(R0010,北京索莱宝科技有限公司);BCA蛋白浓度测定试剂盒(PC0020,北京索莱宝科技有限公司);改良Masson三色染色试剂盒(G1346,北京索莱宝科技有限公司);TRPC1抗体(A4016,Abclonal),TRPC3抗体(A7742,Abclonal),TRPC6抗体(18236-1-AP,Proteintech),CaN抗体(13422-1-AP,Proteintech),CaMKⅡδ抗体(20667-1-AP,Proteintech),GAPDH(10494-1-AP,Proteintech),Goat Anti-Rabbit IgG(SA00001-2,Proteintech)。
1.2 仪器 Kent Scientific CODA八通道无创血压测量仪(美国Kent公司);Vevo2100高分辨动物超声影像系统(加拿大VisualSonics公司);自动染色机(LEICA AUTOSTAINER XL公司);Multiskan全波长酶标仪(美国Thermo公司);BX43正置显微镜(日本Olympus公司);Trans-Blot Turbo半干转印槽(美国伯乐公司)。
1.4 实验方法
1.4.1 收缩压测量 测量前先预热仪器,然后将大鼠放入固定盒中固定,将加压圈套在鼠尾上,在避光、安静的环境下测量,每周1次,周期为12周。
1.4.2 动物超声 使用2%戊巴比妥钠麻醉,剔除大鼠前胸被毛,采用Vevo 2100高分辨动物超声影像系统检测各组大鼠左心室结构和功能相关参数,包括校正左心室质量(left ventricular mass corrected,LVMcor);舒张末期左心室前壁厚度(left ventricular anterior wall diastole,LVAWd);舒张末期左心室后壁厚度(left ventricular posterior wall diastole,LVPWd)。
1.4.3 心脏质量指数和左心室肥厚指数 给药12周后,称量大鼠体重(body weight,BW),然后处死大鼠并迅速取出心脏,用预冷的PBS溶液清洗干净,分离左心室,用滤纸吸干水分后,称量心脏重量(heart weight,HW)、左心室重量(left ventricular weight,LVW),根据公式计算得出大鼠心脏质量指数(heart mass index,HMI)和左室肥厚指数(left ventricular hypertrophy index,LVHI)。HMI=HW/BW,LVHI=LVW/BW。
1.4.4 组织染色 将各组大鼠左心室组织在10%甲醛中固定24 h后,脱水,将组织用石蜡包埋,制备组织切片。脱蜡后分别进行苏木素-伊红(Hematoxylin-exsin,H&E)染色和Masson染色。然后在显微镜下观察大鼠心肌横切面、纵切面的组织形态及心肌组织间质部位以及血管周围胶原纤维的沉积情况,并用Image J软件分析心肌细胞横截面积和心肌胶原纤维沉积百分比。
1.4.5 Western blot 取左心室组织适量,加入适量裂解液(RIPA裂解液∶PMSF=100∶1),冰上研磨,超声,确保充分裂解,在4 ℃,12 000 r/min离心10 min后取上清液,采用BCA法检测蛋白浓度。用7.5%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转移到PVDF膜上,用无蛋白快速封闭液室温封闭20 min,然后在4 ℃孵育一抗过夜,包括TRPC1(1∶1 000)、TRPC3(1∶1 000)、TRPC6(1∶1 000)、CaN(1∶1 000)、CaMKⅡδ(1∶1 000)和GAPDH(1∶5 000)。TBST洗膜3次,并在室温与稀释的辣根过氧化物酶标记的山羊抗兔抗体(1∶10 000)孵育1 h,TBST洗膜3次,之后使用ECL超灵敏化学发光试剂盒显色,最后用Image J软件对结果进行分析。
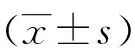
2 结果
2.1 GS-Re对SHR收缩压的影响 每周测量各组大鼠收缩压,结果如图1所示,与对照组相比,随着周龄增加,26周龄模型组大鼠收缩压逐渐升高,且显著高于对照组(P<0.05)。与模型组相比,给予GS-Re治疗后,SHR收缩压均有不同程度的下降,16周龄时各剂量组均具有统计学意义(P<0.05),其中以GS-Re 40组降压作用最明显,与卡托普利组降压作用接近,二者无显著性差异(P>0.05),但仍显著高于26周龄对照组收缩压(P<0.05)。上述结果表明GS-Re对SHR的收缩压有一定的降压作用。
条码扫描仪:接收控制中心指令,同时扫描保护装置机箱条码并传递给控制中心。本系统采用左右两个工装台进行交替式测试,智能测试控制中心根据扫描仪的ID号进行左右测试子系统的识别与控制。

*:与WKY 比较,P<0.05 ;#:与Model比较,P<0.05 ;n=8。图1 GS-Re对SHR收缩压的影响
2.2 GS-Re对SHR左心室结构的影响 采用超声心动图观察各组大鼠左心室结构。如图2所示,与26周龄对照组相比,模型组LVMcor、LVAWd和LVPWd显著增加(P<0.05)。26周龄时,随着给药量的递增,GS-Re 20组和GS-Re 40组能显著降低SHR的LVMcor、LVAWd和LVPWd(P<0.05)。

A:超声心动图代表图;B:校正左心室质量统计结果;C:舒张末期左心室前壁厚度统计结果;D: 舒张末期左心室后壁厚度统计结果;*:与WKY 比较,P<0.05; #:与Model 比较,P<0.05;n=6。图2 GS-Re对SHR左心室结构和功能的影响
上述结果表明GS-Re能够有效改善SHR左心室结构。
2.3 GS-Re对SHR心脏质量指数和左心室肥厚指数的影响 高血压引发的心肌肥厚首先表现为心脏总体重量的增加,主要受累部位为左心室,表现为左心室质量增加,因此采用HMI和LVHI来评估肥厚的情况,结果如图3所示,与26周龄对照组相比,模型组HMI和LVHI值均明显增大(P<0.05)。给予GS-Re 12周后,与模型组比较,GS-Re 20组和GS-Re 40组HMI和LVHI显著性减小(P<0.05)。该结果表明GS-Re能够改善SHR的HMI和LVHI。
A:心脏质量指数;B:左心室肥厚指数;*:与WKY 比较,P<0.05; #:与Model 比较,P<0.05;n=7。图3 GS-Re对SHR左心室肥厚的影响
2.4 GS-Re对SHR心肌组织形态改变的影响
2.4.1 H&E染色 为了更进一步观察各组大鼠心肌组织形态的变化,运用H&E染色观察大鼠心肌细胞形态大小及心肌纤维排列情况。结果如图4所示,显微镜下观察发现,26周龄时对照组大鼠心肌纤维排列整齐,心肌细胞形态大小正常,而模型组大鼠心肌纤维排列紊乱,心肌细胞束出现断裂,心肌细胞横截面积显著增大(P<0.05)。GS-Re 20和GS-Re 40给药后,较模型组心肌细胞横截面积明显缩小(P<0.05)。结果表明GS-Re能够改善SHR的心肌组织形态。

A:WKY;B:Model;C:GS-Re 10;D:GS-Re 20;E:GS-Re 40;F:Captopril;G:心肌细胞横截面积统计结果;标尺=20 μm;*:与WKY比较, P<0.05; #:与Model比较, P<0.05;n=7。图4 GS-Re对SHR左室心肌组织病理形态及心肌细胞大小的影响
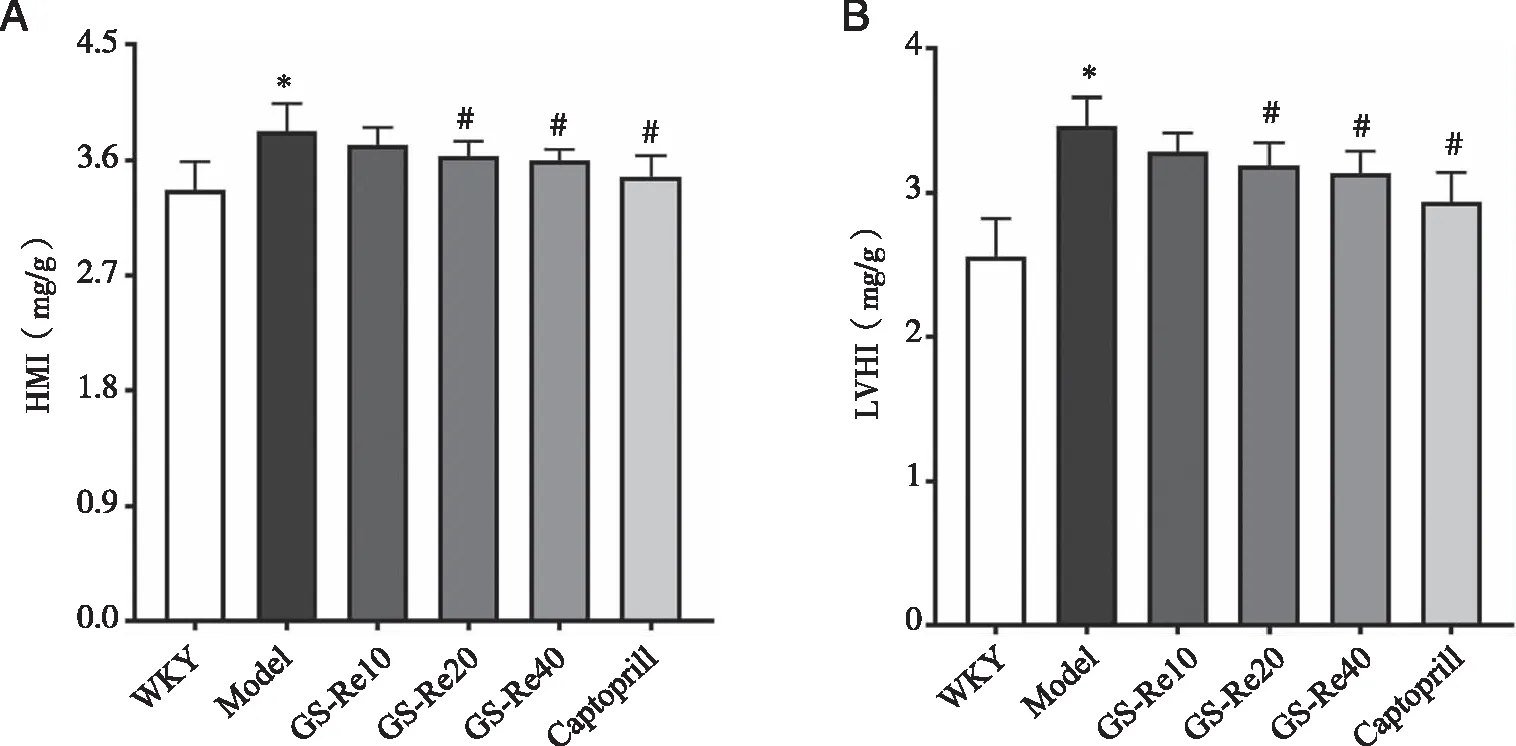
2.4.2 Masson染色 LVH常伴随着心肌纤维化,因此利用Masson染色观察各组大鼠心肌组织胶原纤维沉积情况。结果如图5,图中蓝色部分为胶原纤维,红色部分为肌纤维。显微镜下观察发现,26周龄时,对照组心肌组织血管和间质部位胶原纤维较少,而模型组心肌组织中有大量的胶原纤维沉积(P<0.05)。胶原纤维的过度沉积会引起心肌组织僵硬,从而影响左心室的收缩舒张功能。不同剂量GS-Re给药后,胶原纤维的沉积较模型组有不同程度的改善,其中GS-Re 20和GS-Re 40显著减少SHR心肌组织中的胶原纤维沉积(P<0.05)。
A:WKY;B:Model;C:GS-Re 10;D:GS-Re 20;E:GS-Re 40;F:Captopril;G:心肌细胞横截面积统计结果;标尺=20 μm;*:与WKY比较, P<0.05; #:与Model比较,P<0.05;n=7。图5 GS-Re对SHR左心室胶原沉积的影响
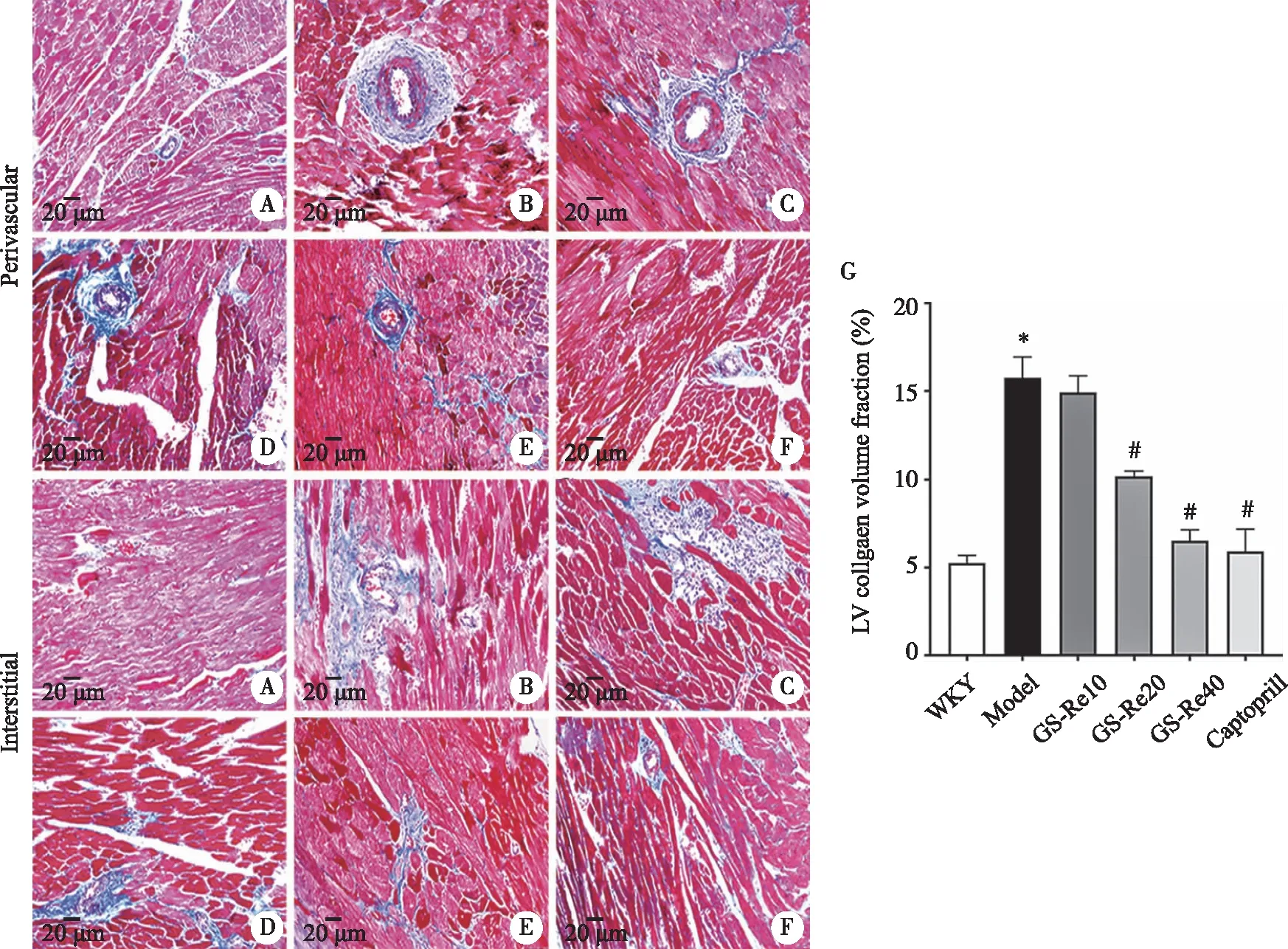
2.5 GS-Re对SHR左心室组织中TRPC蛋白表达的影响 26周龄时,与对照组相比,模型组左心室组织中TRPC1、TRPC3、TRPC6蛋白表达均显著上调(P<0.05)。GS-Re给药后,上述蛋白表达较模型组均有不同程度的下调,其中GS-Re 10组显著下调了TRPC1(图6A)和TRPC3(图6B)蛋白表达(P<0.05),而GS-Re 20和GS-Re 40则显著下调了TRPC1(图6A)、TRPC3(图6B)及TRPC6(图6C)蛋白的表达(P<0.05)。
A:TRPC1蛋白表达量;B:TRPC3蛋白表达量;C:TRPC6蛋白表达量;*:与WKY比较,P<0.05;#:与Model比较,P<0.05 ;n=5。图6 GS-Re对SHR左心室组织中TRPC蛋白表达的影响
2.6 GS-Re对SHR左心室组织中CaN和CaMKⅡδ蛋白表达的影响 26周龄时,与对照组相比,模型组左心室组织中CaN和CaMKⅡδ蛋白表达均显著上调(P<0.05)。GS-Re给药后,上述蛋白表达较模型组均有不同程度的下调,其中GS-Re 10组显著下调了CaN(图7A)蛋白表达(P<0.05),而GS-Re 20和GS-Re 40则显著下调了CaN(图7A)和CaMKⅡδ(图7B)蛋白的表达(P<0.05)。

A:CaN蛋白表达量;B:CaMKⅡδ蛋白表达量;*:与 WKY比较,P<0.05;#:与Model 比较,P<0.05; n=5。图7 GS-Re对SHR左心室组织中CaN和CaMKⅡδ蛋白表达的影响
3 讨论
LVH是高血压所致心脏疾病的主要表现之一,是一种心脏重塑的过程。这整个过程既有基因表达、蛋白质合成、肌节改变、细胞代谢等多种细胞层面的变化,又有心肌形态发生变化,包括体积增大、组织间质和血管周围胶原纤维沉积等组织层面上的变化,LVH最终导致心脏收缩功能下降[15-16]。LVH是一个重要的心脏疾病预测因子,LVH的减轻与心脏疾病预后的改善显著相关[17]。
为了确定GS-Re是否能够改善LVH,本研究选择SHR作为LVH的模型,SHR因其病理生理改变接近人类原发性高血压,已被广泛用于心血管疾病的研究。SHR在7周龄左右时出现自发性高血压,12~14周龄开始逐步形成左心室肥厚[18]。
卡托普利属于血管紧张素转换酶抑制剂类药物,可有效降低血压、改善LVH,因此本实验选择卡托普利作为阳性对照药。
灌胃给予GS-Re 12周后,观察到GS-Re能够显著降低SHR左心室质量、舒张末期左心室前壁及后壁厚度,改善了SHR左心室的结构。此外,给予GS-Re治疗后,左心室心肌纤维排列整齐,心肌细胞横截面积减小,血管周围和组织间质胶原纤维沉积减小,LVH得到了有效改善。故认为GS-Re降低了SHR的收缩压,有效减轻了左心室的后负荷,是其改善LVH的原因之一。最近Lee等[19]研究表明在患有高血压和LVH的成人中,血压的下降能够有效改善病情并减轻心血管疾病事件的风险。我们先前的研究表明GS-Re能增加NO的产生并升高环磷酸鸟苷(cGMP)水平[20],有利于血管舒张,此结果类似Yutaka等人的研究[21]也表明GS-Re能够促进NO的释放,从而促进血管舒张,这可能是GS-Re的降压作用的一种机制。此外还有研究表明TRPC3的过表达可能通过调节线粒体功能从而调节高血压患者的血管张力和血压[22],考虑到本研究表明GS-Re下调了SHR左心室TRPC3蛋白的表达量,因此我们推测GS-Re可能也下调了血管中TRPC3的表达,从而发挥下调收缩压的作用,但需要进一步实验验证。
细胞内Ca2+依赖性信号通路的改变是LVH的分子标志之一。TRPC是一种阳离子通道,能允许钙离子的通过。大量研究表明TRPC参与心肌肥厚的发生发展,如Wu等[23]较为全面的研究了TRPC3/C4/C6在心肌肥厚中的作用,发现其机制是通过调控[Ca2+]i及CaN/NFAT信号通路实现的。Camacho等[10]研究也表明TRPC1/C4的敲除可预防病理性肥厚的发展。此外抑制TRPC1[24]能够减轻佛波酯(phorbol 12-myristate 13-acetate,PMA)诱导的H9人类胚胎干细胞衍生心肌细胞的肥大;抑制TRPC3[25]也被证明可减轻高盐诱导的小鼠心肌肥厚,这些结果说明TRPC在调控心肌肥厚中发挥着重要作用。CaN和CaMKⅡ被认为是细胞内2种主要的钙信号转导关键分子[5],也是TRPC的重要下游蛋白[7-8]。CaN是一种钙依赖的蛋白磷酸酶,能够促进细胞质中的p-NFAT去磷酸化进入细胞核内,在核内激活多种肥厚相关基因,引发LVH[26-27]。而CaMKⅡδ是一种丝氨酸/苏氨酸蛋白激酶,其能将HDAC磷酸化后从核转位至胞质,解除对心肌肥厚相关基因的抑制而导致LVH[5]。此前曾有研究表明GS-Re能够降低[Ca2+]i从而发挥保护心脏的作用[14],但研究并未继续深入。本实验结果表明GS-Re降低了SHR左心室组织中TRPC1/C3/C6及其下游的CaN和CaMKⅡδ蛋白的表达,这表明GS-Re降低[Ca2+]i可能是通过抑制TRPC实现的,并且进一步下调了TRPC下游的钙信号通路相关蛋白。下调左心室组织中TRPC及其下游的钙信号通路可能是GS-Re改善LVH的另一种原因。
本实验的局限在于,没有使用特异性TRPC抑制剂或通过沉默/敲除TRPC基因更深入的探讨GS-Re对TRPC的调节机制,之后需要进一步的实验验证。
本研究结果表明GS-Re降低了SHR收缩压,改善了其左心室的结构,降低了左心室心肌细胞的横截面积和胶原纤维沉积,并下调了TRPC1/C3/C6及其下游的CaN和CaMKⅡδ蛋白表达,提示GS-Re改善SHR左心室肥厚的作用与其抑制TRPC介导的钙信号通路有关。
