犬去黏膜回肠输尿管新生黏膜上皮性质鉴定
2023-06-30杨登浩赵泽驹
杨登浩,唐 文,沈 雷,赵泽驹
(1.遵义医科大学附属医院 泌尿外科,贵州 遵义 563099;2.遵义医科大学 外科手术学实验室,贵州 遵义 563099)
输尿管超过15 cm的缺损为输尿管严重损伤,临床上主要采用回肠代输尿管治疗[1]。其术后黏膜相关并发症多以至改进不断,裁剪去黏膜回肠代输尿管前期研究显示效果较好[2]。模型犬术后第3个月开始发现代输尿管新生黏膜,形态类似小肠黏膜[3],部分样本新生黏膜与小肠黏膜形态结构差异较大,存在鉴定必要性;MUC2、UPK2分别为肠黏膜杯状细胞、尿路上皮细胞标记物;CK7、CK20在肠和尿路上皮中呈现不同表达,联合检测有助于上皮性质鉴定,本实验将通过检测上述指标加以鉴别,现报告如下。
1 材料与方法
1.1 材料 实验用比格犬9只(由重庆沃森生物技术有限公司提供);切片机、冷冻台、漂烘仪、干燥箱、修复仪、脱色摇床、漩涡混匀仪、掌上离心机、移液枪、数字切片扫描仪、刀片、载玻片、盖玻片;苏木素染色剂、伊红染色剂、蒸馏水、二甲苯、多聚甲醛、无水乙醇、二甲苯、柠檬酸盐缓冲液、PBS缓冲液、DAPI染色试剂、正常山羊血清、一抗(CK 7;ABclonal,A12004)、一抗(CK20,ABclonal,A0248)、一抗(MUC2;ABclonal,A14659)、一抗(UPK2;ABclonal,A10813)、二抗(FITC标记山羊抗兔,Servicebio,GB22303)。
1.2 方法
1.2.1 模型建立与取材 比格犬术前禁饮禁食12 h,3%戊巴比妥肌肉注射麻醉,麻醉生效后仰卧位固定,术区备皮,消毒铺巾。经腹正中,从剑突至耻骨联合上方约4 cm进入腹腔,打开后腹膜,分离左侧肾蒂,止血钳钳夹肾蒂,切除左肾,4号丝线缝扎肾蒂近端;分离右侧输尿管,将输尿管与肾盂、膀胱连接处分别剪断,切除输尿管,膀胱输尿管残端结扎,形成输尿管全段缺损。据回盲部15 cm处取带蒂回肠约15 cm,回肠断端端端吻合,检查无漏后,连续缝合肠系膜裂口;带蒂回肠段用0.5%碘伏冲洗,18 F尿管结扎阻断带蒂回肠段系膜血管,电刀沿肠系膜血管对侧纵向切开肠管,再次0.5%碘伏冲洗肠腔,留取部分回肠作为阳性对照组,裁剥法去除其黏膜层及黏膜下层,留取部分组织作为阴性对照组,将F5双“J”管放置于肠腔面,3-0可吸收线连续缝合为管状,其近端与肾盂吻合,远端与膀胱吻合,松开系膜血管;观察见尿液至造瘘流出,检查腹腔未见尿瘘、肠瘘及活动性出血后,逐层关闭腹腔,术后7 d连续肌肉注射头孢唑林抗感染,术后1月拔出双J管,术后3、6、12月分别选取3只比格犬处死,留取去黏膜回肠输尿管样本作为实验组,按取材月份将实验组样本分为术后3、 6、 12月组,10%甲醛溶液固定保存(图1)。

A:术中开始剥脱黏膜;B:术中回肠输尿管成形。图1 比格犬建模效果
1.2.2 HE染色 将组织样本放入装有液态石蜡的模具中固定,用切片机制备5 μm切片并于40 ℃水浴锅中舒展捞片,切片置于80 ℃烤箱烘干,然后将切片至于二甲苯中脱蜡,脱蜡后将切片放入乙醇溶液中水化,随后用PBS溶液洗片,最后通过苏木素及伊红染色,封片后采集图像及分析。
1.2.3 免疫荧光 参照免疫荧光实验方法,检测各时段样本MUC2、UPK2、CK7和CK20表达,石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ 15 min,二甲苯Ⅱ 15 min,二甲苯Ⅲ 15 min,无水乙醇Ⅰ5 min;无水乙醇Ⅱ5 min,85%酒精5 min,75%酒精5 min,蒸馏水洗;抗原修复:将切片浸入柠檬酸盐缓冲液(pH 6.0),微波炉高火加热10 min,停火8 min,中高火再加热10 min;冷却后,PBS洗3次,每次5 min;血清封闭:滴加山羊血清封闭液,室温20 min;滴加一抗(一抗浓度为:CK7 1∶100;CK20 1∶100;MUC2 1∶100;UPK2 1∶50),4 ℃过夜;PBS洗3次,每次5 min;滴加与一抗同源二抗(稀释比1∶100),37 ℃ 30 min;PBS洗3次,每次5 min;滴加DAPI,室温孵育10 min;PBS洗3次,每次5 min;使用显微摄像系统对切片进行图像采集,每张切片先于100倍下观察全部组织,再分别采集200倍显微图像,共采集3个视野。采用Image-J图像分析系统测定所采集全部图像的荧光强度和面积,并计算每张图像的平均荧光强度,使用3张图像的平均荧光强度再计算平均数,得出每例样本的平均荧光强度。DAPI染细胞核为蓝色,CK7、CK20、MUC2、UPK2显示出的阳性表达均为绿色。
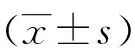
2 结果
2.1 大体观察 术后2 d 1只犬死亡,购买比格犬造模补充,2只犬腹部切口红肿、溢脓,给与清创缝合后愈合;术后3、6、12月解剖观察见腹腔轻度粘连、无积液、积脓;新输尿管光滑、完整,无瘢痕、漏口;肾脏无增大,肾盂无扩张;新输尿管腔面光滑、通畅,无瘢痕及溃疡。
2.2 HE染色 阳性对照组回肠结构完整、层次清晰,由内向外分为黏膜层、黏膜下层、肌层与浆膜层(图2A)。阴性对照组黏膜剥脱干净,黏膜下层、肌层和浆膜层结构完整(图2B);实验组术后3、6、12个月均见新生黏膜,其形态各异,但其有许多共同点与阳性对照组(正常回肠黏膜)相似,即黏膜层均向肠腔突出,形成小肠的特征性结构小肠绒毛状结构(图2C~E)。

A:阳性对照组;B:阴性对照组;C:术后3月组;D:术后6月组;E:术后12月组。图2 对照组回肠与实验组去黏膜回肠HE染色结果对比
2.3 免疫荧光 阳性对照组与术后3、6、12月组CK7阴性表达(图3 A~D),CK20阳性表达(图3 E~H),UPK2阴性表达(图3 I~L),MUC2阳性表达(图3 M~P)。与阳性对照组相比,术后3月组CK20表达明显降低,具有统计学意义(P<0.05);阳性对照组与术后6、12月组相比,CK20表达量未见明显差异,无统计学意义(P>0.05,表1);与阳性对照组相比,术后3月组MUC2表达明显降低,具有统计学意义(P<0.05),阳性对照组与术后6、12月组相比,MUC2表达量未见明显差异,无统计学意义(P>0.05,表2)。

表1 CK20平均荧光强度统计结果

表2 MUC2平均荧光强度统计结果

A~D:阳性对照组与术后3、6、12月组相比,CK7的表达情况(免疫荧光,×200); E~H:阳性对照组与术后3、6、12月组相比,CK20的表达情况(免疫荧光,×200);I~L:阳性对照组与术后3、6、12月组相比,UPK2的表达情况(免疫荧光,×200);M~P:阳性对照组与术后3、6、12月组相比,MUC2的表达情况(免疫荧光,×200)。图3 各组裁剪去黏膜回肠输尿管CK7、CK20、UPK2和MUC2的表达情况
3 讨论
临床上长段输尿管损伤(>15 cm)时有发生,治疗较为棘手,目前多采用回肠代输尿管[4]。但术后梗阻、电解质紊乱等黏膜相关并发症长期困扰着患者和医生。裁剪去黏膜回肠代输尿管实验显示黏膜相关并发症显著减少[5],延长模型犬饲养时间,术后3个月起HE染色观察到代输尿管新生黏膜长出,随时间延长逐渐类似小肠黏膜[3],部分样本新生黏膜与小肠黏膜层形态结构差异较大。为明确再生黏膜的性质和推测其可能的来源,检测黏膜上皮部分标记物,以期望通过标记物的组合表达论证其属性,将有助于探究新生黏膜出现的可能来源及机制,为裁剪去黏膜回肠代输尿管提供理论支持。
上皮组织细胞标记物较多,本实验用回肠裁剪去黏膜代输尿管,再生黏膜来源于肠黏膜隐窝处干细胞和尿源性干细胞分化的可能性较大,上皮组织细胞标记物在肠黏膜上皮和尿路上皮细胞中特异性表达的相对较少,并以CK7、CK20、MUC2和UPK2为常见。
CK7、CK20是细胞角蛋白家族中的成员,为构成细胞骨架的重要物质。CK7 存在于大多数上皮组织和尿路上皮细胞中,在胃肠黏膜上皮细胞中不表达[6],CK20存在于正常的胃肠道黏膜上皮、尿路上皮等细胞中[7],CK7、CK20的联合表达被广泛应用与上皮细胞、上皮组织来源肿瘤、转移瘤组织类型的鉴别[8-9],CK7-/CK20+提示该组织为胃肠上皮组织的可能性大,CK7+/CK20+则提示该组织或肿瘤可能为尿路上皮,但其特异性不足,通常需联合其它特异性标记物联合评估[7,10-11]。为更准确鉴别新生黏膜为肠黏膜上皮还是尿路上皮细胞,故增加其各自的特异性免疫标志物尿路上皮细胞分化特异性糖蛋白2(uroplakin2,UPK2)和粘蛋白2(mucin2,MUC2),将有助于提高检测的特异性[12-13],本次实验通过上述指标的检测辨别新生黏膜的组织类型。
研究结果显示,HE染色观察见新生黏膜存在小肠绒毛状结构,其类似于小肠黏膜,免疫荧光显示新生黏膜上皮CK7-/CK20+提示该组织为肠黏膜上皮可能性大,同时结合MUC2阳性表达,UPK2阴性表达,说明新生黏膜上皮为肠黏膜上皮。与对照组相比,术后3月组CK20表达明显降低(P<0.05),对照组与术后6、12月组CK20表达量未见明显差异(P>0.05);与对照组相比,术后3月组MUC2表达明显降低(P<0.05),对照组与术后6、12月组MUC2表达量未见明显差异(P>0.05);表明裁剪去黏膜后1~6月新生黏膜开始逐渐长出并不断成熟,6月后新生黏膜发育成熟。
上述结果说明回肠黏膜剥脱后发生了再黏膜化,新生黏膜为肠黏膜上皮,其机制可能为回肠黏膜层剥脱时,凹进黏膜下层及基底层的隐窝的肠干细胞(intestinal stem cells,ISC)未被剥脱消除,且肠壁黏膜下层、肌层、浆膜层结构基础尚存,故可能由残存的隐窝肠干细胞分化而来[14-16]。是否存在其它上皮再生的可能性目前尚不清楚,理论上去黏膜的代输尿管腔面黏膜下层具备细胞载体功能,存在尿源性干细胞定植和循环干细胞归巢可能性,还需在今后的实验中做进一步探究。
