农村老年脑卒中患者衰弱轨迹及影响因素的纵向研究
2023-06-29钱军红刘志薇钱宏斌张振香
钱军红 刘志薇 李 妍 钱宏斌 李 梅 张振香
1)潢川县人民医院,河南 潢川 465150 2)郑州大学护理与健康学院,河南 郑州 450001
脑卒中具有高发病率、高致残率、高致死率和高复发率的特点,给家庭和社会造成严重的经济负担[1]。研究显示,脑卒中患者年龄越大,发病率越高[2]。农村老人是脑卒中的重要患病人群,其致残率、病死率高于城市地区的老人[3]。农村老年脑卒中患者普遍存在衰弱[4],衰弱的发生会加重患者的认知功能障碍和吞咽功能障碍,从而导致患者的生活质量下降,增加患者再入院率和病死率的风险[5]。衰弱的发展和转归是一个不断变动的过程[6],且衰弱轨迹中存在不同的发展轨迹类型[7]。目前国内关于脑卒中患者衰弱的研究多为横断面调查[8],纵向研究则能够明确衰弱在脑卒中不同阶段的动态变化情况。因此,本研究采用群组轨迹模型分析农村老年人脑卒中患者衰弱随时间的发展变化情况,并进一步探讨不同衰弱轨迹类型的影响因素。
1 对象与方法
1.1 研究对象采用便利抽样法选取2021-11—2022-02 河南信阳某二级综合医院神经内科住院的250 名农村老年脑卒中患者进行调查。纳入标准:(1)年龄≥60岁,符合《中国急性缺血性脑卒中诊治指南(2018)》[9]和中华医学会制定的《各类脑血管疾病诊断要点》[10]的诊断标准,并经颅脑MRI 或者CT 确诊的脑卒中患者;(2)符合农村患者条件,农村患者是指在农村居住生活(在家居住半年或半年以上),以农业生产为生活来源的病人[11];(3)脑卒中生命体征平稳,神志清楚,能进行沟通,回答简单的问题;(4)愿意参与本次研究调查。排除盲聋以及有精神疾病的患者。
1.2 评价工具
1.2.1 一般资料调查表:此量表由研究者自行设计,包括性别、年龄、文化程度、经济条件、婚姻状况、居住情况、卒中类型、卒中次数、多重用药、多病共存以及是否康复锻炼等。
1.2.2 中文版Tilburg 衰弱量表(Tilburg frailty indicator,TFI):该量表由荷兰GOBBENS 等[12]在“整合概念”模型的基础上研发,由奚兴等[13]汉化。该量表包含躯体、心理、社会衰弱3个维度,15个条目:健康情况、走路困难、体质量下降情况、平衡状况、听力、视力、握力和疲劳感记忆力、焦虑、抑郁、应对能力、独居情况、社会关系、社会支持情况,每项条目1分,总分15 分,5 分及以上为衰弱,本研究中该量表的Cronbach’s α系数为0.743。
1.2.3 Barthel 指数量表(Barthel index,BI):Barthel指数量表是由美国BARTHEL 等[14]学者于1965 年研制,共10项内容:洗澡、修饰、进食、穿衣、大便、小便、如厕、上下楼梯、床椅移动、活动。总分100 分,得分越高提示自理能力越强。本研究中该量表的Cronbach’s α系数为0.796。
1.2.4 社会支持评定量表(social support rating scale,SSRS):SSRS[15]由肖水源设计,共10个条目,内容包括客观支持、主观支持、对社会支持的利用度等。总分越高表示患者的社会支持水平越高。总分≤22分表示患者的社会支持水平低,23~44分表示患者的社会支持水平中等,≥45分表示患者的社会支持水平高。本研究中该量表的Cronbach’s α 系数为0.761。
1.2.5 匹兹堡睡眠质量指数量表(Pittsburgh sleep quality index,PSQI):该量表由美国匹兹堡大学医学博士BUYSSE 等[16]于1989 年编制,共18 个条目,由睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物、日间功能障碍7 个维度组成。每个条目按0~3等级计分,总分21分,得分越高表示睡眠质量越差。本研究中该量表的Cronbach’s α 系数为0.791。
1.2.6 微型简易营养评估量表(the mini nutritional assessment,MNA):MNA 由瑞士的GUIGOZ 等[17]于1996年提出,由18个条目,4个维度组成:身体评估、综合评估、饮食评价以及自我评价。总分30分,≥24分表示营养良好,17~23.5 分表示有营养不良的风险,<17 分表示营养不良。本研究中该量表的Cronbach’s α系数为0.806。
1.2.7 简版老年抑郁量表(geriatric depression scale,GDS-15):由SHEIKH等[18]在GDS基础上设计15个条目的简版单维度老年抑郁量表(GDS-15)。该量表要求被试者用“是”或“否”作答,“是”计1 分,“否”计0分。总分0~15 分,≥6 分表示患者有抑郁症状,分数越高表示患者的抑郁症状越明显。本研究中该量表的Cronbach’s α系数为0.786。
1.3 研究方法采用面对面方式,在研究对象住院期间病情稳定后开展问卷调查。在患者出院后的1个月和6 个月进行电话随访调查。全程严格执行质量控制。患者住院期间共发放250份问卷,回收有效问卷242 份,有效回收率96.8%。最终219 例患者完成全部随访,23 例患者流失,总流失率为9.50%。219例完成随访的患者与23例失访患者人口学及疾病相关信息均无可比性(P>0.05)。
1.4 统计学方法采用Microsoft Excel 对数据进行录入,SPSS 25.0 及STATA 15.1 软件进行统计分析。计量资料采用均数±标准差(±s)描述;计数资料采用频数、百分比(%)描述。采用多因素Logistic 回归分析探讨影响发展轨迹的影响因素。采用群组轨迹分析模型(group based trajectory model,GBTM)探讨农村老年脑卒中患者衰弱的不同轨迹分型。模型拟合效果评价主要包含以下指标:平均验后分组概率(average posterior probabilities,AvePP)和贝叶斯信息标准(Bayesian information criterion,BIC)。其中,BIC绝对值越小,表示模型拟合越好。AvePP>0.7 表示各亚组内研究对象符合该轨迹的程度良好。此外,根据曲线相似程度、模型的简洁性、可解释性和最少组比例来确定最佳组数[19]。
2 结果
2.1 农村老年脑卒中患者衰弱发展轨迹分析首先,固定多项式阶次为3,探索性建立1~5个群组轨迹模型,根据表5可知,从模型1到模型5,BIC绝对值逐渐减低,所以本研究根据模型的曲线相似程度、模型的简洁性、可解释性和最小组比例(每组患者>50例)确定3组为最佳模型,见表1。
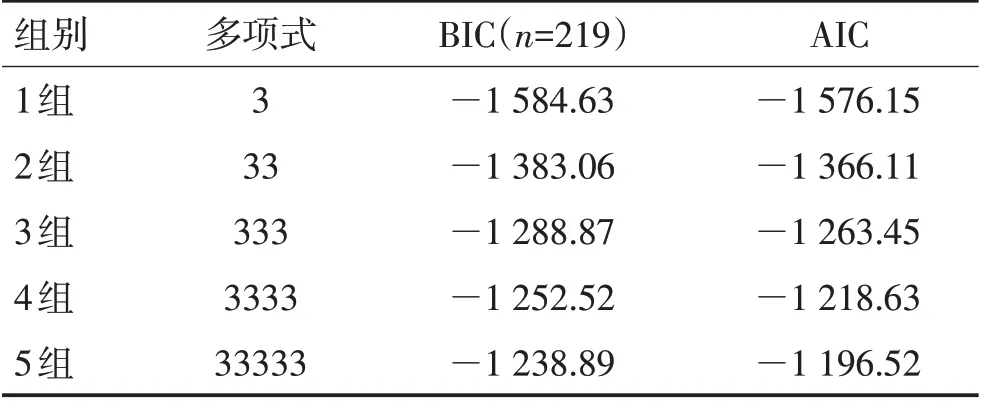
表1 农村老年脑卒中患者衰弱的群组轨迹模型分组依据Table 1 Group trajectory model grouping basis of frail elderly stroke patients in rural areas
确定最佳分组数为3组后,将多项式阶次逐渐降低阶数,直至所有组阶次的P值均<0.05,经过7 次多项式阶次的迭代得到最佳曲线形状。最终确定的多项式阶次为(0 1 2),见表2。此时,组1、组2和组3的AvePP 分别为0.99、0.94、0.96,均>0.70,表明模型的拟合效果良好。见图1、表3。
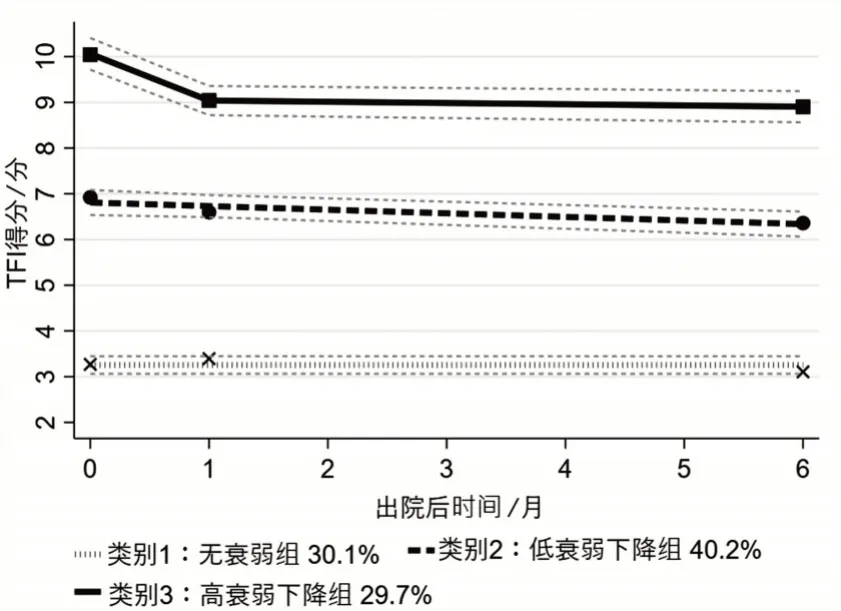
图1 农村老年脑卒中患者衰弱3组发展轨迹变化图Figure 1 Changes in the development trajectories of three groups of frailty in rural elderly stroke patients

表2 3组多项式阶次迭代情况Table 2 Three groups of polynomial order iterations
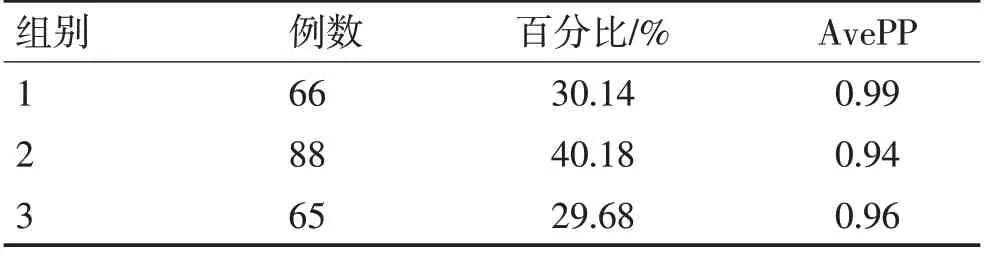
表3 农村老年脑卒中患者衰弱3组的平均验后概率及所占百分比Table 3 Average post-test probability and percentage of frailty 3 groups of rural elderly stroke patients
2.2 农村老年脑卒中患者衰弱发展轨迹群组类别特征根据3组发展轨迹的不同变化特点,分别对其进行命名。第一条曲线(类别1)显示,患者在3个时间点上,TFI得分呈现较低水平的稳定状态,平均分为3分左右,低于5分,表明患者在出院后6个月内均无衰弱,且持续处于较低水平,因此将其命名为“无衰弱平稳组”。第二条曲线(类别2)显示,患者在3 个时间点上,TFI得分平均分在7分左右,在后期随访期间有较少水平的下降,因此将这类患者命名为低衰弱下降组。第三条曲线(类别3)显示,患者在3个时间点上,TFI 得分先下降后总体呈平稳状态,在T1 时,得分高于其余2组。在后期随访期间,得分仍处于较高状态,由此可知,这类患者处于较高水平的衰弱状态,因此将这类患者命名为“高衰弱下降组”。见图1。
2.3 单因素分析患者的婚姻、经济水平、居住方式、卒中次数、多重用药、多病共存、康复锻炼、自理能力、营养状况和睡眠质量在3组间差异均有统计学意义(P<0.05)。见表4。
表4 不同衰弱发展轨迹组别的患者单因素分析 (±s)Table 4 Univariate analysis of patients with different debilitating trajectory groups (±s)
因素性别[n(%)]无衰弱平稳组(n=66)低衰弱下降组(n=88)高衰弱下降组(n=65)χ2/F值1.94 P值0.379男女年龄/岁文化程度[n(%)]初中及以上小学及以下婚姻状况[n(%)]已婚未婚/丧偶经济水平[n(%)]好一般差居住方式[n(%)]非独居独居饮酒[n(%)]32(31.1)34(29.3)71.05±5.85 21(41.2)45(26.8)51(35.9)15(19.5)22(45.8)36(29.8)8(16.0)46(36.8)20(21.3)45(43.7)43(37.1)71.28±7.02 18(35.3)70(41.7)50(35.2)38(49.4)14(29.2)51(42.1)23(46.0)47(37.6)31(33.0)26(25.2)39(33.6)73.43±7.07 12(23.5)53(31.5)41(28.9)24(31.2)12(25.0)34(28.1)19(38.0)32(25.6)43(45.7)2.59 3.93 7.05 10.86 6.41 4.02 0.077 0.140 0.029 0.028 0.041 0.134是否33(30.3)33(30.0)44(40.4)44(40.0)32(29.3)33(30.0)吸烟[n(%)]0.01 0.995是否卒中次数[n(%)]首发复发卒中类型[n(%)]缺血性出血性/混合性多病共存[n(%)]有无多重用药[n(%)]30(25.0)36(36.4)54(39.4)12(14.6)55(29.6)11(33.3)25(21.4)41(40.2)50(41.7)38(38.4)51(37.2)37(45.1)76(40.9)12(36.4)50(42.7)38(37.3)40(33.3)25(25.2)32(23.4)33(40.2)55(29.6)10(30.3)42(35.9)23(22.5)16.18 0.28 10.09 10.36<0.001 0.870 0.006 0.006有无4(15.4)62(32.1)18(69.2)70(36.3)4(15.4)61(31.6)康复锻炼[n(%)]10.77 0.005是否20(47.6)46(26.1)17(40.5)70(39.8)5(11.9)60(34.1)抑郁[n(%)]0.40 0.819是否社会支持BI评分营养情况18(27.7)48(31.2)31.08±11.84 93.71±13.71 22.27±4.61 26(40.0)62(40.3)27.92±11.69 85.97±16.49 21.40±4.08 21(32.3)44(28.6)28.23±11.16 73.38±19.67 20.51±3.36 1.59 24.62 3.07 0.207<0.001 0.048
2.4 多因素Logistic 回归分析将单因素分析中具有统计学差异的指标作为自变量,以无衰弱平稳组作为参照类,进行多分类Logistic 回归分析,结果显示,相较于无衰弱平稳组,低衰弱下降组的影响因素主要有睡眠质量(OR=1.17,95%CI:1.08~1.28,P<0.05)、首次发病(OR=0.29,95%CI:0.11~0.72,P<0.05)。相较于无衰弱平稳组,高衰弱下降组的影响因素主要有自理能力(OR=0.94,95%CI:0.91~0.97,P<0.05)、睡眠质量(OR=1.16,95%CI:1.06~1.27,P<0.05)、独居(OR=3.09,95%CI:1.09~8.75,P<0.05)、首次发病(OR=0.26,95%CI:0.09~0.71,P<0.05)、多病共存(OR=3.27,95%CI:1.29~8.29,P<0.05)、康复锻炼(OR=0.20,95%CI:0.05~0.78,P<0.05)。见表5。

表5 农村老年脑卒中患者衰弱发展轨迹影响因素的多因素Logistic回归分析Table 5 Multivariate Logistic regression analysis of factors influencing the development trajectory of debilitating development in rural elderly stroke patients
3 讨论
3.1 农村老年脑卒中患者衰弱发展轨迹分析农村老年脑卒中患者衰弱轨迹存在异质性,本研究拟合出3组农村老年脑卒中衰弱的发展轨迹,分别为无衰弱平稳组、低衰弱下降组、高衰弱下降组,其中29.68%的患者属于高衰弱下降组,患者在随访期间从T1时间段开始到随访结束,该人群的衰弱程度重,预后不良,需要临床医护人员特别关注。目前,脑卒中患者群体中类似的研究报道较少。郭雁飞等[7]在对中国50 岁及以上人群衰弱轨迹的研究中识别出“低水平稳定”“中度增加”及“高度增加”3 条衰弱轨迹。王水玲等[20]基于群组轨迹将社区老年重度高血压患者衰弱拟合了“低-稳定型”“低-快速增长型”“中快速增长型”“高缓慢增长型”4 种不同衰弱发展轨迹。以上研究结果显示衰弱呈上升的发展趋势,本研究则显示衰弱程度呈下降趋势,结论之间的差异推测可能原因如下:首先,衰弱的人群类型不同,本次研究对象是老年脑卒中患者;其次,本研究是从衰弱的严重程度来拟合衰弱的轨迹,而非衰弱的发生率;最后,可能跟研究随访的时间有关,本研究只随访了脑卒中后半年的时间。鉴于此,以后可延长随访时间,也可调查农村老年人脑卒中前衰弱的发生率,以便更加全面了解农村老年脑卒中患者衰弱状态与时间的关系。
3.2 农村老年脑卒中患者衰弱发展轨迹影响因素
3.2.1 首次发病:本研究显示,相较于无衰弱平稳组,首发脑卒中是低衰弱下降组患者和高衰弱下降组患者的保护因素。张鑫宇等[21]研究指出,首发脑卒中在老年脑卒中患者衰弱预测模型中差异有统计学意义,与本研究结果一致。赵瑞雪等[22]研究发现脑卒中促进衰弱的发生。脑卒中后通常伴有不同程度的后遗症,再次入院病情较上一次严重[23]。因此,临床医护人员应向患者宣教脑卒中的相关知识,提高患者自我管理效能,从而预防脑卒中复发,以减少衰弱的发生。
3.2.2 多病共存:本研究发现,相较于无衰弱平稳组,多病共存是高衰弱下降组患者的危险因素。这一结果与吴晨曦等[24]研究结果相似,证明慢性病数量多是养老机构躯体症状群轨迹“高下降”和“高上升”轨迹的独立预测因素。农村老年人普遍有高血压、高血脂、糖尿病、脑卒中等慢性疾病,且多种慢性病共存患者较常见[25]。本研究显示农村老年脑卒中患者多重用药情况并不明显。可能原因:(1)农村老年患者自行购药情况严重,用药不规范[26];(2)农村老年人用药依从性差,通常会有漏服与忘记服药的现象[27]。综上,医护人员应及时评估农村老年脑卒中患者是否存在多病共存,同时需规范农村老人就诊看病程序,合理用药,降低衰弱的发生。
3.2.3 居住方式:相较于无衰弱平稳组,独居是高衰弱下降组患者的独立危险因素。LEE 等[28]研究得出独居是老人发生衰弱的危险因素;张鑫宇等[21]研究发现独居是老年脑卒中患者发生衰弱的独立风险因素,与本研究结果类似。农村孤寡老人居多,独居是普遍存在现象。独居的农村老年脑卒中患者缺少照顾和沟通,物质上的支持与帮助不足,导致衰弱的发生率较高[29],提示临床医务人员应重点关注独居农村脑卒中患者,及时发现患者存在的问题。
3.2.4 自理能力:本研究显示自理能力是农村老年脑卒中患者高衰弱下降组的保护因素。王水玲等[23]研究指出,自理能力是衰弱轨迹的影响因素,与本研究结果一致。自理能力越差进入高衰弱下降组的概率越大。农村老年脑卒中患者随年龄增长会出现生理性功能下降,日常生活活动能力下降,增加了衰弱的发生[30]。脑卒中后康复运动锻炼有助于提高脑卒中后遗症期患者日常生活活动能力,降低衰弱的发生[31]。因此,对于住院期间自理能力较低的患者,临床医护人员应制定合理的运动训练计划,改善其营养状态,提高其自理能力,延缓衰弱的发生、发展。
3.2.5 睡眠质量:本研究显示,相较于无衰弱平稳组,睡眠质量是低衰弱下降组和高衰弱下降组的危险因素。郭凯林等[32]在中国老年人衰弱的发展轨迹的研究中发现,睡眠质量好有助于衰弱水平的降低,与本研究结果相似。LORBER 等[33]研究也发现睡眠质量越差,患者越容易衰弱。患者的睡眠障碍与衰弱呈正相关,即匹兹堡睡眠质量指数量表得分越高,衰弱越严重[34]。农村老年脑卒中患者出现的各种睡眠功能障碍会影响其神经功能康复,容易导致神经衰弱、焦虑、抑郁,促进衰弱的发生[35-36]。临床医护人员需及时评估患者的睡眠质量,保证病房环境安静,提高患者睡眠质量,出院后嘱咐患者合理安排睡眠时间。
3.2.6 康复锻炼:本研究发现康复锻炼是农村老年脑卒中患者高衰弱下降组的保护因素。高衰弱下降组的农村老年脑卒中患者入院时病情严重,卒中后致残率高,且伴不同程度的功能障碍,导致衰弱发生率高。脑卒中24 h内的患者及时进行康复运动锻炼,有利于促进患者神经系统、器官功能的恢复[37]。农村老年脑卒中衰弱患者康复锻炼依从性差[38]。护士应在康复中发挥积极作用,特别是高衰弱下降组的农村老年脑卒中患者,应提高其康复锻炼的依从性,同时,通过微信小程序等信息平台指导农村老年脑卒中患者进行康复锻炼。
本研究分别于患者急性住院稳定期、出院后1个月、出院后6 个月对农村老年脑卒中患者衰弱情况进行纵向追踪,通过群组轨迹模型拟合农村老年脑卒中患者衰弱发展轨迹,最终确定为3 组衰弱发展轨迹,分别为无衰弱平稳组、低衰弱下降组、高衰弱下降组。未来临床应重点关注独居、首次发病、多病共存、睡眠质量差、自理能力差以及康复锻炼差的农村老年脑卒中患者。未来研究可进一步扩大样本量,开展多中心、大样本调查,增加样本的代表性。
