不同部位载药可溶性微针载药量比较及体外评价
2023-06-29钟家浩姚文栋谢先泽徐恒武
钟家浩 姚文栋 谢先泽 徐恒武
可溶性微针(dissolving microneedle,DMN)是一种由可溶性生物相容性材料制成微米级针体,在穿透皮肤角质层(stratum corneum,SC)后溶解释放装封于针体内药物的一种新型给药剂型[1-3]。DMN 刺穿角质层产生微孔道,但其深度不会损伤真皮中的神经末梢和血管[3]。因此,DMN 透皮给药不会导致出血和疼痛,是一种无痛给药方式。尽管在药物递送方面极具开发潜力,但DMN 由于依赖针体透皮给药,其载药局限于针体而使载药量低,限制了其进一步开发及临床应用潜力[4]。课题组前期研究中发现,医用胶布辅助微针给药后背衬层也会溶解吸收[5-6]。因此,本研究以聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、硫酸软骨素(chondroitin sulfate,CS)为材料,制备不同部位载不透皮的多肽类药物——神经毒素(neurotoxin,NT)的DMN,并对其形态特征,机械强度,载药量及体外透皮释放进行评价。
1 材料与方法
1.1 仪 器 微针模具,台州薇凯生物科技有限公司;HF-50 数显推拉力计HLX-S 推拉力计测试机架,美国PACK 公司;TL6R 立式低速冷冻离心机,湖南赫西仪器装备有限公司;DZF-6050 真空干燥箱,上海精宏实验设备有限公司;Waters Alliance e2695型高效液相色谱仪,美国Waters 公司;Nikon Eclipse Ci-L 显微镜,日本尼康株式会社。
1.2 材 料 NT,质量分数>97%,云南龙凤谷生物药业有限公司,批号H45 021228;PVP,美国Sigma-Aldrich 公司,批号BCBP9635V;CS,上海麦克林生化科技有限公司,批号C11 082605;实验用水为去离子水,其他试剂均为分析纯。
1.3 不同部位载药DMN 的制备 本研究依据前期研究使用两步离心法[5-6]制备DMN(见图1):(1)DMN针体的制备:以质量比为1∶1 分别称取CS 与PVP 于烧杯中,加入5 mg/mL 的NT 水溶液或纯水0.8 mL,充分溶解并搅拌均匀。将含药的基质液注入微针模具中,在4 ℃条件下,4 000 r/min 离心10 min,除去并收集微针模具表面的含药基质液,放入干燥箱中干燥1 h 后取出备用;(2)DMN 背衬层的制备:以质量比为1∶1 分别称取CS 与PVP 于烧杯中,加入5 mg/mL的NT 水溶液或纯水5.0 mL,搅拌均匀后注入微针模具,相同条件下离心10 min,取出具有含药基质液的微针模具干燥成形,用弯镊小心脱模,即得DMN。
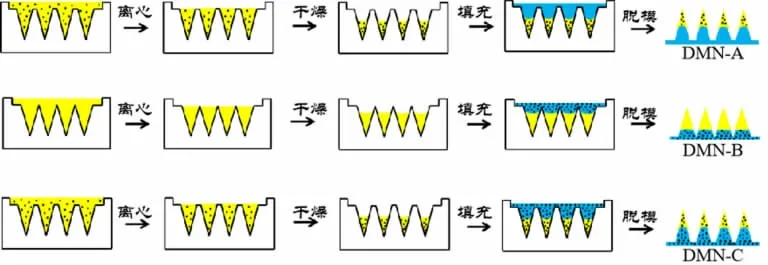
图1 两步离心法制备不同部位载药可溶性微针示意图
1.3.1 针体载药可溶性微针的制备(DMN-A)在“1.3”项下,(1)中使用5 mg/mL 的NT 水溶液溶解CS与PVP;(2)中加入纯水,其余步骤不变,得到针体载药可溶性微针(DMN-A)的制备。
1.6 体外透皮释放 使用Franz 扩散池法做体外透皮释放评价。在Franz 扩散池的接收室内加入pH=7.4 的PBS 作为接收液,超声排出多余空气。取离体大鼠皮肤,角质层朝上。将DMN-A、DMN-B、DMN-C置于离体大鼠皮肤上,按压后用医用胶布固定,过程中保证皮肤完整性。固定供给池和接收室,随后以600 r/min 的转速模拟人体皮下血液和组织液内循环,保持32 ℃恒温。分别于0、10、20、30 min 及1、2、3、4、6、8 h 后收集0.5 mL 接收液作为样品进行含量测定,取样后及时补充等量新鲜接收液。将取出的接收液样品处理并HPLC 测定浓度,计算并绘制药物累积渗透释药曲线。
首先保障道路的通行功能,以现状整修为主,清除路面周边存在的障碍物(杂草、植被、块石等)。另一方面,考虑与周边交通形成体系,可修建辅助道路,方便游客到达。同时,考察附近森林古道,是否存在可以形成森林古道体系的可能,形成主题古道,这样可以保证该类型森林古道能够吸引游客,重新焕发生机。
1.7 统计学方法 应用IBM SPSS Statistics 26 软件进行数据分析。所有数据经Shapiro-Wilk 检验(适用于n<50),均符合正态分布,以均数±标准差()表示,组间比较采用方差分析,P<0.05 表示差异有统计学意义。n 表示实验重复次数。
小六子的母亲有病啊。小六子自打那次给了我一镐柄以后有些生他妈的气,而因此不怎么回家,可是他是疼爱自己的母亲的。他为了能够挣到更多的钱,去为妈治病,矿山上所有的加班他都不会放过。
停工吹扫期间,轻油线的吹扫基本在4月11日至4月12日完成,为了在安全的前提下完成吹扫任务,采取以下较好的措施:
1.3.2 背衬层载药可溶性微针(DMN-B)的制备 在“1.3”项下,(1)中使用纯水溶解CS 与PVP;(2)中加入5 mg/mL 的NT 水溶液,其余步骤不变,得到DMN-B 的制备。
1.3.3 针体与背衬层均载药可溶性微针(DMN-C)的制备 在“1.3”项下,(1)中使用5 mg/mL 的NT 水溶液溶解CS 与PVP;(2)中加入5 mg/mL 的NT 水溶液,其余步骤不变,得到DMN-C 的制备。
1.5 载药量测定 将DMN 溶于1 mL 去离子水中,提取10 min 后,以8 000 r/min 离心,5 min 后取上清液过0.45 μm 微孔滤膜,以前期研究中的色谱条件测定其载药量。
1.4 形态特征及机械强度 将微针裁剪至合适大小置于Nikon Eclipse Ci-L 显微镜下观察形态特征,记录微针长度及宽度。使用HF-50 数显推拉力计测定微针纵向与横向的断裂力以确定DMN-A、DMN-B、DMN-C 的机械强度。
2 结果
2.2 载药量测定 针体载药的DMN-A 载药量最少,为(15.2±0.3)μg;背衬层载药的DMN-B 载药量较DMN-A 显著升高(P<0.01),达(87.4±2.8)μg;针体与背衬层均载药的DMN-C 载药量较DMN-A 也显著升高(P<0.01),为(103.7±3.2)μg;表明背衬层载药空间的增加使载药量明显提升。
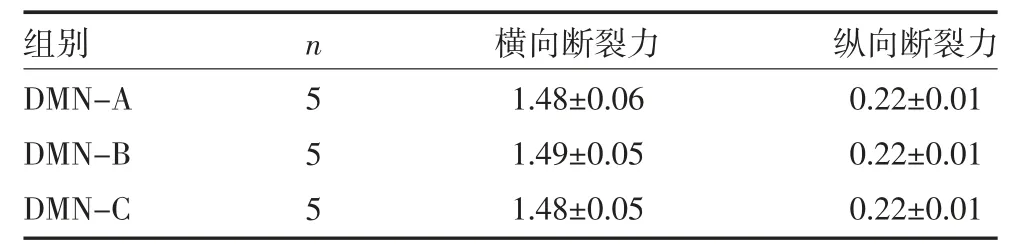
表1 不同部位载药的DMN 机械强度
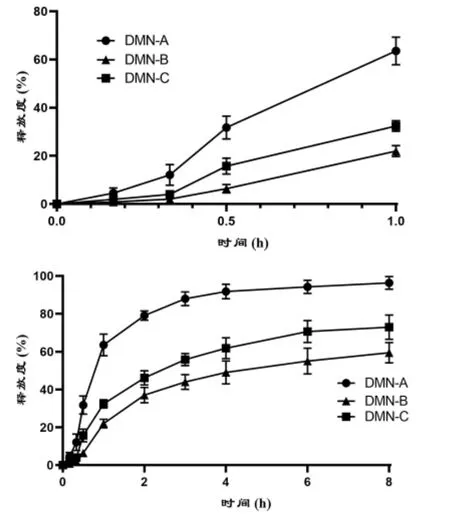
图2 不同部位载药可溶性微针1 h 与8 h 透皮释放曲线(n=3)注:DMN-A 是针体载药可溶性微针;DMN-B 为背衬层载药可溶性微针;DMN-C 为针体与背衬层均载药可溶性微针

图2 DMN 正置与侧置下形态特征(比例尺为1000 μm)
2.1 形态特征及机械强度 三种DMN 均由同一批微针模具制备,形态特征一致。如图2 所示,DMN 整体为金字塔形,正置镜头下可见正方形及棱边轮廓,侧置镜头下为三角形。DMN 高度达500 μm,底宽度为300 μm,针体之间间距约为850~900 μm。机械强度如表1 所示,DMN-A、DMN-B、DMN-C 的横向断裂力、纵向断裂力比较,差异均无统计学意义(P>0.05)。
2.3 体外透皮释放 体外透皮释放如图3 所示,三种不同的DMN 的释放均呈现缓释状态,但又有明显的差异。针体载药的DMN-A 在三者中释放速度最快,尽管在前期释放较慢(前20 min),但在1 h 已大于60%,且在4 h 已释放90%以上;背衬层载药的DMN-B 在三者中释放速度最缓,0.5 h 仍不足10%,8 h 未达60%,DMN-B 在8 h 仍呈释放趋势;针体与背衬层均载药的DMN-C 释放速度略快于DMN-B,但明显低于DMN-A,8 h 释放70%,在4~8 h 释放速度已有所减缓,但仍呈释放趋势。
三是“院校培育模式”。农业院校是培育新型职业农民的主力军,特别是在农业扶贫培训实践中,农广校等机构在培训调研、学员遴选、教师选聘、培训计划制订、培训教材选用等方面发挥着重要作用。农业院校充分发挥其自身在师资体系、场所、课程等方面的资源优势,对农民实施系统性的、专业的、全面的培训。
3 讨论
DNM 通过微米级针体穿透角质层,与体液接触后生物相容性材料溶解释放装封在微针中的药物[1-3]。前期研究发现,背衬材料溶解后亦会通过皮肤吸收。因此,本研究制备了不同部位载药的DMN-A、DMNB、DMN-C 并对其进行表征及体外评价。三种不同部位载药的DMN 形态特征一致,均为金字塔形,表明载药对形态无影响。DMN 通过针体穿过SC 释药,需要具备足够的机械强度。前期研究中发现PVP 及CS的复合材料可以增强机械强度,因此选择了两者机械强度比例制备DMN[5]。已有研究表明,金字塔形的微针相比于其他形状微针结构更为稳固[7],能够更好地穿透SC。所制备的三种微针在机械强度无明显差异,不同部位载药未改变机械强度。
进一步,通过对2017年不同读者实际参与采访工作的程度进行初步分析,得到如图1所示的结果。由图可知,研究生读者对采访工作的参与程度与借阅需求极度不对称(荐购书目册次与借阅册次比值小于0.05);由于我馆采访模式的设置,教职工对采访工作的参与程度较高;本专科生与全英语实验班的参与程度处于较低水平。
在制备的三种DMN 中DMN-A 的载药量最低,这是因为其只通过微针针体载药,相比于其余两者载药空间最小。尽管载药量较低,在释放时由于针体最先穿过角质层与体液接触,因此,DMN-A 释放速率远高于其余两者,在4 h 已基本释放完全。背衬层载药明显增加了载药空间,DMN-B 载药量约为DMN-A 的5.75 倍。但DMN-B 释放速率最慢,在最初30 min 释放极少,较DMN-A 呈现更明显的缓释趋势[8]。这是由于,DMN-B 需要先溶解进入皮肤的前端针体,然后再释放。由于针体与背衬层均载药,载药空间最大,DMN-C 载药量最高,约为DMN-A 的6.82 倍。在体外透皮释放时,DMN-C 针体溶解后在前期较DMN-B 也有明显释放,背衬层的缓慢释放也较DMN-A 持久。尽管DMN-C 兼具DMN-A 两者特性,但其在6 h 后仍有释放,甚至8 h 依旧未释放完全。而微针在穿透活体动物的角质层后,微孔道在6 h 基本恢复,8 h 恢复完全[8-9]。DMN-B、DMN-C 有部分在背衬层中的药物滞留在角质层外。因此,DMN-C相较DMN-A 虽显著提高了载药量,仍存在优化空间。后续可改进针体及靠近微针的前部背衬层用于载药,而靠后的背衬层部分不载药,调整其比例,使DMN-C 在6 h 内释放完全。
