POU2F2在肾透明细胞癌中的表达及其对肾癌细胞生物学行为的影响
2023-06-28蒋梅玉赵新鸿牛云峰李方龙邱建宏
蒋梅玉,赵新鸿,牛云峰,李方龙,邱建宏
(1.解放军联勤保障部队第九八〇医院,河北石家庄 050082;2.河北医科大学第四医院 河北省肿瘤研究所病理研究室,河北石家庄 050011)
肾细胞癌(renal cell carcinoma,RCC)占成人肾脏恶性肿瘤的80%~90%[1]。50%的肾癌为偶然发现,20%~30%的患者首诊时已发生转移[2],转移性肾癌5年生存率仅12%,远低于局部肾癌[3]。透明细胞肾细胞癌(clear cell renal cell carcinoma,ccRCC)约占肾癌发病率的70%~80%[4],是肾癌主要死亡原因[5]。因此寻找早期诊断和预后评估的分子指标及发病机制是提高患者生存率的重要手段。POU2F2是POU转录因子(transcription factors)家族(POU域) 成员,位于染色体19q13.2,在体内多种细胞中普遍表达,能与基因5′端启动子特异性结合,调控目的基因表达[6],在神经元[7-9]、免疫细胞[10]生长发育及多种肿瘤发生发展中起着重要作用。有文献报道POU2F2是调控胃癌、前列腺癌、乳腺癌、胰腺癌、淋巴瘤、肺癌、胶质瘤及宫颈癌等多种肿瘤发展过程中的关键靶标[11-18],影响肿瘤的发生发展,但其在ccRCC方面的研究尚未见报道。本实验通过了解POU2F2与ccRCC的关系,期待挖掘其在ccRCC治疗中潜在的临床应用价值。
1 材料与方法
1.1 实验标本来源ccRCC及癌旁正常组织取自河北医科大学第四医院生物标本库。简单随机抽样法选取2017-2020年收治的61例初诊ccRCC患者的手术标本,同时患者既往未曾接受其他器官恶性疾病手术及放化疗,病例信息完整且无其他系统恶性肿瘤疾病。最终纳入男性41例,女性20例;中位年龄55(27~81)岁。肿瘤直径≤4 cm 27例,>4 cm 34例。取ccRCC原发灶组织及相应癌旁正常组织(距原发灶边缘5 mm以上)。手术切除标本一部分石蜡包埋制片行HE染色;另一部分新鲜标本提取组织总RNA。所有组织标本由3位病理科主任医师确诊为ccRCC,癌旁正常组织无癌细胞浸润。本实验经河北医科大学第四医院伦理委员会批准通过(伦理编号:2020k-1147),研究对象均签署知情同意书。
1.2 实验材料反转录试剂盒购自瑞士Roche;MTS、实时荧光定量试剂盒购自Promega公司;LipofectamineTM2000购自美国Thermo公司;胎牛血清购自美国BI公司;DMEM高糖培养基购自美国Gibco公司;BCA蛋白浓度测定试剂盒、ECL发光试剂盒、DAB显色试剂盒、胰酶购自北京索莱宝;小鼠SP试剂盒购自北京中山金桥;重组质粒sh-POU2F2-763、sh-POU2F2-1013来自上海吉玛大鼠POU2F2单抗购自Abcam公司;羊抗鼠IGg二抗购自北京聚合美生物;EMT相关单抗购自北京天德悦生物科技。人肾癌细胞系ACHN、786-O,正常人肾上皮293-T细胞三株,由河北医科大学第四医院肿瘤研究所病理室馈赠。
1.3 实验方法
1.3.1实时荧光定量法(real-time polymerase chain reaction,qRT-PCR)检测 采用qRT-PCR检测POU2F2 mRNA在ccRCC组织和癌旁正常组织及其在细胞系(786-O和ACHN)和293-T中的表达。以GAPDH作内参,引物序列见表1。
1.3.2免疫组织化学法 免疫组织化学SP法检测ccRCC组织及癌旁正常组织中POU2F2蛋白的表达。人体组织标本经过40 g/L甲醛固定、石蜡切片、脱蜡至水,pH=9的EDTA抗原修复液高压修复20 min,POU2F2一抗(大鼠POU2F2单抗1∶1 000)4 ℃过夜,羊抗鼠IGg二抗(1∶1 000),SP试剂盒和DAB显色。PBS代替一抗做空白对照。
1.3.3肾癌细胞的培养 体积分数10%FBS+90%DMEM+1%双抗培养基常规培养肾癌细胞。
1.3.4细胞的转染以及转染效率的测算 重组质粒sh-POU2F2-763、sh-POU2F2-1013分别转染786-O细胞。空载质粒(sh-NC)作空质粒对照组。qRT-PCR测转染效率及EMT相关肿瘤标记物E-cadherin、N-cadherin、Vimentin、MMP2、MMP9、Snail、Twist、Zeb1mRNA的变化。
1.3.5克隆形成实验、MTS法检测细胞增殖 克隆实验:sh-NC组、sh-POU2F2-1013组转染后的786-O细胞消化重悬,6孔板(3×103个/孔)常规培养1周,40 g/L多聚甲醛固定20 min,体积分数0.1%结晶紫染色20 min,显微镜观察细胞团>50个细胞为1个克隆,计数克隆数目,计算克隆形成率。
MTS实验:将sh-NC组、sh-POU2F2-1013组转染后24 h的786-O细胞消化重悬,均匀的接种于96孔板(1×103个/孔),每组6个复孔。细胞贴壁后0、24、48、72、96 h每孔加20 μL MTS(终浓度500 μg/mL)并孵育2 h,分别测其在592 nm 的吸光度A值,代表细胞增殖能力。
1.3.6划痕实验对细胞迁移能力的影响 sh-NC质粒、sh-POU2F2-1013质粒转染24 h的786-O细胞,接种在6孔板(5×105个/孔)中长至完全融合时用200 μL枪头垂直划痕。光学显微镜观察0、12、24 h划痕宽度;计算细胞迁移率。细胞迁移率=(划痕宽度0h-划痕宽度12h/24h)/划痕宽度0h×100%。
1.3.7Transwell小室对细胞侵袭能力的影响 sh-NC组、sh-POU2F2-1013组质粒转染786-O细胞24 h后,小室的上室中均匀铺稀释Matrigel胶50 μL,过夜。上室加1×105个细胞+200 μL DMEM,下室加600 μL含血清的完全培养基。24 h后取出,固定、染色,擦去上室中的胶和细胞,显微镜下观察。
1.3.8Western blot检测相关质粒转染786-O细胞POU2F2蛋白和上皮间充质转化(epithelial-mesenchymal transition,EMT)肿瘤标记物的蛋白表达的变化 提取转染72 h后的786-O细胞蛋白。测定蛋白浓度,加样(30 μg/孔)进行10%SDS-PAGE进行电泳。转膜,封闭抗原,孵一抗(大鼠POU2F2单抗;兔单抗E-cadherin、MMP2、MMP9、Twist及β-actin浓度1∶1 000),4 ℃冰箱过夜。相应二抗(羊抗鼠IgG抗体1∶1 000,羊抗兔IgG抗体1∶1 000,)孵1 h,曝光成像。
1.4 统计学方法
采用 SPSS 25.0统计学软件分析、GraphPad Prism 8作图。所有实验均独立重复3次取平均值,非参数检验进行组间统计分析,统计量以中位数(四分位数间距)表示,计数资料两样本率的比较采用四格表χ2检验;双尾检验,P<0.05为差异有统计学意义。
2 结 果
2.1 POU2F2 mRNA在ccRCC组织中的表达及与临床参数之间的相关性POU2F2 mRNA在ccRCC组织中的表达明显高于相应正常肾组织(图1)[1.585(1.122,2.243)vs.0.567(0.361,1.049),Z=-4.823,P<0.001],差异具有统计学意义。POU2F2在ccRCC中的表达与临床病例参数间的关系见表2。

图1 ccRCC及癌旁正常组织中POU2F2mRNA的表达(***P<0.001)

表2 ccRCC组织中 POU2F2表达与临床病例参数的关系
2.2 ccRCC组织中POU2F2蛋白的表达POU2F2蛋白在ccRCC及癌旁正常组织中阳性表达率分别为47.5%(29/61)和26.2%(16/61),统计量(χ2=5.950,P=0.015),P<0.05(图2)。ccRCC组织POU2F2蛋白表达与临床病例参数之间的关系见表2。

A:ccRCC组织中高表达;B:在正常组织中低表达;C:POU2F2蛋白在不同组织中的表达情况比较。
2.3 POU2F2 mRNA在ccRCC细胞系中的表达POU2F2在293-T、786-O、ACHN细胞系中的表达分别为0.940±0.136、3.032±0.072、1.261±0.124。786-O、ACHN均高于293-T细胞[(t=17.878、P=0.003), (t=18.623、P=0.003)],差异均具有统计学意义。786-O细胞POU2F2表达量最高,选取其构建POU2F2敲低细胞株进行细胞功能试验(图3A)。

A:癌细胞系中POU2F2 mRNA的表达(**P<0.01);B:786-O细胞中敲低POU2F2基因的验证(*P<0.05)。
2.4 敲低质粒转染786-O细胞后测转染效率sh-NC组和sh-POU2F2-763、sh-POU2F2-1013组的POU2F2 mRNA表达量分别为1.011±0.180、0.957±0.032、0.302±0.003,sh-NC组与sh-POU2F2-763组相比差异无明显统计学意义(t=0.545,P=0.640),sh-POU2F2-1013组的表达明显降低(t=6.150,P=0.025),选取sh-POU2F2-1013质粒进行细胞功能试验(图3B)。
2.5 POU2F2敲低对肾癌细胞增殖能力的影响克隆结果:与sh-NC组相比,sh-POU2F2-1013转染786-O细胞后,细胞的增殖能力明显降低[(335.000±7.000)vs.(133.667±7.572),t=30.314,P=0.001,图4A]。MTS结果:与sh-NC组相比,sh-POU2F2-1013组在72和96 h增殖能力明显降低[(t72h=9.514,P=0.011)、(t96h=20.692,P=0.002)],差异均具有统计学意义(图4B)。
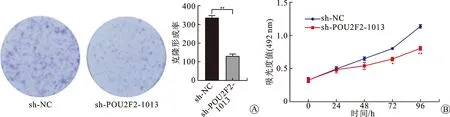
A:克隆形成实验检测POU2F2对786-O细胞增殖能力的影响,**P<0.01;B:MTS法检测POU2F2对786-O细胞增殖能力的影响,*P<0.05。
2.6 POU2F2敲低对肾癌细胞迁移能力的影响划痕实验结果,与sh-NC组相比sh-POU2F2-1013转染786-O细胞后,12 h迁移能力降低[0.283±0.016)vs.(0.219±0.003),t=5.792,P=0.029],24 h迁移能力亦明显降低[(0.514±0.007)、(0.438±0.021),t=4.653,P=0.043,图5]。

图5 敲低POU2F2基因后划痕实验结果(*P<0.05)
2.7 POU2F2敲低对肾癌细胞侵袭能力的影响Transwell小室侵袭结果,与sh-NC组相比sh-POU2F2-1013转染786-O细胞后,细胞的侵袭能力明显降低[(154.33±7.506)vs.(103.33±4.16),t=8.167,P=0.015,图6]。

图6 敲低POU2F2基因后Transwell小室侵袭实验结果(*P<0.05)
2.8 敲低POU2F2后对肾癌细胞EMT相关分子标记物表达的影响qRT-PCR结果在sh-POU2F2-1013转染组中,E-ca mRNA表达量(1.563±0.009)较sh-NC组(1.005±0.015)明显升高,P<0.05,MMP2、MMP9、Twist mRNA表达量较sh-NC组均降低[(0.438±0.015)、(1.000±0.002),(0.305±0.015)、(1.000±0.004),(0.211±0.002)、(1.000±0.016),P<0.05,图7A]。

A:q-PCR法检测sh-POU2F2-1013对EMT相关分子mRNA表达的影响,*P<0.05,**P<0.01;B:Western blot法检测sh-POU2F2-1013对EMT相关分子蛋白表达的影响。
Western blot结果与sh-NC组相比,sh-POU2F2-1013转染786-O细胞后,POU2F2蛋白表达量明显降低, EMT相关肿瘤标记物E-cadherin蛋白表达明显升高、MMP2、Twist蛋白表达明显降低,与mRNA的表达趋势一致(图7B)。
3 讨 论
POU2F2最早是由SINGH等[19]在免疫B细胞中发现的,广泛表达于淋巴结、脾脏等组织。一方面POU2F2受白介素1、白介素6、神经生长因子、炎症以及流感病毒等的调控,另一方面其能特异性识别靶基因的5′-ATTTGCAT-3′区域,调控靶基因的表达。它不仅参与人体正常的调控和免疫应答,也与多种肿瘤的发展有关。
本实验初步研究了POU2F2在ccRCC中的表达,首先检测POU2F2在ccRCC及癌旁正常组织的表达,结果显示POU2F2 mRNA在癌组织的表达量明显高于癌旁正常组织,与患者性别、WHO/ISUP核分级、TNM分期正相关。POU2F2蛋白在ccRCC中的表达量亦明显高于癌旁正常组织,与肿瘤病理分级及临床分期相关。ccRCC组织mRNA表达量和蛋白表达量与临床病例资料的关系并不完全一致,这可能是抽样误差导致样本与总体间存在差异或与基因转录及翻译后修饰等有复杂的关系。组织表达实验结果提示POU2F2在ccRCC中可能发挥癌基因的作用,为进一步探究POU2F2对肾癌细胞系786-O体外增殖、迁移、侵袭等生物学行为的影响,我们选取786-O、ACHN两株人肾癌细胞系分别检测POU2F2 mRNA的表达情况,786-O细胞POU2F2 mRNA的表达量最高,故选786-O进行敲低及功能试验。细胞功能试验表明:sh-POU2F2-1013质粒转染786-O细胞后,细胞的增殖、迁移、侵袭能力明显降低。
EMT指上皮细胞在某些因素的作用下,极性消失、黏附力下降,失去顶-基底极性,具备间质细胞形态及特性,更易突破基底膜,获得侵袭性和迁移能力[20]。此现象最早是在胚胎发育过程中被发现,指特定部位的上皮细胞发生的形态学改变。随着研究不断进展,发现在不良因素刺激下分化成熟的上皮细胞也可通过EMT产生间质纤维母细胞,参与组织纤维化的形成,上皮性肿瘤细胞也可通过EMT,实现其体内的侵袭和转移。该过程中上皮标记物E-cadherin[21]表达降低,而Twist[21];MMP2、MMP9[22];vimentin、ZEB1[23];β-catenin、N-cadherin[24]等间皮标记物表达增加。EMT在众多肿瘤转移[25]中得到广泛的研究,例如在前列腺癌[24]、肺癌、乳腺癌、胰腺癌、卵巢癌、肝癌、胃癌[26-31]。为了探究POU2F2是否影响ccRCC的EMT进程,进而影响肿瘤的生物学行为,本组实验检测敲低shPOU2F2-1013后分别从mRNA和蛋白表达水平检测EMT相关分子的变化,结果显示上皮标志物E-cadherin表达明显升高,而间质标志物MMP2、MMP9及Twist表达明显降低,提示POU2F2可以通过 EMT进而调节肾癌细胞的恶行生物学行为。
综上所述,本实验结果表明,POU2F2在ccRCC中高表达,并与ccRCC的发生、发展密切相关,敲低POU2F2可以抑制ccRCC细胞的体外增殖、侵袭和迁移能力,从而抑制 ccRCC的恶行生物学行为,为ccRCC的分子靶向治疗提供一些新思路。
