大蒜NAC基因家族的鉴定与低温表达分析
2023-06-27闫艺薇田洁
闫艺薇, 田洁,2*
(1.青海大学农林科学院,青海省蔬菜遗传与生理重点实验室,西宁 810016; 2.青海大学省部共建三江源生态与高原农牧业国家重点实验室,西宁 810016)
大蒜(Allium sativumL.)是百合科葱属2年生草本植物,营养物质含量丰富,且含有多种生物活性成分,是世界范围内种植面积较为广泛的药食兼用蔬菜。我国大蒜种质资源丰富,种植面积广。联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)2017年的统计结果显示,我国大蒜种植面积已有82万hm2,占全球种植面积的52.0%;大蒜总产量为2 222万t,占全球产量的78.9%[1]。目前,中国大蒜出口量及产量在全球遥遥领先[2]。大蒜作为青海省海东市乐都区的三大优势品牌蔬菜之一,种植面积已达1 014 hm2[3]。乐都区的大蒜具有很强的药用价值和保健作用[4],但高原大蒜易受低温胁迫,大蒜幼苗期持续低温胁迫将严重影响其生长发育[5]。
NAC(NAM、ATAF1/2、CUC2)家族是植物转录因子家族中最大的家族之一[6]。近年来,在长白落叶松[7]、刚毛柽柳[8]、水稻[9]、杨树[10]和玉米[11]以及众多园艺物种[12-14]中发现了大量NAC基因,研究表明,NAC转录因子家族积极参与植物对逆境胁迫的响应。赵艳青等[15]研究发现,黄瓜NAC基因家族在低温处理下的表达发生显著变化,说明其对响应低温胁迫发挥重要作用。Hou等[13]发现,辣椒NAC基因家族中的CaNAC064能够与低温诱导蛋白互作,从而提高植株耐寒性。在百合科作物中,洋葱[16]和卷丹百合[17]的NAC基因家族也具有低温胁迫应答作用。但目前尚未见有关大蒜NAC基因家族的研究报道,因此,本研究以课题组前期对‘乐都紫皮大蒜’低温胁迫转录组测序结果(未发表数据)为基础,在NR、Swiss-Prot、Pfam 3个数据库中进行注释,基于注释所得的NAC基因研究大蒜NAC转录因子家族对低温胁迫的响应,以期为深入研究大蒜NAC转录因子家族的生物学信息和具体功能奠定基础。
1 材料与方法
1.1 试验材料与处理
以‘乐都紫皮大蒜’的鳞茎为试验材料,以草炭土∶蛭石∶珍珠岩=2∶1∶1的栽培基质进行种植,然后置于RDN-560E-4智能人工气候箱(宁波东南仪器有限公司)中,于光照强度200 μmol·m-2·s-1、光照时间14 h、昼温25 ℃、夜温15 ℃、空气相对湿度70%的条件下进行培养。待培养至长出3~4片叶、株高10 cm左右时,对其进行如下处理:①对照(CK),继续使用上述方法对大蒜幼苗进行培养,定期浇水以保持土壤湿润;②低温胁迫处理(CT),对大蒜幼苗进行昼夜均为4 ℃的培养,光照强度、光照时间及空气相对湿度保持不变,定期浇水保持土壤湿润。
在低温处理0、4、12、24、120 h时进行取样,3次重复。每个重复取长势均匀的5株大蒜叶片做混样处理。将取下的新鲜样品立即放入液氮中冷冻,置于-80 ℃冰箱中保存,备用。
1.2 大蒜总RNA的提取、文库构建及转录组测序
采用TRNzol Universal总RNA提取试剂盒提取植物总RNA,纯化检测合格后,进行真核生物mRNA的富集,随后纯化合成双链cDNA进行PCR扩增;用AMPure XP beads 纯化PCR产物,以得到最终的文库。库检合格后,进行Illumina HiSeq 测序,通过Trinity拼接、Corset层次聚类后得到328 951条Unigene用于后续分析。
以‘乐都紫皮大蒜’低温胁迫转录组测序结果(未发表数据)为基础,在NR、Swiss-Prot、Pfam 3个数据库中进行注释,初步注释到49个大蒜AsNAC基因。
1.3 大蒜NAC家族的鉴定及分析
通过DNAMAN软件将所得的AsNAC核苷酸序列翻译为氨基酸序列,并利用在线网站ExPasy-ProtParam tool(https://web.expasy.org/protparam/)进行AsNAC蛋白理化性质分析,包括氨基酸长度、等电点、分子量、不稳定指数、脂溶系数以及总平均疏水指数。
1.4 系统进化树的构建及同源性分析
采用MEGA 6软件通过Muscle对大蒜和拟南芥(Arabidopsis thaliana)NAC的氨基酸序列进行多重比对,选择极大似然法(maximum likelihood,ML)、设置自检次数为1 000次进行系统进化树的构建。利用在线工具iTOL(https://itol.embl.de/)对进化树进行标记。
1.5 保守基序的测定及蛋白结构预测
利用在线网站MEME(https://meme-suite.org/meme/tools/meme)进行motif预测,数量设置为20,通过TBtools绘制结构域图。利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线工具进行AsNAC蛋白的二级结构模型预测。利用Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)在线工具进行AsNAC蛋白的三级结构模型预测,并通过Pymol软件对图片进行美化。
1.6 实时荧光定量PCR分析
采用TRNzol法提取处理0、4、12、24、120 h的大蒜叶片总RNA,并通过Honor™ Ⅱ 1st Strand cDNA Synthesis SuperMix for qPCR试剂盒合成cDNA。通过Primer Premier 5软件设计荧光定量PCR引物(表1),以不同时期叶片的cDNA为模板、大蒜CYP基因为内参,将目的基因与内参基因进行扩增。每份样品设置3次生物学重复,以大蒜CYP基因的表达量作为内参,采用2—ΔΔCT法计算各基因的相对表达量[18]。

表1 AsNAC 基因实时荧光定量PCR引物序列Table 1 Primer sequences of AsNAC genes for real-time fluorescence quantification
2 结果与分析
2.1 大蒜NAC蛋白理化性质的分析
在NR、Swiss-Prot、Pfam 3个数据库中进行注释,初步注释到49个大蒜AsNAC基因(表2)。对49个具有NAM和NAC功能结构域的大蒜NAC蛋白进行理化性质的分析发现,各NAC转录因子的理化性质差异较大。氨基酸长度以AsNAC011最小,为81 aa;以AsNAC031最大,为619 aa;平均为219.55 aa。等电点以AsNAC031最小,为4.78;以AsNAC006最大,为9.86;其中有16个NAC蛋白的等电点小于7,偏酸性;有32个NAC蛋白的等电点大于7,偏碱性;AsNAC035蛋白的等电点等于7,呈中性。蛋白分子量以AsNAC031最大,为70 229.04 Da;以AsNAC011最小,为9 293.66 Da;平均为25 800.09 Da。不稳定指数为16.76~51.78,脂溶系数为50.23~94.42。总平均疏水指数均小于0,说明49个NAC蛋白均为亲水蛋白。
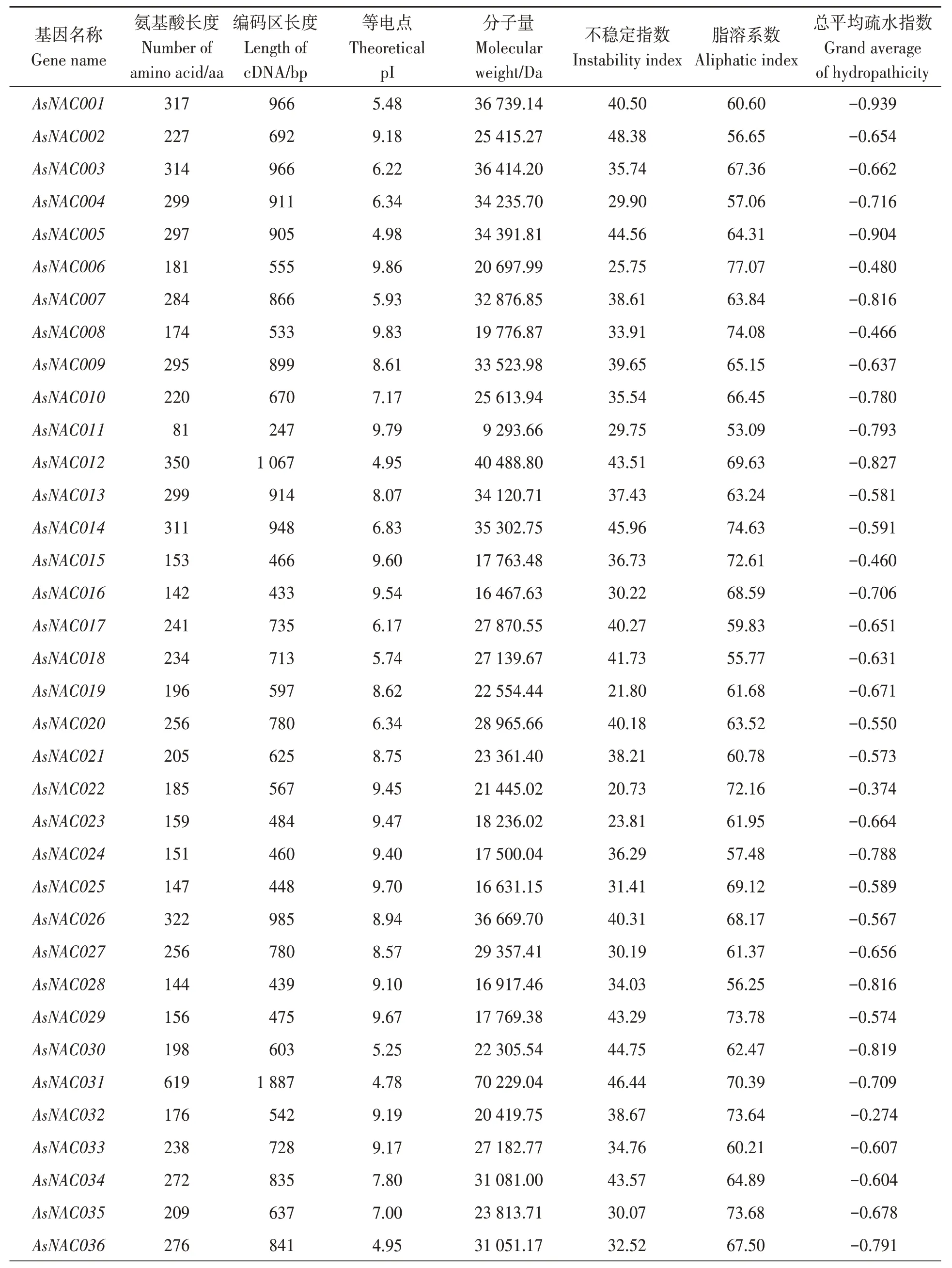
表2 大蒜NAC蛋白的理化性质Table 2 Physical and chemical properties of NAC proteins in Allium sativum L.
2.2 大蒜与拟南芥NAC家族的同源性分析
为研究大蒜与拟南芥NAC家族成员之间的进化关系,通过MEGA 6软件构建大蒜与拟南芥NAC蛋白的进化树,结果(图1)表明,大蒜NAC蛋白共分为10个亚族(Ⅰ~Ⅲ,Ⅴ~Ⅸ,Ⅺ~Ⅻ)。其中,第Ⅸ亚族的NAC蛋白数量最多,内含7个AsNAC蛋白和11个ATNAC蛋白。第Ⅴ亚族仅有1个NAC蛋白(AsNAC049)。第Ⅳ亚族和第Ⅹ亚族仅有ATNAC蛋白,无AsNAC蛋白,说明大蒜在长期进化过程中可能丢失了部分NAC基因。有9个亚族同时具有大蒜和拟南芥的NAC蛋白,说明大蒜和拟南芥的NAC家族在进化水平上具有较高的相似性。

图1 大蒜与拟南芥NAC转录因子系统进化树Fig. 1 Phylogenetic tree of NAC transcription factors in Allium sativum L. and Arabidopsis thaliana
2.3 保守基序的测定
对大蒜49个NAC蛋白序列进行保守结构域分析,有48个AsNAC蛋白序列被鉴定出保守结构域,共得到20种motif。同时将这48个AsNAC蛋白序列通过极大似然法构建进化树,共分为10个小组,如图2所示,标注为a~j,其中j小组包含的AsNAC蛋白最多,有8个;e小组仅有AsNAC031蛋白。

图2 大蒜NAC家族的蛋白保守基序Fig. 2 NAC proteins conservative motif of Allium sativum L.
分析motif和蛋白结构域(图2)发现,AsNAC蛋白具有较为保守的N端和多样的C端。其中motif 3、motif 4、motif 1、motif 2和motif 5为AsNAC转录因子N端的5个保守结构域,共18个蛋白同时含有这5个保守结构域,且相对位置也一致。同时这5个保守结构域出现的次数也最多,分别为38、39、48、48和27次。motif 6、motif 7、motif 8、motif 9、motif 10、motif 11、motif 12、motif 13、motif 14、motif 15和motif 18出现在一些AsNAC蛋白的C端。motif 16仅存在于g组中AsNAC029、AsNAC038、AsNAC015和AsNAC040蛋白序列的N端。motif 17仅出现在b组AsNAC蛋白(AsNAC018、AsNAC046、AsNAC047、AsNAC043、AsNAC017、AsNAC042)中,其中AsNAC047蛋白的N端和C端均有motif 17,其余5个AsNAC蛋白仅在N端存在motif 17。motif 19仅存在于i组AsNAC008和AsNAC026蛋白的N端。motif 20仅存在于i组AsNAC009和AsNAC026蛋白的C端。
2.4 大蒜NAC蛋白二级、三级结构预测
在同时含有motif 3、motif 4、motif 1、motif 2、motif 5的18个大蒜NAC蛋白中随机筛选6个蛋白(AsNAC001、AsNAC010、AsNAC013、AsNAC014、AsNAC017、AsNAC047)对其进行二级和三级结构预测,结果(图3和4)表明,无规则卷曲是构成大蒜NAC蛋白的重要组成部分,所占比例为48.18%~64.88%;其次是α-螺旋和延长链,占比分别为13.69%~32.73%和9.46%~20.33%(表3)。由此可见,大蒜NAC蛋白的三维模型具有高度的相似性,含有大量的无规则卷曲及延长链,与前期二级结构的各项预测结果一致。
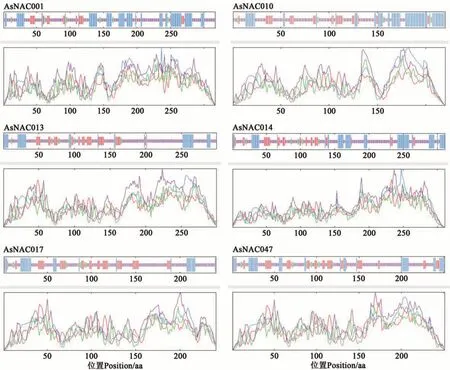
图3 大蒜NAC蛋白二级结构分析Fig. 3 Secondary structure prediction of NAC proteins in Allium sativum L.
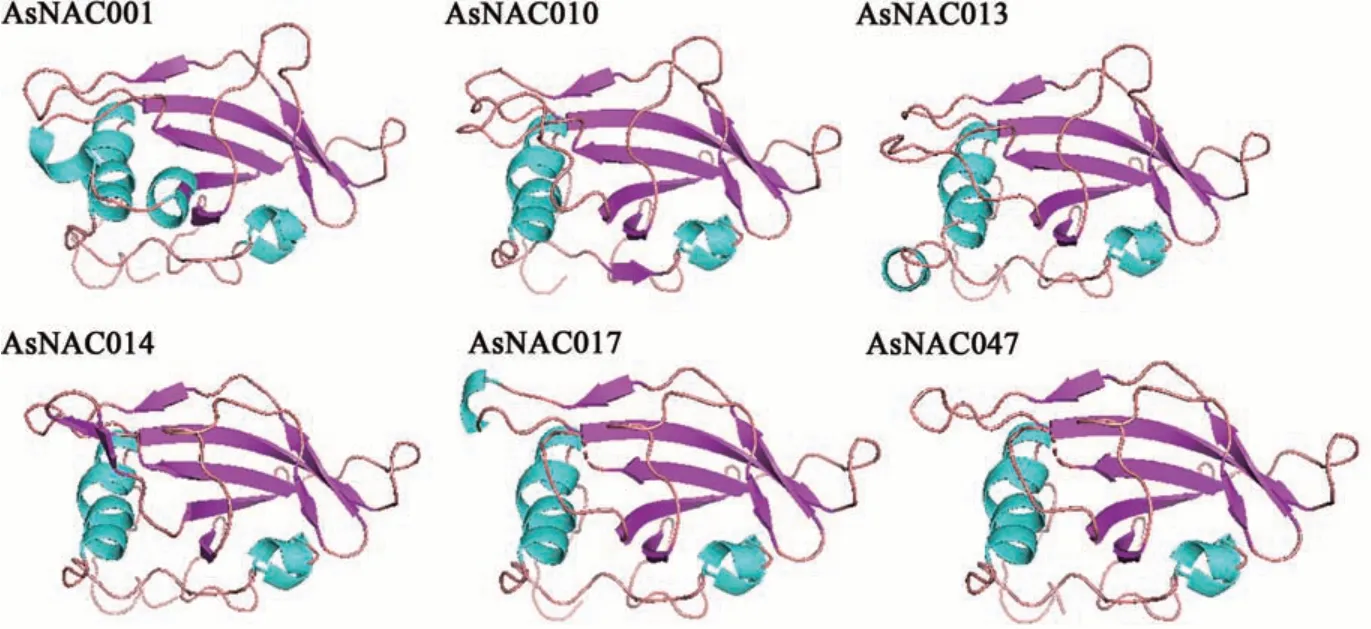
图4 大蒜NAC蛋白三级结构分析Fig. 4 Tertiary structure prediction of NAC proteins in Allium sativum L.

表3 大蒜NAC蛋白二级结构分析Table 3 Secondary structure prediction of NAC proteins in Allium sativum L.(%)
2.5 qPCR分析
为进一步探究大蒜NAC家族基因在低温响应过程中起到的调控作用,对AsNAC001、AsNAC010、AsNAC013、AsNAC014、AsNAC017、AsNAC047共6个基因在叶片中的表达进行分析,结果(图5)表明,随着胁迫时间的延长,AsNAC001、AsNAC010、AsNAC013和AsNAC014基因的表达呈先升高再降低趋势,且在低温胁迫12和24 h时显著上调表达;AsNAC017和AsNAC047基因的表达量在低温胁迫初期(4 h)呈显著下调表达,而后呈先升高后降低的趋势。总体看来,AsNAC010基因的表达量最高,其次是AsNAC001和AsNAC014。由此可见,不同大蒜NAC基因可在不同胁迫时间发挥生理调控功能。
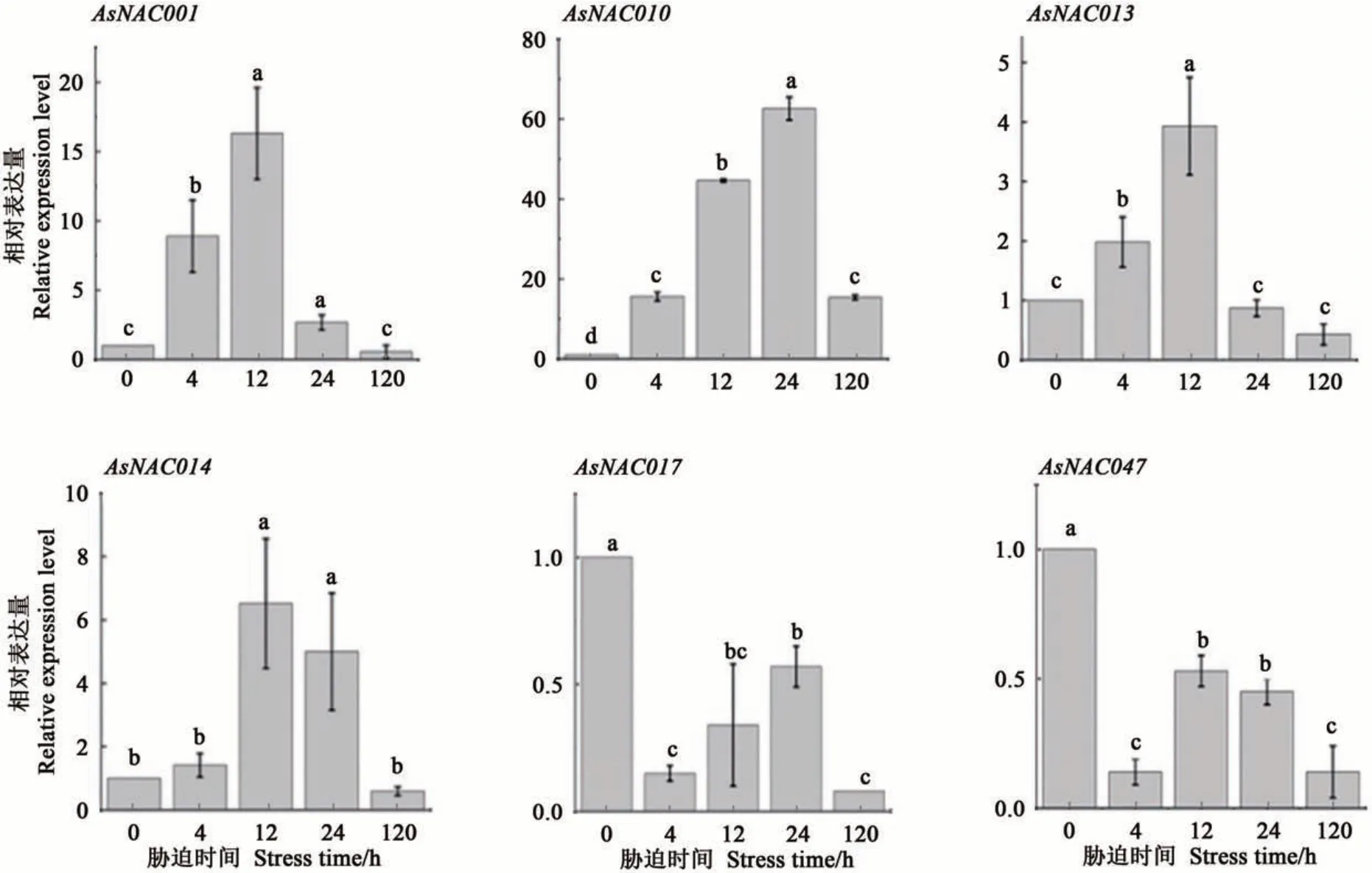
图5 大蒜NAC基因在不同胁迫时间下的表达分析Fig. 5 Expression analysis of NAC genes in Allium sativum L. in different stress times
3 讨论
大蒜的种植温度虽然较为广泛,但青藏高原常有的低温气候依然会影响大蒜幼苗的生长发育[19-20]。研究表明,低温会造成细胞膜冻结,并通过生理机能及其他胁迫抑制植物的生长发育,对植物造成不可逆转的伤害,从而严重影响其产量和品质[21-22];极端温度甚至会造成植物死亡[23]。
NAC家族作为植物转录因子家族中最大的家族之一[6],主要存在于陆生植物中[24]。近年来已被证实在植物的生长发育过程中起到广泛的调节作用,包括纤维发育[25]、叶片衰老[26]、细胞扩增[27]及果实成熟[28]等。此外,NAC对植物响应非生物胁迫也具有调控功能,约25%NAC基因参与一种或多种逆境响应[29]。目前,NAC基因在低温胁迫应答中的作用受到越来越多研究者的关注,Mao等[30]研究发现,过表达TaNAC67的转基因拟南芥在严重冰冻胁迫下的耐受能力强于野生型;王营等[31]分析细叶百合LPNAC13基因在低温处理(2 ℃)下的表达特征,发现其根中LPNAC13基因在低温胁迫6 h内表达显著上调;宋琴等[16]研究表明,4 ℃处理使洋葱幼苗叶片的NAC表达量显著上调。本研究基于大蒜转录组测序结果进行分析,共获得49个大蒜AsNAC基因,其数量低于拟南芥(117)、水稻(151)[32]、大豆(152)[33]等作物,可能是由大蒜基因组相对较保守。49个AsNAC蛋白均为亲水蛋白,根据大蒜与拟南芥NAC家族的进化树分析,将其分为10个亚族。同一亚族内的NAC蛋白序列相似度较高,可能具有相似的生理调控功能。其中,有9个亚族中同时包含大蒜和拟南芥的NAC蛋白,但不同亚族中的数量存在差异,可能是在长期的进化过程中存在基因复制或者基因丢失现象[34-35];仅AsNAC049单独为1个亚族,与拟南芥同源性较低,但其与第Ⅵ和第Ⅶ亚族有一定的相似度,推测其可能在大蒜的生长发育中具有特殊作用。大蒜NAC蛋白长度为81~619 aa,大部分AsNAC蛋白的N端都具有motif 3、motif 4、motif 1、motif 2、motif 5的结构域,且相对位置保持不变;而C端的motif差异较大,符合NAC蛋白N端保守、C端多样化的特征[36]。但并不是所有NAC蛋白的N端都有上述5个保守结构域,AsNAC032、AsNAC028、AsNAC022、AsNAC023、AsNAC031、AsNAC045、AsNAC016、AsNAC041、AsNAC024蛋白的N端仅有motif 3、motif 4、motif 1、motif 2,无motif 5;AsNAC049蛋白的N端仅有motif 4、motif 1、motif 2、motif 5,无motif 3,说明AsNAC蛋白的N端在保守的同时也具有一定的多样性。研究发现,NAC家族的部分保守结构域不仅对植物生长发育起调节作用,还对非生物胁迫的应答响应具有重要意义[37-39]。
对选取的6个大蒜NAC蛋白(AsNAC001、AsNAC010、AsNAC013、AsNAC014、AsNAC017、AsNAC047)进行二级和三级结构预测,结果表明三级建模与二级结构预测结果一致,且这6个蛋白结构高度相似,推测不同大蒜NAC蛋白可能具有相似的生理调控功能。进一步分析大蒜叶片中这6个NAC基因在低温胁迫下的表达模式,有4个基因(AsNAC001、AsNAC010、AsNAC013、AsNAC014)在胁迫12和24 h时呈显著上调表达;2个基因(AsNAC017、AsNAC047)在胁迫4 h时呈显著下调表达,说明不同大蒜NAC基因可在不同胁迫时间发挥生理调控功能。Zhuo等[39]研究了15个梅花NAC基因的冷应激反应模式,发现PmNAC11、PmNAC20、PmNAC23、PmNAC40、PmNAC42、PmNAC48、PmNAC57、PmNAC60、PmNAC66、PmNAC86基因呈上调表达;PmNAC59、PmNAC61、PmNAC82、PmNAC85、PmNAC107基因呈下调表达。本研究中,AsNAC010的表达量最高,可能在大蒜应对低温胁迫中起关键作用,但其具体调控机制仍需进一步研究。
