再生障碍性贫血患者RNA互作网络分析及潜在治疗药物预测*
2023-06-25王紫宁陈浩然张钧栋李泓毅张昊军卢学春
王紫宁, 陈浩然, 张钧栋, 李泓毅, 张昊军, 卢学春△
1解放军医学院,北京 100853 2中国人民解放军总医院第二医学中心血液病科,国家老年疾病临床医学研究中心,北京 100853 3山西医科大学管理学院,太原 030604
再生障碍性贫血(aplastic anemia,AA)是一种以全血细胞减少和骨髓过度脂肪化为特点的可危及生命的骨髓衰竭性疾病。AA在亚洲的发病率较欧美国家高出2~3倍,其年发病率在中国为0.74/10万人口[1]。骨髓中T细胞异常活化所致的自身免疫异常是AA的发病机制之一,其可促进TNF-α、INF-γ在内的多种细胞因子释放,从而通过Fas/FasL信号途径诱导造血干细胞凋亡。miRNA是一组长度在18~23个核苷酸的保守非编码小分子RNA,可通过与mRNA的3′非翻译区(3′-UTR)结合从而实现负向调节,在RNA沉默和基因的转录后调控中发挥作用,影响生物学进程。已有研究证实重型急性再生障碍性贫血患者CD4+T、CD8+T细胞中miR-126-3p、miR-145-5p、miR-223-3p表达下调[2],而miR-150-5p和miR-146b-5p水平上调。调节性T细胞(regulatory T cell,Treg)是人体免疫平衡的重要环节,而大多数自身免疫性疾病中往往存在着Treg的数量不足或功能缺陷,AA患者Treg数量减少且功能受损[3-4]。然而,miRNAs及其靶向mRNAs在T细胞活化和AA发病机制中的具体作用尚未明确。因此,本研究通过生物信息学方法筛选AA患者T细胞差异表达的miRNA,构建T细胞的miRNA-mRNA调控网络,筛选得到二甲双胍具有潜在治疗作用。为了解其治疗难治性AA的疗效及安全性,本文在原有研究[5]基础上,继续纳入难治性AA患者进行疗效分析,以期为难治性AA的药物治疗提供新的理论依据。
1 材料与方法
1.1 AA相关RNA-seq数据筛选
以“aplastic anemia”为检索词在GEO(Gene Expression Omnibus)数据库中检索再生障碍性贫血相关的转录组测序数据。数据集的纳入标准如下:①物种为人;②实验设计完整,且疾病组与正常对照组样本量均包含2例或2例以上重复对照;③疾病组与正常对照组的样本细胞系均为T细胞。最终,基于GPL14613(Affymetrix基因芯片miRNA 2.0阵列)平台的GSE82095数据集和基于GPL24676[Illumina NovaSeq 6000(Homo sapiens)]平台的GSE181989数据集符合标准,并被选作后续分析。所选数据集中样本的特征如表1所示[6]。

表1 所选数据集样本临床信息Table 1 Clinical data of samples from the selected datasets
1.2 miRNA与mRNA的差异表达分析
从GEO数据库下载GSE82095的miRNAs原始表达数据集和GSE181989的mRNAs系列矩阵文件。对于芯片数据,使用R语言中affy包进行背景校正、归一化,使用limma包进行差异分析得到差异表达mRNAs(differential expression mRNAs,DE-mRNAs)。使用稳健的多数组平均(robust multi-array average,RMA)算法对数据进行归一化,并使用K近邻(K Nearest Neighbor,KNN)进行缺失值估算,采用贝叶斯t检验筛选正常对照组和疾病组差异表达基因;对于RNA-seq数据,使用seurat包[7]进行差异分析,得到差异表达miRNAs(differential expression miRNAs,DE-miRNAs)。筛选DE-mRNAs和DE-miRNAs的阈值为P<0.05且|log2FC|>0。
1.3 DE-miRNAs靶向mRNAs的鉴定
通过miRNet(https://www.mirnet.ca/)miRNA综合分析工具,集成了18个数据库(包括miRTarBase、TarBase、miRecords、SM2 miR、PharmacomiR、HMDD、miR2 Disease、PhenomiR、EpimiR、starBase、TransmiR、ADMIRE、PolymiRTS、SNP2TFBS、TSmiR、IMOTA、ExoCarta、TAM)中的高可信度miRNA靶相互作用数据,预测DE-miRNAs的靶向mRNAs[8]。
1.4 mRNA与miRNA的负调控网络
因为miRNA通常与靶向mRNA之间存在着相反的表达关系,将miRNet预测的靶向mRNAs与DE-mRNAs进行比较,识别出重叠的mRNAs。然后将两组之间重叠的mRNAs与DE-miRNAs进行负相关配对(miRNA上调与mRNA下调、miRNA下调与mRNA上调),并将其定义为失调mRNA。
1.5 功能基因注释与通路富集分析
使用R包ClusterProfiler和EnrichPlot对异常mRNA进行了基因本体论(Gene Ontology,GO)功能注释和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集化分析。
1.6 AA潜在治疗药物筛选
通过本团队前期建立的表观精准治疗预测平台(EpiMed)对上述差异表达基因进行多组学关联分析,在已知化合物、临床常用药物以及中药中寻找可能对AA具有治疗作用的药物或化合物,并以关联系数<-0.1,FDR<0.05为阈值筛选负相关药物。同时使用KEGG富集分析,对AA和筛选得到的治疗药物之间的共同作用通路进行分析。
1.7 诊断及纳入标准
本研究经解放军总医院伦理学委员会批准,并登记注册临床试验(ChiCTR2000028833)。难治性AA(refractory or resistant aplastic anemia,rAA)为既往曾接受一线IST治疗6个月后疾病尚未缓解,外周血细胞仍持续性减少的患者,包括慢性再生障碍性贫血(chronic aplastic anemia,CAA)及重型急性再生障碍性贫血(severe aplastic anemia,SAA),其严重程度分型参照Camitta标准及Bacigalupo标准。在原有针对27例难治性AA患者的研究[5]基础上,继续纳入13例患者作为研究对象。所有患者均对本研究知情同意。纳入患者标准为:年龄在14周岁及以上,经临床确诊为难治性再生障碍性贫血患者;接受过正规治疗,包括环孢素A(CsA)、抗人胸腺球蛋白和抗人淋巴细胞球蛋白(ATG/ALG)、雄激素等治疗方法,且接受上述治疗后效果不佳,根据疗效评估标准诊断为无效或疾病进展。
1.8 治疗方案
入组患者均接受含盐酸二甲双胍联合治疗方案,具体包括:盐酸二甲双胍片250 mg×3/日;环孢素A胶囊3 mg/(kg·d);司坦唑醇片2 mg×3/日;并根据患者情况不同,辅以叶酸片、腺苷钴胺片等口服治疗。在HGB<60 g/L,PLT<10×109/L时分别给予红细胞和血小板输注支持治疗。并监测患者在治疗期间出现的不良反应。
1.9 随访与疗效评定标准
所有患者随访至2022年9月31日,失访患者截止到末次就诊时间。在服用药物后1、3、6、12个月进行临床疗效评估。
疗效判定参照Camitta标准并略加修改,具体如下:①完全血液学反应(CR):脱离血制品输注,HGB>100 g/L,ANC>1.5×109/L,PLT>100×109/L,随访12个月以上未复发。②部分血液学反应(PR):脱离既往输血依赖;至少一系血细胞恢复至正常或增长到基线的2倍;任何一系血细胞基线水平上升并维持3个月及以上,包括HGB增长30 g/L以上(治疗前<60 g/L)、ANC增长0.5×109/L以上(治疗前<0.5×109/L)、PLT增长20×109/L以上(治疗前<20×109/L)。③无效血液学反应(NR):患者未脱离血制品输注依赖,症状、血常规未达PR或疾病进展。
1.10 统计学方法
所有结果均采用R语言软件进行分析。符合正态分布的计量资料以均数±标准差表示,非正态分布的计量资料以中位数Md(IQR)表示。分类变量使用卡方检验;连续型变量使用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 mRNA与miRNA的差异表达分析
分别对AA患者和正常对照组人群T细胞mRNA和miRNA表达谱进行差异分析,共鉴定出1261个DE-mRNAs(471个上调,790个下调)和78个DE-miRNAs(45个上调,33个下调)(图1)。
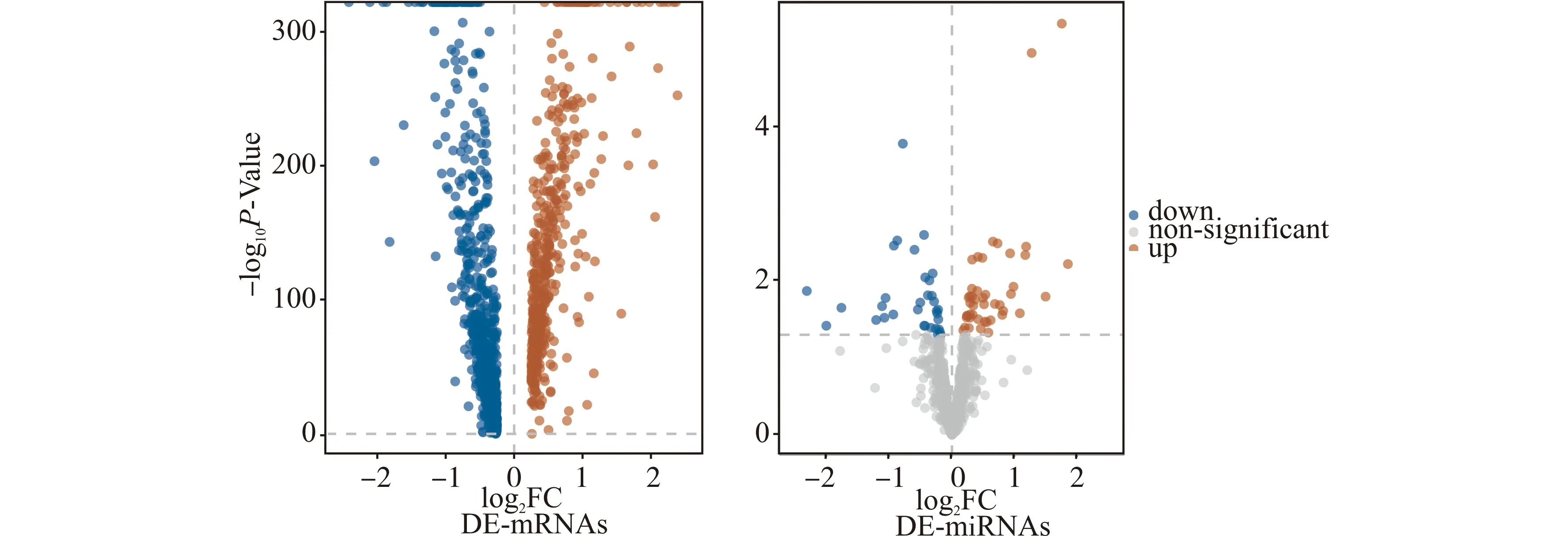
图1 AA患者与正常对照T细胞中mRNA与miRNA差异分析火山图Fig.1 Volcano plot of mRNA and miRNA differential analysis in T cells of AA patients and healthy controls
2.2 DE-miRNAs的靶mRNAs预测
按照负调控原则,预测AA中的mRNA-miRNA调控网络,将DE-miRNAs的靶向mRNAs与DE-mRNAs进行负向配对,最终获得26个miRNA与168个靶向DE-mRNA(失调mRNA)的调控关系(表2),并构建调控网络(图2)。

表2 DE-miRNAs调控方向与靶向mRNAs数量的关系Table 2 Relationship between regulatory tendency of DE-miRNAs and number of targeted mRNAs
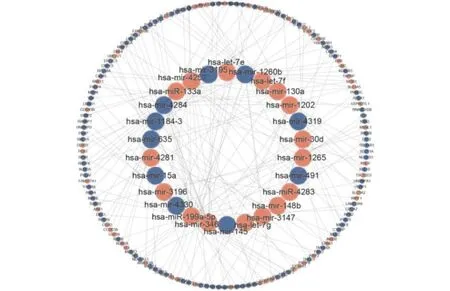
图2 DE-miRNAs与失调mRNAs调控网络Fig.2 Regulatory network of DE-miRNAs and targeted mRNAs
2.3 功能基因注释与通路富集分析
利用GO功能富集分析来研究168个失调mRNA的生物学意义,GO功能包括3类:细胞组分(cellular component,CC),生物过程(biological progress,BP)和分子功能(molecular function,MF),取GO富集分析中每个类型前5条结果进行可视化,结果显示,AA相关失调mRNA可能参与了T细胞分化、造血调控、物质代谢等过程,主要富集在细胞质、内质网以及染色体区等细胞部位,主要与调控细胞代谢、基因表达转录、端粒酶RNA结合等功能相关(图3)。对168个失调mRNA进行KEGG通路富集分析,结果显示,失调mRNAs主要富集在病毒感染、mTOR信号通路、PI3K-Akt信号通路、细胞凋亡以及物质代谢等信号通路(图4)。

图3 168个失调mRNA的GO富集分析结果Fig.3 GO enrichment analysis result of 168 DE-mRNAs
2.4 AA潜在治疗药物筛选
使用EpiMed平台将AA疾病转录组与药物相关转录组进行关联分析,对潜在治疗药物进行筛选。结果发现,环孢素A、吗替麦考酚酯、雷帕霉素、二甲双胍、维生素B、白藜芦醇、姜黄素等药物与AA疾病转录组具有相关性。同时,我们发现二甲双胍作为降血糖药物,其关联强度大于环孢素A和甲泼尼龙,且具有多个共同靶点(CD74、IFITM1、IFITM3等)。对AA具有潜在干预作用的药物及其相关靶分子详见表3。
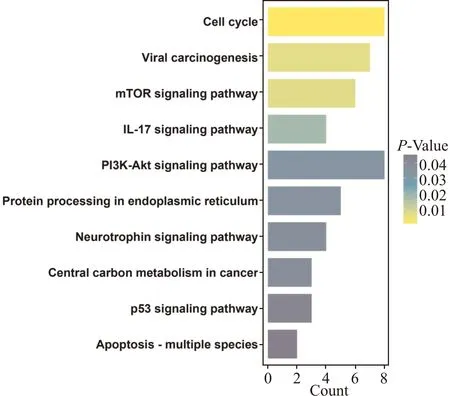
图4 168个失调mRNA的KEGG富集分析结果Fig.4 KEGG enrichment analysis result of 168 DE-mRNAs

表3 EpiMed表观精准治疗平台预测结果Table 3 Prediction result of EpiMed epistemic therapy platform
2.5 纳入患者基本临床特征
共纳入明确诊断为难治性再生障碍性贫血(rAA)并应用含盐酸二甲双胍联合治疗方案患者共40例。患者中位年龄39.6(28,47)岁,其中男17例,女23例,SAA患者12例,CAA患者28例。应用含盐酸二甲双胍联合免疫抑制剂治疗前,CAA患者中位病史间期1.98(0.63,4.10)年,SAA患者中位病史间期1.65(0.58,2.96)年,患者治疗前的临床及实验室特征详见表4。两组患者治疗前血红蛋白浓度、血小板计数、红细胞计数、中性粒细胞计数绝对值的差异具有统计学意义(均P<0.05),其余临床特征比较差异无统计学意义。
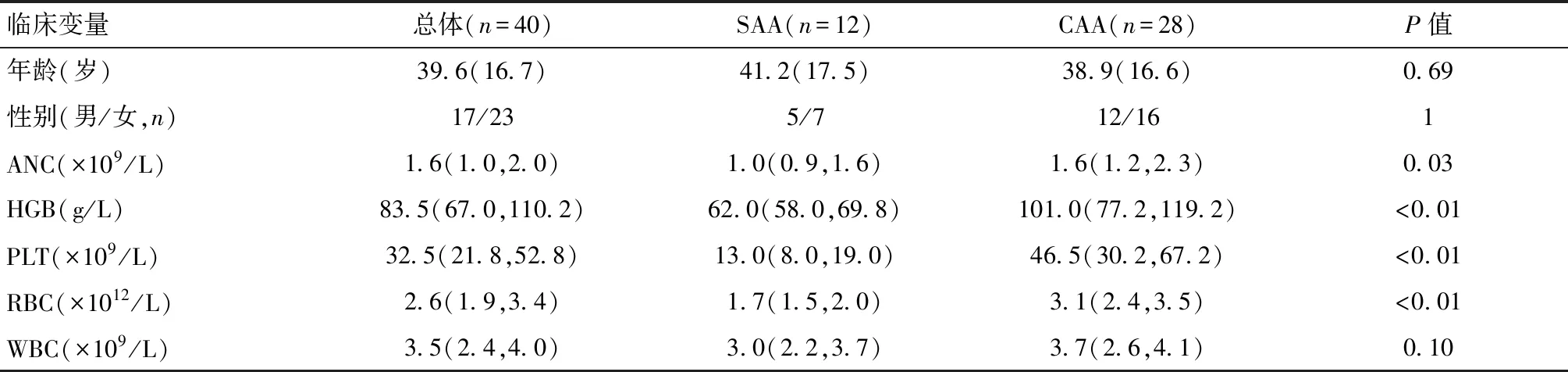
表4 40例rAA患者初诊时基本临床特征[Md(IQR)]Table 4 Clinical characteristics of 40 patients with refractory aplastic anemia at first hospital visit[Md(IQR)]
2.6 疗效评价
接受治疗的40例rAA患者中,无早期死亡事件发生。经盐酸二甲双胍联合环孢素A方案治疗后1、3、6、12个月分别有70%、70%、80%、88%的患者获得血液学反应。治疗后患者的血液学反应例数及血液学反应率见表5。40例患者在接受联合方案治疗后12个月的中位血红蛋白浓度、中性粒细胞计数和血小板计数相对于基线明显增加。SAA患者血红蛋白、血小板、红细胞水平在治疗前后差异均有统计学意义(均P<0.05);中性粒细胞计数在治疗前后的差异无统计学意义(P=0.12)。CAA患者血红蛋白、红细胞水平在治疗前后差异有统计学意义(均P<0.05)。CAA及SAA患者治疗前及治疗后12个月的具体疗效指标见表6。
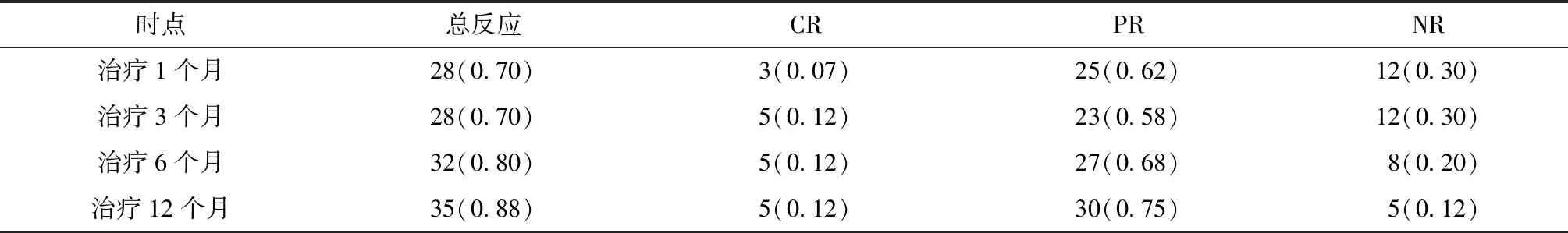
表5 40例rAA患者经盐酸二甲双胍联合环孢素A方案治疗后疗效[n(%)]Table 5 Efficacy of Metformin hydrochloride combined with Cyclosporine A in the treatment of 40 patients with refractory aplastic anemia[n(%)]
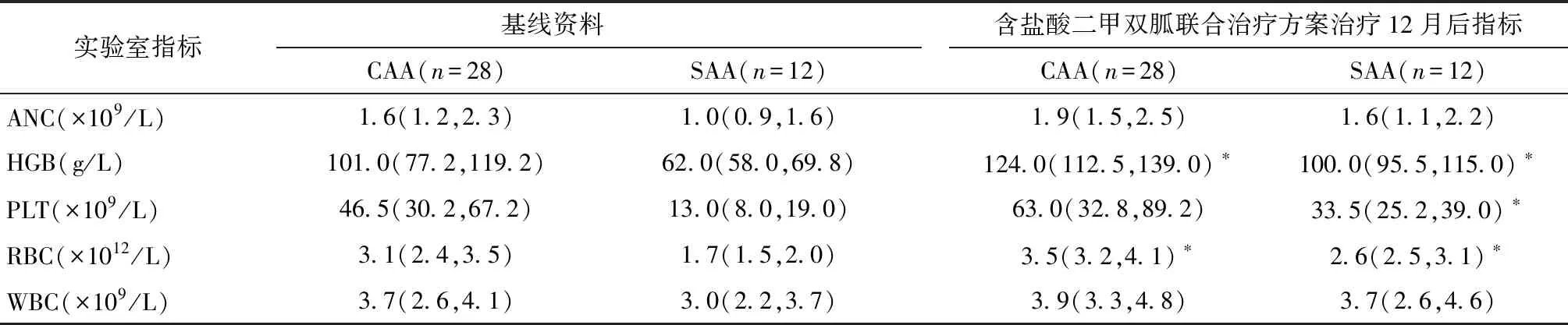
表6 40例rAA患者治疗前后血液学指标变化Table 6 Changes of hematological indicators of refractory aplastic anemia patients before and after Metformin hydrochloride based therapeutic regimen
3 讨论
AA是一种由免疫介导的造血功能衰竭性疾病,主要表现为免疫介导的骨髓造血组织被脂肪替代、造血干细胞凋亡以及无效造血导致外周血细胞减少[9]。骨髓间充质干细胞介导的微环境改变及成脂/成骨分化失衡在AA的发病机制中同样起重要作用。近年来,miRNA在免疫细胞分化、炎症、自身免疫系统疾病、血液系统恶性肿瘤的发生和发展中的研究不断深入,有学者提出其可作为疾病的潜在生物标志物。目前miRNA在AA中的作用机制尚未完全阐明,既往研究主要关注miRNA与CD34+细胞、间充质干细胞之间的关系,缺乏针对T细胞的miRNA-mRNA调控网络研究。Hosokawa等[2]研究表明,SAA与CAA患者在分别接受免疫抑制治疗后,其外周血单核细胞中存在特征性的miRNA差异表达谱。miR-126-5p与AA治疗的反应呈负相关,在诊断及治疗前miR-126-5p表达较高的患者无进展生存期较短,表明miRNA可作为AA诊断和疾病监测的潜在生物标志物。
本研究通过构建AA骨髓T细胞的miRNA-mRNA调控网络,得到差异表达的miRNAs,上调miRNAs主要为hsa-miR-199a-5p、hsa-miR-4252、hsa-miR-346,其靶向mRNA数量分别为30、22、20个;下调miRNAs主要是hsa-miR-4284、hsa-miR-1260b、hsa-miR-635,靶向mRNA数量分别为20、19、6个。hsa-miR-199a-5p是miR-199家族成员之一,目前已被证明是乳腺癌、肝癌、肺癌的肿瘤抑制性miRNA[10]。骨髓微环境中脂肪细胞在造血微环境稳态及骨重塑中发挥着重要作用。miR-199a-5p在PPARγ的调控下表达上调,可通过靶向TGFBI促进骨髓过度脂肪化,从而增加AA无效造血,加速疾病进展[11]。Wang等[12]发现miR-346通过Wnt/β-catenin信号通路促进Cyclin D1、c-Myc、TCF-1和LEF-1等下游基因表达,从而促进骨髓间充质干细胞成骨分化。此外,在Burkitt淋巴瘤细胞系相关实验中发现,miR-346还可靶向抑制HIF-1α/VEGF轴,降低肿瘤血管的生成活性且提高放疗敏感性[13],表明miR-346在骨髓间充质干细胞分化、血管生成等方面均发挥一定作用,与AA发病机制相吻合。研究表明,miR-4284可能是不同类型肿瘤及炎症性疾病的生物标志物,具有调控细胞凋亡或参与免疫炎症相关通路的作用,如过表达的miR-4284可促进胃癌、非小细胞肺癌细胞生长、迁移及侵袭[14];强直性脊柱炎患者的MSCs中miR-4284的下调可导致CXCL5表达增加,抑制破骨细胞的生成等[15]。miR-1260b与化疗药物敏感性、肿瘤淋巴结转移、细胞增殖与凋亡以及肿瘤细胞迁移等生物学过程相关,可通过靶向内皮细胞中HIPK2增强血管生成,因此学者提出miR-1260b可作为肿瘤疾病诊断或预后标志物[16]。李峻等[17]通过对AA患者外周血单核细胞miRNA的分析发现,CAA和SAA患者中miRNA-1260b差异表达具有统计学意义,通过抑制ETS1的表达,进而促进Th17的分化,在再生障碍性贫血的发病中发挥作用。现有研究表明miR-635可通过靶向PART1影响FUS/EZH2等蛋白的表达,调控Toll样受体信号通路及调节免疫进程,与肿瘤的生长密切相关,可作为肿瘤靶向治疗的靶点[18]。
与既往研究相比,本研究筛选得到的的差异miRNAs调控不同的mRNAs,AA相关失调mRNA主要富集在细胞质和染色体区,主要涉及细胞凋亡、mTOR信号通路、PI3K-Akt以及IL-17信号通路等脂向分化级免疫相关的KEGG通路。由此,本研究推测异常免疫系统攻击造血系统后导致骨髓造血细胞衰竭,为骨髓脂肪细胞的分化形成提供了优越条件,反之其分泌的多种活性物质及脂肪因子也进一步影响造血过程,促进疾病的发展。研究表明,哺乳动物雷帕霉素靶蛋白(mTOR)在MSCs的成脂分化中起重要作用,mTOR特异性阻断剂可扩增Treg细胞,使T细胞分化偏离促炎性Th1和Th17亚群,从免疫和代谢两方面调节骨髓功能,从而起到治疗AA的作用[19]。Li等[20]在AA动物模型中发现了高浓度的PI3K、p-Akt、p-NF-α、TNF-α等蛋白,表明PI3K/Akt/NF-κB信号通路活跃,应用中药组方可以调控Akt和NF-κB磷酸化,达到缓解AA患者骨髓抑制的效果。
目前临床上针对AA的治疗方案主要为免疫抑制治疗和造血干细胞移植,可使60%~80%的患者完全或部分恢复自身造血。IST治疗虽可使部分AA患者获益,但患者恢复自身骨髓造血时间较长,复发和晚期克隆性造血的概率增加,且尚未有药物针对骨髓过度脂肪化这一共有现象进行治疗。因此,本研究使用EpiMed表观精准治疗预测平台对疾病-药物进行了关联分析,筛选得到包括环孢素A、吗替麦考酚酯、雷帕霉素、二甲双胍、白藜芦醇、姜黄素等在内的系列药物。吗替麦考酚酯和他克莫司被广泛应用于异体骨髓移植及实体器官移植后的患者,可以通过下调钙调神经磷酸酶来抑制T细胞活化,从而预防移植物抗宿主或急性排斥反应。Martynova等[21]对21例AA患者应用ATG联合他克莫司治疗发现,在12个月时有14例(66.7%)患者获得血液学反应。雷帕霉素通过抑制mTOR信号通路抑制T细胞的增殖和线粒体代谢,阻滞细胞由G0期进入G1期,并通过AA小鼠的动物模型进行验证,为临床治疗提供了新思路[22]。二甲双胍作为治疗糖尿病的主要药物,具有不良反应少、价廉以及疗效确切等优点。近年研究发现,二甲双胍除降糖外,还发挥调控细胞分化、抗肿瘤、抑制血管病变、抗衰老等作用,其机制可能在于调节过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor-γ,PPARγ)和C/EBPα家族的活性从而抑制骨髓内间充质干细胞向脂肪细胞分化,同时对异常的T细胞功能进行调节,刺激多能造血干细胞生长,从而间接发挥造血支持作用,这也验证了本研究结果的可靠性。同时,本课题组通过临床试验发现,二甲双胍联合环孢素等药物治疗rAA具有一定的疗效,40例患者在治疗后1、3、6、12个月分别有70%、70%、80%、88%的患者获得血液学反应,且中位血红蛋白浓度、中性粒细胞计数和血小板计数相对于基线明显增加,患者摆脱输血依赖,与既往研究中CsA联合ATG并添加第3种免疫抑制剂或生长因子对rAA患者的疗效相比,总缓解率有所增加。虽本研究在原有研究基础上扩大了样本量,但样本量总数尚不足,盐酸二甲双胍对AA确切的远期疗效尚需未来开展更大规模的临床试验加以进一步证实。
miRNA作为表观遗传学的重要组成部分,其在AA的发病过程中起着重要作用,AA中miRNA与mRNA之间的调控关系并非是简单的线性调控,而是错综复杂的网络调控,仍需进一步研究揭示表观遗传学在AA中的具体机制。本研究为miRNA在调控AA发病过程中的作用以及靶向治疗提供了新思路并预测得到包括雷帕霉素、二甲双胍等在内的对AA可能具有治疗效果的药物。因AA的发病率低,现有的骨髓样本较少,后续仍需进一步扩大样本量验证骨髓T细胞中的miRNA-mRNA网络及其生物学功能,为AA的治疗提供理论依据。
