AEG-1对裸鼠肝癌模型中肝癌细胞生长及肺转移的影响*
2023-06-25周珍珍
刘 谨, 周珍珍
1华中科技大学同济医学院附属同济医院消化内科,武汉 430030 2河南省人民医院消化内科,郑州 450003
原发性肝癌(简称肝癌)是中国常见高发的恶性肿瘤之一,而肝癌细胞的血行播散侵袭转移是造成患者死亡的主要原因[1-2]。肺转移是肝细胞癌最常见的血行转移器官[3-4],是肝癌研究的难点[5]。新近研究表明,编码“肺归巢域”蛋白基因AEG-1(astrocyte elevated gene 1)在细胞恶性转化、肿瘤转移播散等方面发挥重要作用[6-8]。我们的前期研究[9]发现高表达AEG-1的肝癌细胞更易向人肺微血管内皮细胞趋化,提示AEG-1可能与肝癌定向肺转移相关。为了证实AEG-1在肝癌中的作用,我们构建稳定过表达AEG-1肝癌细胞株SMMC-7721-AEG-1-L及过表达对照SMMC-7721-control-L,稳定沉默AEG-1肝癌细胞株SMMC-7721-shAEG-1-P及沉默对照SMMC-7721-control-P,并使用上述细胞株建立裸鼠肝癌模型;建立上述4种肝癌细胞株的皮下移植瘤裸鼠模型,观察过表达或沉默AEG-1基因对肝癌细胞生长和发展的作用;建立肝癌原位移植瘤模型和血行播散模型,并用小动物活体成像系统进行监测,研究过表达或沉默AEG-1基因在肝癌定向肺转移中所起的作用。
1 材料与方法
1.1 细胞培养
以在吉凯基因所购得的慢病毒包装AEG-1(cDNA NM_178812)高表达基因编码序列,转染肝癌细胞株SMMC-7721,获得AEG-1基因过表达细胞株(SMMC-7721-AEG-1-L);包装无任何目的的基因序列pEGFP-N1-3 FLAG,转染获得过表达对照细胞株(SMMC-7721-control-L);质粒转染构建的稳定SMMC-7721细胞株:转染含有靶向AEG-1的shRNA(shRNA序列:5′-GCTGACTGATTCTGGTTCAT-3′)质粒获得沉默AEG-1细胞株(SMMC-7721-shAEG-1-P)和转染无任何靶向shRNA pGCSi-H1/Neo,获得沉默对照细胞株(SMMC-7721-control-P);随后使用荧光素酶基因慢病毒包装颗粒感染上述4种稳定转染细胞株。以上细胞株均由华中科技大学附属同济医院肝病研究所提供,细胞培养方法详见文献[9]。
1.2 实验动物
裸鼠购于北京华阜康生物科技有限公司,品系Balb/c nu/nu,SPF级,雄性,3~4周龄。实验过程中对裸鼠的处置符合中华人民共和国科学技术委员会颁布的《实验动物管理条例》的规定。60只裸鼠分组情况如表1。

表1 60只Balb/c nu/nu裸鼠随机分为4组(n)Table 1 Sixty Balb/c nu/nu nude mice were randomly divided into 4 groups (n)
1.2.1 建立人肝癌细胞SMMC-7721裸鼠皮下移植瘤模型 当上述4组细胞生长状态良好且呈对数生长时,用0.25%胰酶和0.02%EDTA消化细胞,并用吸管吹打,用培养液将消化下来的细胞重新悬浮成单细胞悬液并计数,80×g离心10 min后,弃上清液,随后用0.9%的生理盐水吹打,制备单细胞悬液。各组取裸鼠5只,按5×106细胞/0.2 mL剂量接种于裸鼠右肩胛皮下(具体操作参照文献[10-12])。注射后每天观察肿瘤形成及有无红肿、溃破。
1.2.2 建立肝癌原位移植瘤模型 无菌条件下,分别取上述4组皮下移植瘤小鼠各1只,取瘤后处死。选择活力好的瘤组织浸入无菌生理盐水中漂洗,并切成1 mm×1 mm×1 mm组织块待用;用氯氨酮及地西泮稀释后麻醉裸鼠,沿右侧季肋部横向切口,分离腹肌,暴露肝右叶,剪开肝叶,用3个0的可吸收缝线将1块移植瘤组织缝入肝脏,用明胶海绵填压止血,逐层关腹(具体操作参照文献[13])。
1.2.3 建立肝癌血行播散模型 按照1.2.1方法准备各组肝癌细胞,用手捏住裸鼠尾巴选择两侧静脉血管用胰岛素注射器吸取细胞悬液100 μL缓慢注射,拔出针后用棉签按住注射部位以免细胞悬液流出(具体操作参照文献[3-4])。
1.2.4 动物活体成像 荧光素钾/镁盐(激活荧光素酶的底物)的配制:室温溶解荧光素于DPBS(不含镁离子和钙离子)中使终浓度为15 mg/mL;在超净台内,先将0.22 μm滤膜过滤器用5~10 mL无菌水过滤并将水丢弃;然后过滤灭菌溶解充分的荧光素溶液,并用1.5 mL EP管分装,避光冻存-20℃备用。
从动物房取出实验动物,尽量保证其处于无菌环境。成像前将超净台及房间进行紫外照射30 min;1%戊巴比妥钠溶液麻醉实验动物,待动物麻醉后再行腹腔注射荧光素;每个小鼠注射10 μL/g荧光素储存液,5~10 min后用活体成像系统进行成像。
1.2.5 裸鼠的处死与苏木精-伊红(HE)染色 术后继续饲养,观察裸鼠的生长情况,如体重增减,活动程度的变化以及对外界刺激的反应情况等,观察裸鼠生长35 d后处死动物,无菌条件下,对鼠进行系统解剖,并观察肝癌在肝内和肺部的转移情况,同时收集裸鼠全部肺组织、肝脏组织,进行固定、切片、免疫组化染色观察组织成瘤情况,记录肿瘤大小、称取瘤重。组织包埋及HE染色由武汉百奥斯生物科技有限公司制作。
1.3 实时定量PCR检测
运用Trizol(Invitrogen公司)法提取细胞的总RNA,反转录合成cDNA。采用一步法试剂盒进行荧光定量PCR,检测AEG-1和β-actin的相对表达量,引物序列分别为:AEG-1,正向:5′-TGTTGAAGTGGCTGAGGG-3′,反向:5′-CAGGAAATGATGCGGTTG-3′;β-actin,正向:5′-GTTGCGTTACACCCTTTCTTG-3′,反向:5′-GACTGCTGTCACCTTCACCGT-3′。
1.4 Western blot检测
配制胞核蛋白裂解液,buffer A:10 mmol/L HEPES-KOH(pH=7.9),1.5 mmol/L MgCl2,10 mmol/L KCl,0.5 mmol/L DTT,0.2 mmol/L PMSF,1 μg/mL亮肽素;buffer B:20 mmol/L HEPES-KOH(pH7.9),25%甘油,1.5 mmol/L MgCl2,420 mmol/L NaCl,0.2 mmol/L EDTA,0.5 mmol/L DTT,0.2 mmol/L PMSF,1 μg/mL亮肽素(Ferments公司)。用核蛋白裂解液抽提转染细胞的总蛋白,测定蛋白提取液浓度,-70℃保存备用。取总蛋白50 μg与上样缓冲液充分混匀,100 ℃水浴10 min变性后上样。12% SDS-PACE凝胶行电泳分离后,转印至PVDF膜。5%脱脂奶粉室温封闭1 h,加兔抗人AEG-1一抗(Abcam公司,1 ∶1000)4℃孵育过夜,TBST液漂洗,加Cy3标记的羊抗兔IgG二抗(武汉博士德公司,1 ∶4000)室温孵育30 min,TBST液漂洗。ECL试剂(Pierce公司)显色,曝光,显影,定影,用X线胶片拍照保存。Image J图像分析软件测定条带的灰度值,以与内参β-actin蛋白灰度值的比值表示蛋白质的相对表达量。
1.5 统计学方法
应用SPSS 17.0软件进行统计学分析,计量资料以均数±标准差表示,两组间均数的比较采用t检验,多组间均数的比较采用方差分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 实时定量PCR及Western blot检测SMMC-7721肝癌细胞株AEG-1 mRNA及蛋白表达
应用实时定量PCR检测SMMC-7721肝癌细胞株AEG-1 mRNA表达情况,结果显示:SMMC-7721-AEG-1-L、SMMC-7721-control-L肝癌细胞株AEG-1 mRNA表达量分别为[(4.58±0.32)vs.(0.86±0.05),P<0.05];SMMC-7721-shAEG-1-P、SMMC-7721-control-P肝癌细胞株AEG-1 mRNA表达量分别为[(0.80±0.07)vs.(2.61±0.13),P<0.05]。不同组别肝癌细胞AEG-1 mRNA表达情况见图1A。
应用Western blot检测SMMC-7721肝癌细胞株AEG-1蛋白表达情况,结果显示:SMMC-7721-AEG-1-L、SMMC-7721-control-L肝癌细胞株AEG-1蛋白表达量分别为[(0.517±0.009)vs.(0.232±0.004),P<0.05];SMMC-7721-shAEG-1-P、SMMC-7721-control-P肝癌细胞株AEG-1蛋白表达量分别为[(0.272±0.007)vs.(0.582±0.004),P<0.05]。不同组别肝癌细胞AEG-1蛋白表达情况,见图1B、1C。

1:SMMC-7721-AEG-1-L;2:SMMC-7721-control-L;3:SMMC-7721-shAEG-1-P;4:SMMC-7721-control-P;A:AEG-1 mRNA表达情况;B~C:AEG-1蛋白表达情况;与SMMC-7721-control-L组比较,*P<0.05;与SMMC-7721-control-P组比较,#P<0.05图1 实时荧光定量PCR及Western blot检测SMMC-7721细胞株转染情况Fig.1 The transfection of SMMC-7721 cell line was detected by real-time quantitative PCR and Western blotting
2.2 AEG-1调控肝癌细胞的生长
裸鼠皮下移植瘤模型,皮下接种SMMC-7721-AEG-1-L和SMMC-7721-control-L细胞2 d内接种部位皮丘完全消失,3~5 d接种部位见突出于皮肤表面的实性瘤结节,成瘤率为100%(图2A、2B)。肿瘤体积测量显示,SMMC-7721-AEG-1-L组肿瘤体积大且生长迅速,在第10天出现生长高峰,SMMC-7721-control-L瘤体小且生长速度缓慢,组中有1肿瘤体积明显较小,注射肝癌细胞10 d后瘤块消失,至第20天再次出现。造成这一现象的原因可能与肝癌细胞皮下注射部位缺少血供,以及裸鼠本身免疫功能未完全敲除有关。SMMC-7721-shAEG-1-P和SMMC-7721-control-P细胞2 d内接种部位皮丘完全消失,第5天接种部位见突出于皮肤表面的实性瘤结节,成瘤率为100%(图2C、2D)。在第25天和第30天的测量中,SMMC-7721-AEG-1-L组肿瘤体积均显著高于SMMC-7721-control-L组(均P<0.05,图3A)。而SMMC-7721-shAEG-1-P组、SMMC-7721-control-P组裸鼠肿瘤体积在6次测量中均无显著差异(均P>0.05,图3B)。30 d后部分体积较大的肿瘤侵袭皮肤出现破溃。

A:SMMC-7721-AEG-1-L组;B:SMMC-7721-control-L组;C:SMMC-7721-shAEG-1-P组;D:SMMC-7721-control-P组图2 裸鼠肝癌模型的皮下剥离肿瘤Fig.2 Subcutaneous tumors in nude mice hepatoma model
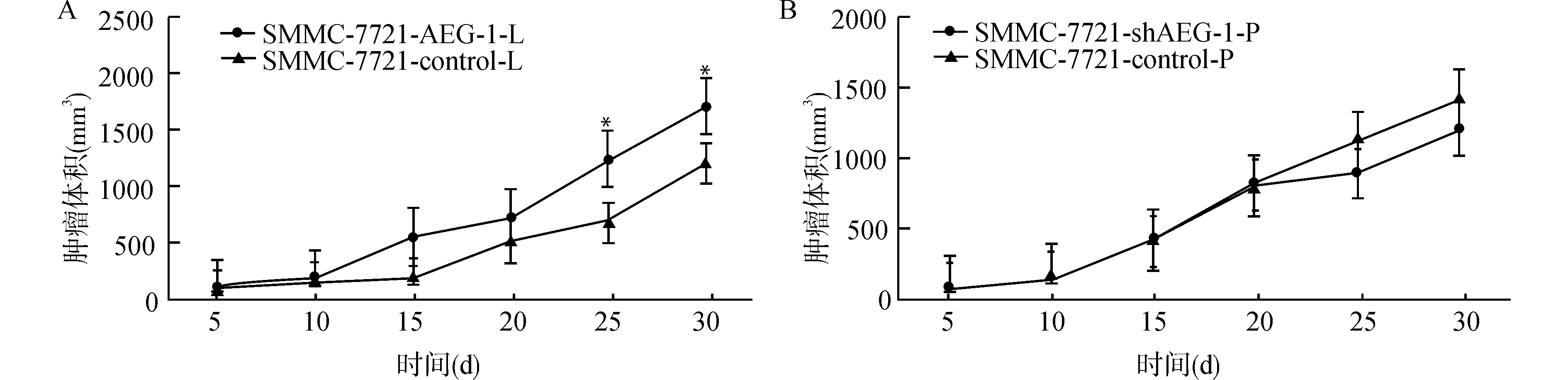
与SMMC-7721-control-L组比较,*P<0.05图3 裸鼠肝癌模型中皮下移植瘤模型瘤体生长曲线Fig.3 Tumor growth curve of subcutaneous xenograft tumor model in nude mice
2.3 AEG-1与肝癌细胞肝内转移
处死皮下移植瘤裸鼠,取出肝脏组织肉眼进行观察,SMMC-7721-AEG-1-L组肝脏表面密布破溃出血点,SMMC-7721-control-L组未见异常。SMMC-7721-shAEG-1-P组以及SMMC-7721-control-P组肝脏均有转移灶(图4)。随机取一处肝脏组织做石蜡包埋,HE染色组织学检查发现:SMMC-7721-AEG-1-L组裸鼠肝脏组织出现弥漫性侵犯转移灶,SMMC-7721-control-L组见小范围炎症出现。SMMC-7721-shAEG-1-P与SMMC-7721-control-P组肝脏亦可见侵袭转移灶(图5)。肝内原位移植术后7 d进行裸鼠活体成像证实手术移植成功率为100%。第35天再次进行裸鼠活体成像,结果显示:与SMMC-7721-control-L组相比,SMMC-7721-AEG-1-L组出现明显肝内侵袭转移,发光面积和强度均显著增加;SMMC-7721-shAEG-1-P组肿瘤发光面积较小且发光强度明显降低,色阶比对小于SMMC-7721-control-P组的10%~20%(图6)。术后35天处死肝内原位移植瘤模型裸鼠,各组随机选择一只裸鼠取肝脏,进行石蜡包埋,光学显微镜组织学检测肝内包埋瘤体长径和转移灶数量:SMMC-7721-AEG-1-L组447.58 μm,转移灶数量为11个,SMMC-7721-control-L组451.58 μm,肝内转移灶数量为9个;SMMC-7721-shAEG-1-P组69.98 μm,转移灶为6个;SMMC-7721-control-P组391.41 μm,转移灶为9个。组间比较显示,SMMC-7721-AEG-1-L组和SMMC-7721-control-L组存在显著差异;SMMC-7721-shAEG-1-P组的肿瘤大小及转移灶数量明显低于SMMC-7721-control-P组,见图7。

A:SMMC-7721-AEG-1-L组;B:SMMC-7721-control-L组;C:SMMC-7721-shAEG-1-P组;D:SMMC-7721-control-P组图4 肝癌细胞皮下移植瘤裸鼠肝脏改变Fig.4 Liver changes in nude mice with subcutaneous xenograft of hepatoma cells
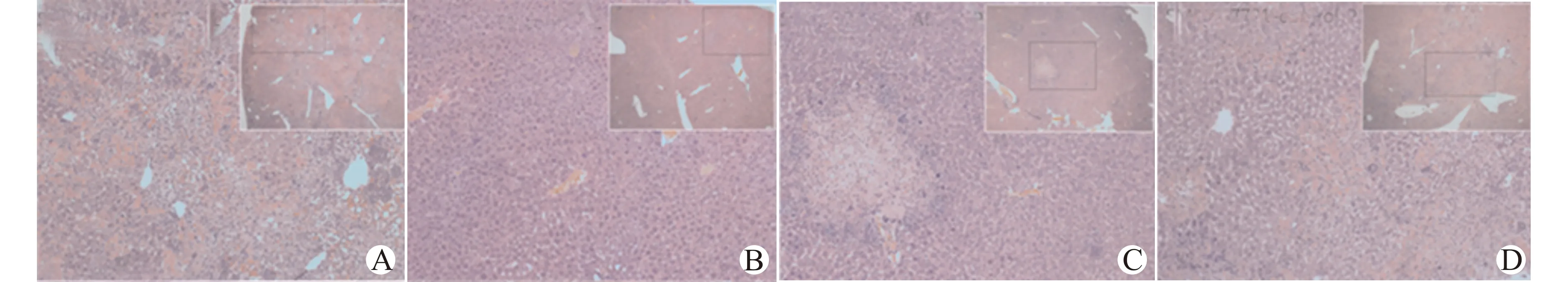
A:SMMC-7721-AEG-1-L组;B:SMMC-7721-control-L组;C:SMMC-7721-shAEG-1-P组;D:SMMC-7721-control-P组;放大倍数×100,右上小窗×40图5 皮下移植瘤模型肝癌细胞的肝内转移(HE染色)Fig.5 Intrahepatic metastasis of hepatoma cells in subcutaneous xenograft tumor model (HE staining)
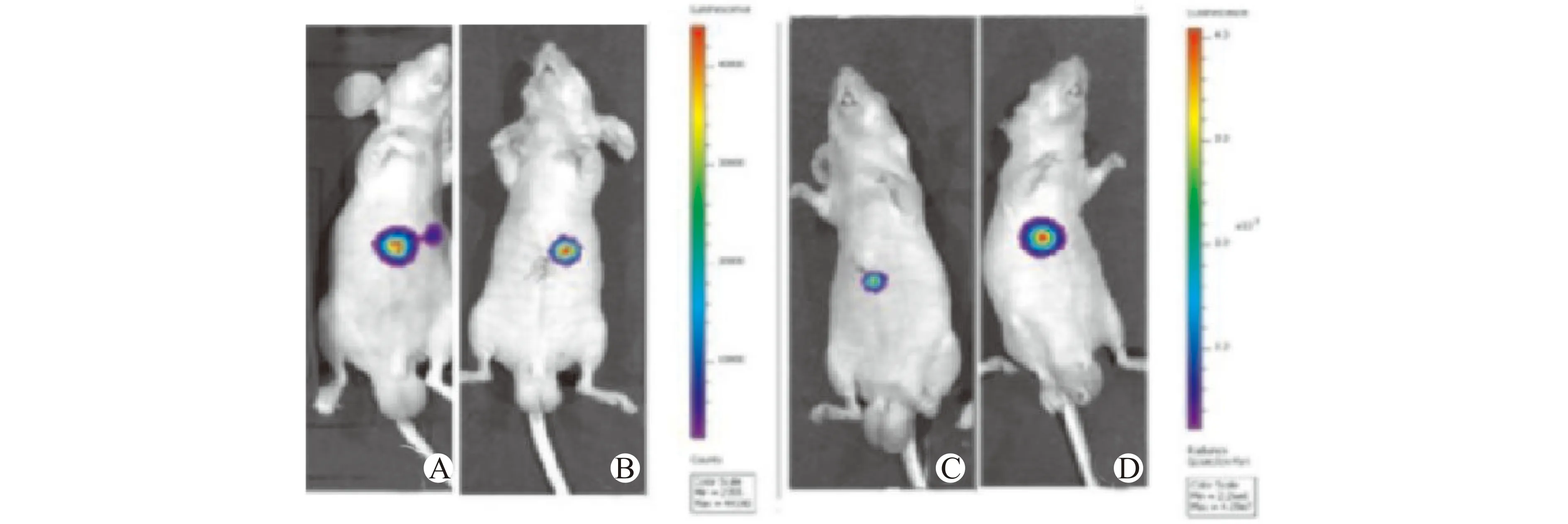
A:SMMC-7721-AEG-1-L组;B:SMMC-7721-control-L组;C:SMMC-7721-shAEG-1-P组;D:SMMC-7721-control-P组;比色条代表发光强度,从红色至紫色发光强度逐渐降低图6 肝癌原位移植瘤模型活体成像Fig.6 In vivo imaging of orthotopic xenograft tumor model

A:SMMC-7721-AEG-1-L组;B:SMMC-7721-control-L组;C:SMMC-7721-shAEG-1-P组;D:SMMC-7721-control-P组;放大倍数×100,左上小窗×40图7 原位移植瘤模型原位肝癌及肝内转移灶(HE染色)Fig.7 Liver cancer in situ and intrahepatic metastasis foci of orthotopic xenograft tumor model (HE staining)
2.4 AEG-1与肝癌细胞肺转移
肉眼观察皮下移植瘤模型肺组织均无异常表现;HE染色组织学检查发现,SMMC-7721-AEG-1-L组存在2个肺转移灶,SMMC-7721-control-L组未见肺部转移灶;SMMC-7721-shAEG-1-P组未见肺转移灶,SMMC-7721-control-P组肺部有1处转移灶(图8)。肝内原位移植瘤裸鼠活体成像中均未看到肺部出现发光(图6);但是光学显微镜组织学检查发现,SMMC-7721-AEG-1-L组、SMMC-7721-control-L组肺部转移灶分别为3个、1个;SMMC-7721-shAEG-1-P组未发现肺部转移灶,SMMC-7721-control-P组肺部存在2个转移灶(图9)。
裸鼠肝癌细胞血行播散模型,以每只5×106的细胞数尾静脉注射SMMC-7721-AEG-1-L、SMMC-7721-control-L、SMMC-7721-shAEG-1-P和SMMC-7721-control-P肝癌细胞。尾静脉注射35 d后活体成像未观测到肺部发光转移灶,第60天后再次行活体成像发现肺转移率分别是:SMMC-7721-AEG-1-L组60%、SMMC-7721-control-L组20%;SMMC-7721-shAEG-1-P组20%、SMMC-7721-control-P组60%。图10显示各组典型肺部转移结果,SMMC-7721-AEG-1-L组的肺右上叶和左侧三叶出现大片发光癌灶,SMMC-7721-control-L组大约在右肺门的位置检测到1处发光癌灶;SMMC-7721-shAEG-1-P组在左肺下叶有1处发光癌灶,SMMC-7721-control-P组全肺出现弥散性癌灶。裸鼠于尾静脉注射后的60 d给予处死,取肺组织。肉眼可见SMMC-7721-control-P组裸鼠肺表面有满肺转移微小点状癌灶,其余3组肺表面未见异常。取部分肺组织石蜡包埋HE染色,光学显微镜下进行观测:SMMC-7721-AEG-1-L组转移灶有18个,SMMC-7721-control-L组有3个转移灶;SMMC-7721-shAEG-1-P组转移灶为5个,SMMC-7721-control-P组转移灶有23个(图11)。
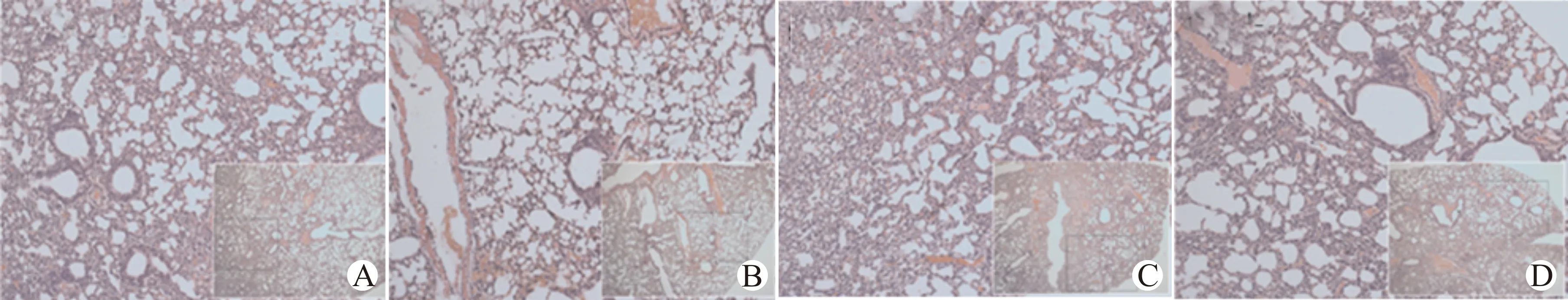
A:SMMC-7721-AEG-1-L组;B:SMMC-7721-control-L组;C:SMMC-7721-shAEG-1-P组;D:SMMC-7721-control-P组;放大倍数×100,右下小窗×40图8 肝癌皮下移植瘤模型肺转移(HE染色)Fig.8 Lung metastasis of liver cancer in subcutaneous xenograft tumor model (HE staining)

A:SMMC-7721-AEG-1-L组;B:SMMC-7721-control-L组;C:SMMC-7721-shAEG-1-P组;D:SMMC-7721-control-P组;放大倍数×100,左上小窗×40图9 肝癌原位移植瘤模型肺转移(HE染色)Fig.9 Lung metastasis of liver cancer in orthotopic xenograft tumor model (HE staining)

A:SMMC-7721-AEG-1-L组;B:SMMC-7721-control-L组;C:SMMC-7721-shAEG-1-P组;D:SMMC-7721-control-P组;比色条代表发光强度,从红色至紫色发光强度逐渐降低图10 裸鼠肝癌细胞血行播散模型肺转移活体成像Fig.10 In vivo imaging of lung metastasis in hematogenous spread model of nude mice

A:SMMC-7721-AEG-1-L组;B:SMMC-7721-control-L组;C:SMMC-7721-shAEG-1-P组;D:SMMC-7721-control-P组图11 血行播散模型肝癌细胞肺转移(HE染色)Fig.11 Lung metastasis of hepatoma cells in hematogenous spread model (HE staining)
3 讨论
肝癌是临床上常见的恶性肿瘤之一,其发病率逐年上升,病死率居我国恶性肿瘤的第2位,死亡原因大多与侵袭转移有关[1-2]。因此,有效地减少或阻断肝癌细胞的转移是当前研究的重点之一。
原发性肝癌的远处转移多以血行播撒为主,尤以肺转移最为常见[5]。研究表明循环肿瘤细胞从原发部位肿瘤组织脱落进入血流,启动远端转移过程,而循环肿瘤细胞向靶器官微血管内皮细胞趋化是前期准备和必要条件[14-17]。我们前期研究[18]观察到,在Transwell小室下层铺有一层人肺微血管内皮细胞(HPMECs)及人脐静脉微血管内皮细胞(HUVECs),发现肝癌细胞株更易向铺有HPMECs的小室趋化。这一实验提示,肝癌细胞转移可能更易向肺转移。那么,是什么因素调控了肝癌细胞向肺微血管内皮细胞趋化呢?
研究表明,AEG-1基因在多种肿瘤中高表达,如非小细胞性肺癌、乳腺癌、结肠癌、食管癌、宫颈癌、头颈部鳞状细胞癌等[19-20],AEG-1基因的高表达与肿瘤细胞增殖、凋亡、耐药等密切相关[7,21-23],这些研究表明,AEG-1在肿瘤的发生发展、侵袭转移中起重要作用。在体内实验中[24-25],使用裸鼠异种移植模型,人类肝癌细胞中AEG-1的过表达导致形成了具高度侵袭性、血管生成性和转移性的肿瘤,而AEG-1的表达抑制减缓了肝癌的发展。我们前期研究发现[26],抑制肝癌细胞AEG-1可影响骨架蛋白F-actin表达,肝癌细胞骨架重排,有可能减少肝癌侵袭转移。AEG-1在癌症的炎症机制中起关键的作用,有研究发现AEG-1可通过NF-κB的活化促进肝癌发展。
本研究小组[27-28]及近期研究[29]显示,AEG-1与肝脏炎症密切相关。本研究在皮下移植瘤、原位移植瘤模型中观察到AEG-1高表达可增加肝内转移的同时伴有肝脏的炎症浸润。而AEG-1在人类炎症及纤维化发生等多条信号转导通路中发挥重要作用[30-32],可调控PI3K/Akt、p38 MAPK、ERK等通路,我们在后期的分子研究中可检测相关信号通路的变化,为进一步研究肝癌侵袭转移提供实验依据。
本研究选择低侵袭性成瘤率较高的SMMC-7721肝癌细胞构建AEG-1过表达或沉默的SMMC-7721肝癌细胞株,而后使用荧光素酶基因慢病毒载体转染上述肝癌细胞用于动物活体成像[33]。本研究建立皮下移植瘤模型测量皮下肿瘤体积[34],观测AEG-1过表达/沉默与肿瘤生长的关系。结果显示SMMC-7721-AEG-1-L组的肿瘤体积和生长速度显著增加。
肝内原位移植瘤模型[10-12]模拟人原发肝细胞癌,使用较为直观的动物活体成像的方法来检测原发肝癌中AEG-1基因表达在肿瘤肝内转移中所起的作用。原位移植瘤模型中,SMMC-7721-AEG-1-L组肝内有明显发光转移灶,SMMC-7721-shAEG-1-P组的肝脏肿瘤发光范围较小且没有发光转移灶。
血行播散裸鼠模型的活体成像结果显示AEG-1过表达导致肺转移灶发光范围及强度显著增加。相反,沉默AEG-1则导致肺转移灶发光范围及强度显著降低,本研究结果与Bhatnagar等[35]在前列腺癌中的研究结果一致。HE染色检测裸鼠血行播散模型的肺转移结果显示,AEG-1过表达/沉默导致肺转移灶数量显著增多/减少。以上研究结果与头颈部鳞状细胞癌中的研究一致[36],表明AEG-1高表达具有促进肝癌细胞肺转移的作用。
综上所述,AEG-1基因过表达具有促进肝癌的生长以及肝内、肝外侵袭转移的作用,反之沉默AEG-1基因则可以抑制肝癌细胞的生长和肺转移。本研究为进一步探讨肝癌肺转移定向趋化的分子机制奠定了实验基础。
