临床特征及术前检验结果在低级别软骨肉瘤和内生软骨瘤鉴别中的作用*
2023-06-25刘起昆于小钧李孟伟李志伟蒋咏桥
刘起昆, 于小钧, 李孟伟, 李志伟, 蒋咏桥, 康 皓
华中科技大学同济医学院附属同济医院骨科,武汉 430030
中心型软骨肉瘤是最常见的恶性软骨性肿瘤,约占恶性骨肿瘤的20%,其中约70%为低级别软骨肉瘤[1];内生软骨瘤是第2常见的原发性良性透明软骨性肿瘤,占原发骨肿瘤的12%~24%,90%为单发且大部分无症状[2]。低级别软骨肉瘤和内生软骨瘤的鉴别诊断比较困难,尤其是位于长骨部位的病变,两者具有相似的影像学和组织细胞学特征[3]。低级别软骨肉瘤和内生软骨瘤因肿瘤性质不同,手术方式和患者术后管理完全不同。前者多进行瘤段切除,而后者一般行刮除植骨或密切随访治疗[1]。因此,准确诊断肿瘤类型对患者的治疗和预后具有重要意义。研究表明,炎症反应在肿瘤的发生发展中起着重要作用[4]。最近,有研究发现术前血液炎性指标与骨/软组织肿瘤预后及分级相关[5-6]。基于这些研究结果,我们推测术前血液学检测指标如中性粒细胞数、单核细胞数、C-反应蛋白、碱性磷酸酶、白/球蛋白及各种指标间的比值等可能对低级别软骨肉瘤和内生软骨瘤的鉴别有潜在的诊断价值。本文通过分析低级别软骨肉瘤与内生软骨瘤患者术前血液学检测指标的结果,明确术前临床及检查指标是否有助于两者的鉴别。
1 资料与方法
1.1 病例资料
收集2015年1月至2020年12月于我院行软骨肉瘤和内生软骨瘤手术治疗的患者资料,所有病例均经2名病理医生复核确诊,所有病理诊断为高分化或者Ⅰ级软骨肉瘤的病例归类为低级别软骨肉瘤。最后,共获得105例内生软骨瘤和42例低级别软骨肉瘤病例资料。收集的患者临床指标包括:患者年龄、性别、病程、肿瘤部位及最长直径、中性粒细胞数(N,109/L)、单核细胞数(M,109/L)、淋巴细胞数(L,109/L)、血小板计数(PLT,1012/L)、白蛋白和球蛋白浓度(A/G,g/L)、碱性磷酸酶浓度(ALP,U/L)、乳酸脱氢酶浓度(LDH,U/L)、γ-谷氨酰肽转移酶浓度(γ-GT,U/L)、凝血酶原时间(PT,s)。病例纳入条件及标准:①入院前无癌症病史;②无急/慢性炎症、无风湿及自身免疫性疾病、无血液系统疾病;③无抗炎、非甾体药物及免疫抑制剂治疗;④血液学检查结果均为有创治疗术前的检查结果。
1.2 统计学方法
采用SPSS 22.0、Graphpad prism 8.0和R软件(版本3.6.0)进行数据处理和统计学分析。计算中性粒与淋巴细胞比值(NLR)、淋巴细胞与单核细胞比值(LMR)、血小板与淋巴细胞数比值(PLR)、白蛋白与球蛋白比值(AGR)。连续型变量用中位数(M)和四分位数(P25,P75)表示,分类变量用频率和百分比表示。对于非配对数据通过Mann-Whitney’sU检验来评估组间差异,Spearman相关系数用于明确变量间的关系。ROC曲线分析用于明确临床及术前检查指标对两种肿瘤的鉴别有效性及最佳截断值。首先进行单因素Logistic回归分析明确与肿瘤性质相关的变量,如果P值小于0.05则进一步纳入多因素Logistic回归分析,结果以比值比(OR)和95%置信区间(CI)表示,P值小于0.05考虑为肿瘤性质关联的独立危险因素并纳入Nomogram模型构建。所有检验均为双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 低级别软骨肉瘤和内生软骨瘤患者术前各项指标比较
本研究共纳入105例内生软骨瘤和42例低级别软骨肉瘤病例。结果如表1所示,在患者年龄、病程、肿瘤大小、NLR、LMR、AGR和ALP这7项指标上两组均存在显著差异。低级别软骨肉瘤患者的年龄、病程、肿瘤大小的中位数及四分位数分别为51.5(29.3~59.5)岁、8(1~24)个月、9.4(8.0~12.5)cm;而内生软骨瘤患者分别为43.0(26.0~52.0)岁、3(1~12)个月、2.7(2.0~4.5)cm;前者的发病年龄、病程及肿瘤大小均明显大于后者。此外,如图1所示,低级别软骨肉瘤患者的NLR、ALP值明显高于内生软骨瘤患者,而LMR和AGR值则显著低于后者。
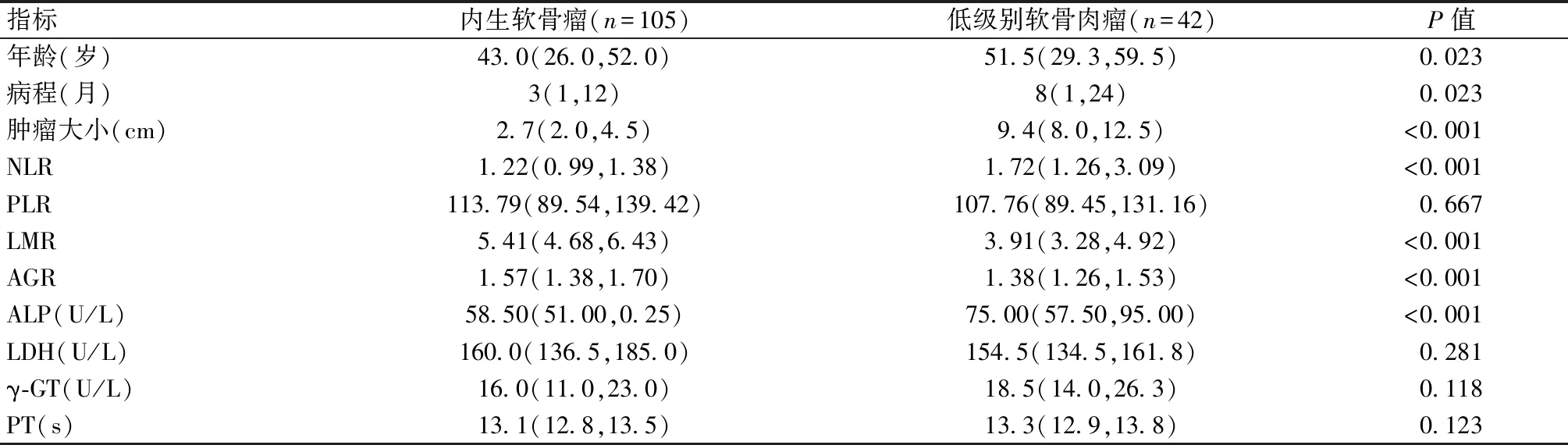
表1 内生软骨瘤和低级别软骨肉瘤患者的临床特征和术前检查结果比较[M(P25,P75)]Table 1 Comparison of clinical features and preoperative laboratory results between patients with enchondroma and low-grade chondrosarcoma[M(P25,P75)]
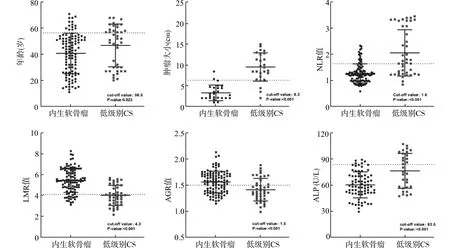
图1 低级别软骨肉瘤和内生软骨瘤患者的临床特征和术前血液检验指标比较Fig.1 Comparison of clinical features and preoperative blood test indicators between low-grade chondrosarcoma and enchondroma patients
2.2 患者的临床特征及术前检验结果与肿瘤性质的相关性
Spearman相关性检验的结果如表2所示,患者年龄、肿瘤大小、NLR值、ALP与低级别软骨肉瘤的诊断呈正相关,而LMR、AGR值与其呈负相关。其中,肿瘤大小、NLR和LMR值与肿瘤性质的相关系数绝对值大于或等于0.4,表明存在中等以上的相关性。
2.3 评估临床特征及术前检查指标对术后肿瘤性质诊断的有效性
ROC曲线分析结果如表3及图2所示,肿瘤大小、NLR、LMR及ALP对应的ROC曲线下面积(AUC)分别为0.93、0.78、0.82、0.72,最佳截断值分别为6.3 cm、1.6、4.3、83.5 U/L,这4项指标对于两种肿瘤的鉴别均具有明显的预测价值(P值均小于0.05且AUC值均大于0.7)。对于满足以下情况之一的患者更倾向于诊断低级别软骨肉瘤:肿瘤最大直径>6.3 cm;NLR>1.6;ALP值>83.5 U/L;LMR<4.3。
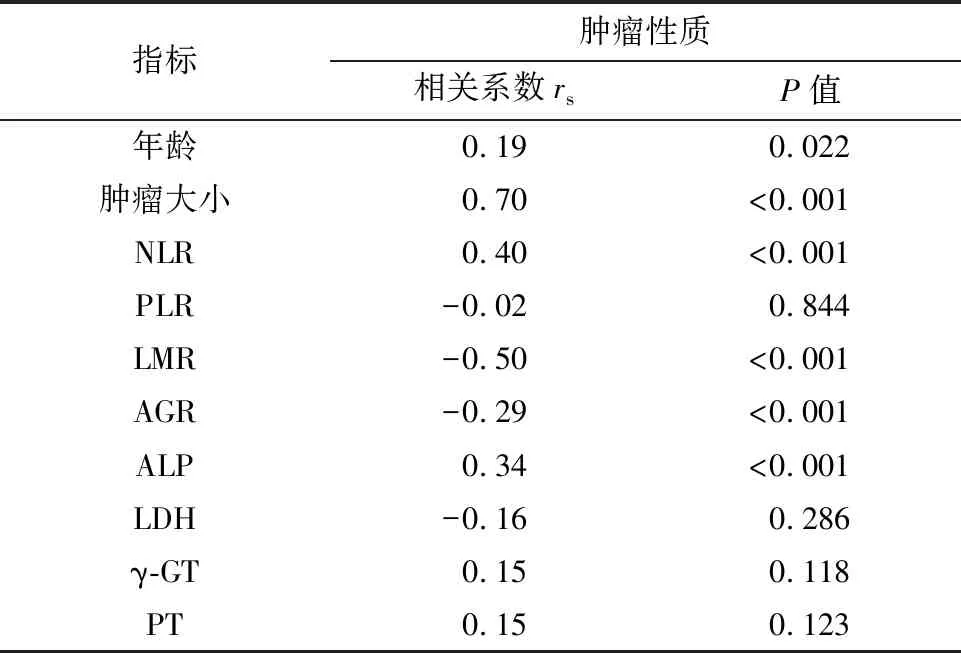
表2 术前各种指标与术后肿瘤性质的相关性Table 2 Correlation between preoperative indicators and postoperative tumor malignancy
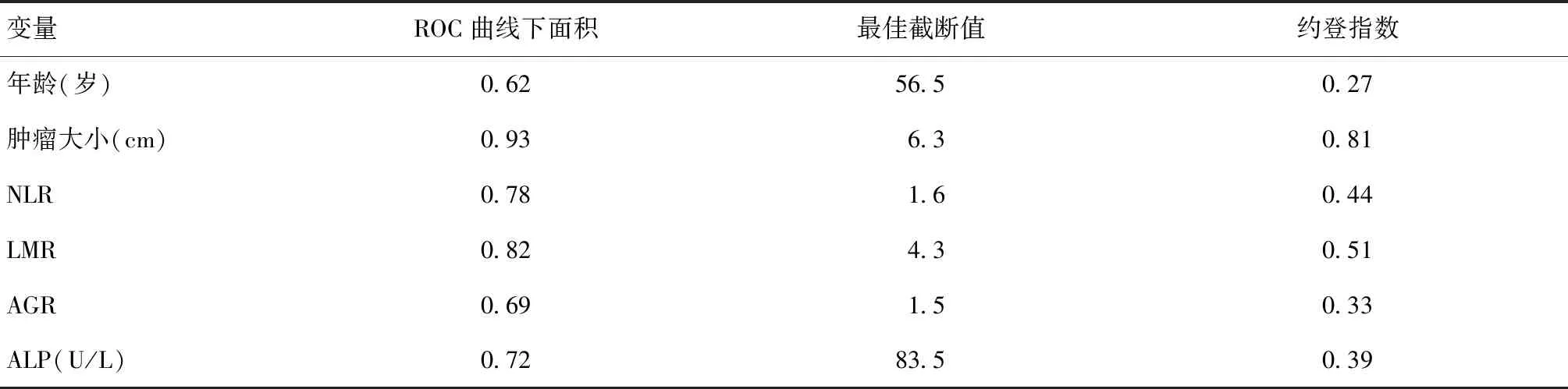
表3 每个变量对应的ROC曲线下面积,最佳截断值和约登指数Table 3 Area under the ROC curve,optimal cut-off value and Youden index for each variable
2.4 多因素Logistic回归分析及Nomogram模型预测结果
为了排除潜在的混杂因素,我们进一步行多因素Logistic回归分析明确与肿瘤性质相关的独立危险因素。结果显示肿瘤大小、NLR和LMR值对于鉴别内生软骨瘤与低级别软骨肉瘤有较好的帮助(表4)。我们利用这3个显著关联的变量构建出Nomogram预测模型,结果显示该模型能较好地区分肿瘤的性质,其ROC曲线下面积为0.96(图3)。

表4 多因素logistic回归分析结果Table 4 Results of multivariate logistic regression analysis
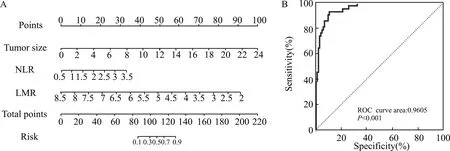
图3 Nomogram预测模型(A)构建鉴别肿瘤性质及ROC曲线分析(B)Fig.3 Nomogram prediction model for tumor malignancy identification(A)and ROC curve analysis(B)
3 讨论
术前准确诊断病变性质对于治疗决策和术后管理至关重要。内生软骨瘤和低级别软骨肉瘤的鉴别已有广泛的研究但诊断依然存在挑战。目前,还没有标准的管理指南可供参考,任何一种评估方法或者技术手段都不能完全准确地区分二者[7]。
最近,很多研究表明术前的检验结果可能对肿瘤的诊断、鉴别及预后有临床价值。Netanyahu等[8]的研究发现,高级别腹膜后肉瘤患者术前的NLR和CRP值较大,且这两个指标与肿瘤的预后相关。我们的结果与之类似,发现低级别软骨肉瘤患者术前的NLR值要显著高于内生软骨瘤患者。一项研究分析了588例原发软组织肿瘤的术前临床特征和实验室检验数据,结果发现临床特征如肿瘤大小和检验指标如CRP、WBC、LDH是软组织肿瘤诊断为肉瘤的重要预测因素,作者建议符合3个及以上预测指标的软组织肿瘤更倾向于肉瘤,患者应到专业的肿瘤中心诊治[9]。炎性检验指标如CRP、NLR及中性粒细胞数也能有效用于子宫平滑肌肉瘤和良性平滑肌瘤的鉴别[10]。此外,术前NLR比值还能用于预测膝关节色素沉着绒毛结节性滑膜炎术后复发的可能性;当术前NLR比值高于2.42时,患者术后更容易出现复发[11]。患者的临床特征及术前检验结果是鉴别低级别软骨肉瘤和内生软骨瘤简单经济、广泛适用的有效手段,是两者鉴别方法的重要补充。
临床及肿瘤学特征在低级别软骨肉瘤和内生软骨瘤间存在一定的异质性。其中,肿瘤生长方式的不同是鉴别两者的重要依据;低级别软骨肉瘤为缓慢浸润性生长,而内生软骨瘤为有限的膨胀性生长[12]。此外,低级别软骨肉瘤多见于中老年,约62%的病例发生于40~60岁;部位多见于软骨成骨活跃的骨端和干骺端,超过2/3位于骨盆、肋骨和肩胛带等躯干部位。内生软骨瘤是常见的软骨源性良性肿瘤,69%的患者年龄在10~20岁间;好发于手、足短管状骨[3]。内生软骨瘤一般无明显症状,如果出现疼痛则需要考虑或者排除软骨肉瘤[13]。
影像学检查是明确肿瘤性质的重要手段和前提。很多关于MRI鉴别内生软骨瘤和低级别软骨肉瘤的研究表明,MRI对于两种肿瘤的鉴别作用还存在争议[14-15]。尽管如此,MRI上肿瘤的一些影像表现依然能为两者的诊断提供线索;如果MRI上出现骨皮质破坏、软组织肿块及肿瘤周围骨髓小片状T1WI低信号、T2WI高信号异常征象多考虑为低级别软骨肉瘤[1];有研究报道,MRI上骨皮质内侧“扇形变”特征的程度对鉴别低级别软骨肉瘤和内生软骨瘤有最高的特异性和敏感性,同时认为动态对比增强MRI对两者的鉴别没有意义[13]。此外,基于MRI的3D组织结构分析可能有助于低级别软骨肉瘤和内生软骨瘤的鉴别[16]。
组织及病理学诊断是目前明确肿瘤性质的重要依据和线索。组织学上,内生软骨瘤主要由界限清楚、灰白色带折光性的透明软骨结节构成,周围被反应性形成骨包围;镜下主要由大量软骨细胞组成,散在分布透明基质钙化灶及坏死的软骨细胞,双核软骨细胞比较少见[2]。低级别软骨肉瘤主要由灰白/灰黄色透亮的大分叶软骨构成伴不同程度黏液样变,骨髓腔完全被浸润的软骨组织取代、宿主板层骨小梁完全被软骨包围[17];周围骨皮质潜在变薄、扇形样改变,部分骨皮质破坏、延伸至周围软组织;镜下由粘液样或透明基质组成,大小不等的肿瘤性软骨细胞散在其中,细胞核小、染色质深染,核无明显异型性。需要指出的是,病理诊断的准确性会受到病理科医生临床经验等主观因素的影响而存在较大的变异性,缺乏客观性和可重复性[2]。
除了以上的这些鉴别要点和方法之外,目前也有少量新的方法和指标得到报道。Helfenstein等[18]认为,微小染色体维持蛋白6(minichromosome maintenance protein 6,MCM6)能有效识别肿瘤细胞的增殖活性,有助于低级别软骨肉瘤和内生软骨瘤的鉴别。生长阻滞和DNA损伤诱导蛋白45β(growth arrest and DNA damage-inducible protein 45β,Gadd45β)是终板形成软骨细胞分化过程中必不可少的分子,可能有助于Ⅰ级软骨肉瘤和内生软骨瘤的鉴别[3]。还有研究表明,基因组学分析可以用于低级别软骨肉瘤和内生软骨瘤的鉴别,内生软骨瘤存在70%的异柠檬酸脱氢酶1(isocitrate dehydrogenase 1,LDH1)或LDH2突变和60%的2型胶原α1(collagen type 2 alpha 1 chain,COL2A1)突变;相反,软骨肉瘤只有20%的IDH1或IDH2突变,100%的COL2A1存在突变[19]。微小RNA可能也可以用于内生软骨瘤与低级别软骨肉瘤的鉴别[20]。
低级别软骨肉瘤和内生软骨瘤的鉴别诊断目前仍然是个挑战,需要骨及软组织肿瘤领域的影像学专家、病理学家及临床医生的共同协作和努力。为避免误诊,临床中对于软骨源性肿瘤的诊断必须结合临床表现、病灶部位、术前辅助检查及病理组织学特征。临床特征和术前检验结果可能对两者的鉴别诊断有一定的帮助。
