禾谷镰孢菌β-1,3-葡聚糖合成酶催化亚基GLS2异源表达体系的建立
2023-06-20延扬帆
延扬帆, 张 峰
(南京农业大学 植物保护学院,南京 210095)
由禾谷镰孢菌Fusarium graminearum引起的赤霉病 (Fusaruim head blight) 是危害我国小麦产量和品质的重要病害[1]。在农业上,禾谷镰孢菌的防治措施主要包括抗性育种[2]、农业防治[3]、生物防治[4]及化学防治[5-8],其中化学防治是目前主要的防治措施。随着病原菌抗药性问题日趋严重[9],挖掘新的杀菌剂蛋白靶标、设计具有新型作用机制的杀菌剂是解决病原菌抗药性的关键手段。
真菌细胞壁是位于质膜外的一种高可塑性骨架,是真菌的特征结构,主要由葡聚糖、几丁质、糖蛋白组成,在细胞中起保护和支持等作用[10],其中β-1,3-葡聚糖是真菌细胞壁中较为丰富的一种多糖。大量的研究结果表明,抑制β-1,3-葡聚糖的合成将导致细胞溶解或形态改变[11-12]。此外,在植物免疫中存在病原体相关分子模式 (pathogenassociated molecular patterns, PAMPs),该模式可以识别病原菌的β-1,3-葡聚糖,从而引起植物的免疫反应[13]。真菌中β-1,3-葡聚糖主要由β-1,3-葡聚糖合成酶 (β-1,3-glucan synthase, GS) 以尿嘧啶二磷酸葡萄糖 (UDP-glucose) 为前体物质合成[14]。该酶由催化亚基和调节亚基组成,分别由FKS和RHO1基因编码[15-18]。其中催化亚基Fksp 为膜蛋白,主要位于细胞膜中[19],调节亚基Rho1p 蛋白为Rho家族蛋白,为三磷酸鸟苷(guanosine triphosphate,GTP)结合蛋白,二磷酸鸟苷(guanosine diphosphate,GDP)和三磷酸鸟苷作为调节因子与 Rho1p 蛋白结合并调节该酶的活性[17]。在酿酒酵母中,β-1,3-葡聚糖合成酶催化亚基由FKS1、FKS2、FKS33 种基因进行编码,FKS1编码的FKS1p 与FKS2编码的FKS2p 存在功能冗余,单独敲除该基因不影响酵母的存活,但双敲除基因会导致酵母死亡[20-21]。此外,其他酵母菌中该酶的催化亚基均由多个基因编码,如在白色念珠菌Candida glabrata、裂殖酵母Schizogenesis pombe中均含有4 个编码基因[22-23]。与酵母菌不同,在许多丝状真菌中,该酶都仅含有一个编码催化亚基的基因,如构巢曲霉Aspergillus nidulans[24]、烟曲霉Aspergillus fumigatus[25]、稻瘟菌Magnaporthe oryzae和茄腐镰刀菌Fusarium solani[26]等。β-1,3-葡聚糖合成酶催化亚基在不同物种中都具有重要生物学功能,如烟曲霉在缺失唯一的β-1,3-葡聚糖合成酶编码基因后仍能存活,但表现出严重的生长缺陷[25];而新生隐球菌缺失该基因就无法存活[27]。禾谷镰孢菌中β-1,3-葡聚糖合成酶仅含有一个催化亚基GLS2,其参与β-1,3-葡聚糖的合成。本实验室前期研究结果表明,该基因的敲除导致禾谷镰孢菌菌丝生长受损,无法通过无性繁殖产生孢子 (数据未发表)。鉴于β-1,3-葡聚糖合成酶在禾谷镰孢菌中的重要作用及医药领域已开发出相应的抑制剂,因此该蛋白可作为开发小麦赤霉病菌抑制剂的潜在靶标。
β-1,3-葡聚糖合成酶在医药领域也是一个重要的靶标蛋白,脂肽类如棘白菌素[28]、三萜苷类如enfumafungins[29]、C-芳基糖苷类如papulacandins[30]等均是以该酶为靶标开发得到的β-1,3-葡聚糖合成酶抑制剂,其中棘白菌素类药剂已被批准上市[31]。此外,由于β-1,3-葡聚糖合成酶在病原菌中普遍存在,而在哺乳动物中不存在,所以该抑制剂对动物等非靶标生物安全性较高[32]。棘白菌素类药剂通过与真菌β-1,3-葡聚糖合成酶非竞争性结合而抑制真菌生长,但由于棘白菌素类药剂杀菌谱较窄,导致真菌的耐药性问题日趋严重,而药剂和靶标结合方式不明也限制了新型抑制剂的开发[33],所以药剂与该蛋白靶标互作的结构解析是是近年来医药上的研究热点。尽管目前对于β-1,3-葡聚糖合成酶的生物学性质研究较多,但仍未见该酶被成功表达和纯化的报道。Jimenez-Ortigosa 等利用Cryo-Electron Tomography 技术,观察到白色念珠菌C.glabrata中的β-1,3-葡聚糖合成酶为六聚体复合物[34]。Inoue 等利用产物截留的方法富集到了700 倍的酶复合物[20],但并未成功纯化到完整的β-1,3-葡聚糖合成酶。Beauvais 等的研究结果表明,由于截短mRNA 的形成,未能成功利用草地贪夜蛾昆虫细胞Sf9 表达系统表达来自烟曲霉的完整重组蛋白FKS1p[35]。异源表达和纯化β-1,3-葡聚糖合成酶的失败,严重限制了GS 抑制剂与β-1,3-葡聚糖合成酶互作的三维结构的解析。本研究拟通过草地贪夜蛾昆虫细胞Sf9 表达系统,以禾谷镰刀菌为供试菌株,筛选表达该菌株β-1,3-葡聚糖合成酶催化亚基的载体和分离纯化所需的去污剂,旨在为该蛋白的生物化学功能及三维结构的研究奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株、质粒、细胞 禾谷镰孢菌菌株为野生型菌株PH-1;禾谷镰孢菌菌株cDNA、杆状病毒表达质粒pFastBac 和草地贪夜蛾Spodoptera frugiperda昆虫细胞Sf9,由南京农业大学植物保护学院农药靶标生物学实验室保存;大肠杆菌Escherichia coliDH5α 感受态细胞和大肠杆菌E.coliDH10Bac 感受态细胞,由南京农业大学植物保护学院农药靶标生物学实验室自制。
1.1.2 供试试剂 FastPfu Premix、DNA Marker、T4 DNA Ligase、2 × Ezmax-Single CloneMix Plus和质粒小量抽提试剂盒,均购自TOLOBIO;标准蛋白Marker,购自Thermo Fisher;限制性内切酶BamHⅠ、EcoRⅠ、HindⅢ、NheⅠ和NotⅠ,购自TaKaRa;His 抗体、GFP 抗体和Strep 抗体,购自Absin;去污剂十二烷基-β-D-麦芽糖苷 (ndodecyl-β-maltoside, DDM)、十烷基-β-D-麦芽糖苷(n-decyl-β-maltoside, DM) 购自Glycon,n-正辛基-β-D-葡葡萄糖苷 (n-octyl-β-D-glucoside, βOG)、十二烷基二甲胺氧化胺 (dodecyldimethylamine oxide,DDAO) 和正壬基-β-D-麦芽糖苷 (n-nonyl-β-Dmaltoside, NM),购自Anatrace;Ni-NTA 琼脂糖树脂购自Cytiva;草地贪夜蛾昆虫细胞培养基SIM SF、转染试剂Sinofection 均购自北京义翘神州科技股份有限公司。氯化钠,购自生工;4-羟乙基哌嗪乙磺酸 (4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid, HEPES ),购自索莱宝;甘油(glycerol),购自永华;咪唑(imidazole),购自源叶生物。
1.1.3 试验仪器 Trident960 PCR 扩增仪,Heal Force 公司;FUSION FX7 RGB SPECTRA 生物大分子分析仪,Vilber 公司;MQD-B1R 摇床,旻泉仪器公司;SPX-500 智能型生化培养箱,宁波东南公司;Centrifuge 5424 高速离心机,Eppendorf公司;COULTER 超高速离心机,BECKMAN 公司。
1.1.4 引物设计 使用SnapGene 软件进行引物设计,引物订购于金斯瑞生物科技有限公司。
1.1.5 分离纯化所用缓冲液 Buffer A (150 mmol/L NaCl,20 mmol/L HEPES,10%甘油,pH 7.5);Buffer B (150 mmol/L NaCl,20 mmol/L HEPES,10%甘油,25 mmol/L 咪唑,pH 7.5);Buffer C(150 mmol/L NaCl,20 mmol/L HEPES,10%甘油,250 mmol/L 咪唑,pH 7.5)。
1.2 试验方法
1.2.1 昆虫细胞表达载体的构建 为了检测蛋白的表达、增加蛋白的可溶性、促进蛋白表达后定位于细胞膜上及便于蛋白的分离纯化,拟在表达载体上添加绿色荧光蛋白 (green fluorescent protein,GFP) 标签、血凝素 (hemagglutinin,HA) 信号肽、AcMNPV (autographa californica nuclear polyhedrosis virus) 杆状病毒包膜磷酸化糖蛋白 (glycoprotein,GP67) 信号肽、8 个组氨酸(Histidine, His)标签8 ×His、2 个链球菌抗生物素蛋白 (streptavidin,Strep)标签2 × Strep,同时添加烟草蚀纹病毒TEV 识别位点,以便于后续切除表达分离标签及信号肽。同时为了促进FgGLS2 的稳定表达,构建FgRHO蛋白表达载体,与FgGLS2 表达载体在昆虫细胞中进行共表达。使用FgG-F 和FgG-R 一对引物扩增FgGLS2 基因,使用引物 gp-F 和GFP-TEVR1、GFP-TEV-R2 扩增GP67-8 × His-GFP-TEV 片段,使用引物HA-F 和GFP-TEV-R1、GFP-TEVR2 扩增HA-8 × His-GFP-TEV 片段,将两组片段和目的基因利用同源重组的方法分别进行融合,同样方法将其连接在用B a m H Ⅰ和H i n d Ⅲ酶切后的pFastBac 空载上,以构建载体pFastBac-GP67(signal peptide)-8 × His-GFP-TEV-FgGLS2 和pFastBac-HA(signal peptide)-8 × His-GFP-TEVFgGLS2。使用引物gp-F 和strep-R 扩增标签GP67-6 × His-2 × Strep,使用引物HA-F 和strep-R 扩增标签HA-8 × His-2 × Strep,将已构建成功的两个载体用NotⅠ和BamHⅠ进行酶切,将扩增后的标签与酶切后的载体进行T4 DNA Ligase 连接,以构建载体pFastBac-GP67(signal peptide)-6 × His-2 ×Strep-TEV-FgGLS2 和pFastBac-HA(signal peptide)-8 × His-2 × Strep-TEV-FgGLS2。用引物FgR-F 和FgR-R1、FgR-R2 扩增FgRHO-TEV 基因并用T4 DNA Ligase 连接将基因连接在用EcoRⅠ和NheⅠ酶切后的pFastBac-8 × His 载体上,以构建载体pFastBac-FgRHO-TEV-8 × His (引物序列见表1)。

表1 本试验所需引物的序列Table 1 Primer sequences used in this study
1.2.2 杆状病毒质粒的制备 将上述制备成功的载体热激转化至大肠杆菌DH10Bac 感受态细胞中,进行蓝白斑的筛选。挑选白斑的菌体摇培扩繁后,于12 000 r/min 离心2 min,收集菌体。用质粒小量抽提试剂盒中的buffer P1、P2、P3 裂解菌体,用纯度100%的异丙醇沉降,于12 000 r/min离心10 min 后使用70%的乙醇清洗沉淀,待沉淀风干后,加入适量ddH2O,充分溶解后即制得杆状病毒质粒DNA,置于 -20 ℃保存备用。
1.2.3 重组杆状病毒的制备 100 μL 昆虫细胞培养基与15 μL 转染试剂、5 μL 杆状病毒质粒DNA搅拌混匀,加入2 mL 包含1 × 106个/mL Sf9 昆虫细胞的培养液中,27 ℃静置培养6 d,2000 r/min离心,收集上清液即为P1 代病毒液。将其按体积比1 : 100 的稀释比例加入至包含3 × 106个/mL Sf9昆虫细胞的10 mL 培养液中,于27 ℃、120 r/min摇培2 d,2000 r/min 离心后收集上清液,即为P2 代病毒液。同法制备P3 代病毒液。
1.2.4 重组蛋白的表达纯化 将P3 代病毒液按体积比1 : 100 的比例加入至50 mL 包含3 × 106个/mL Sf9 昆虫细胞的培养液中,于27 ℃ 120 r/min 摇培2 d,2000 r/min 下离心,收集菌体。用Buffer A 重悬破碎后,收集沉淀;用Buffer A 重悬后收集上清液。加入一定体积的Ni-NTA 琼脂糖树脂进行孵育,使用Buffer B 和Buffer C 进行亲和纯化。
1.2.5 结果检测 单独表达载体根据蛋白表达量分别选择蛋白质免疫印迹法(Western Blot)和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDSPAGE)两种方式进行检测,FgGLS2 蛋白取离心后的上清液和沉淀后,使用Western Blot 方法进行检测。GP67-8 × His-GFP-TEV-FgGLS2、HA-8 ×His-GFP-TEV-FgGLS2 使用His 和GFP 抗体进行检测。GP67-6 × His-2 × Strep-TEV-FgGLS2,HA-8 × His-2 × Strep-TEV-FgGLS2 使用His 和Strep 抗体进行检测。FgRHO-TEV-8 × His 使用Ni-NTA琼脂糖树脂纯化后通过SDS-PAGE 进行检测分析。蛋白共表达后取两次离心后的上清液、沉淀和纯化后的洗脱液共5 个样用Western Blot 进行双抗体检测。
2 结果与讨论
2.1 蛋白序列分析
通过Uniprot 网站 (https://www.uniprot.org/uniprotkb/I1RUP6/entry) 对FgGLS2 蛋白序列进行序列分析,发现该蛋白包含1944 个氨基酸,全长蛋白222 kD。使用NovoPro 网站 (https://www.novopro.cn) 对蛋白进行跨膜螺旋结构域(transmembrane helices ,TMH)的预测,发现该蛋白含有16 个跨膜域 (图1)。

图1 FgGLS2 蛋白序列分析Fig.1 FgGLS2 protein sequence analysis
2.2 昆虫细胞表达载体构建图谱
本研究通过添加信号肽的方式以便于目的蛋白定位于细胞膜上并在正确位置进行折叠,通过添加GFP 标签以便于初步观察载体是否能够表达,通过添加His 和Strep 标签以便于后续对蛋白进行检测和纯化,用材料与方法中所示策略构建相应载体,载体构建图谱如图2 所示。通过Swiss Bioinformatics Resource Portal 网站 (https://www.expasy.org/) 计算重组蛋白的pI 值和重组蛋白的分子质量 (图2A)。载体pFastBac-FgRHO-TEV-8 ×His 用于表达重组蛋白FgRHO-TEV-8 × His (载体图谱如图2B 所示),载体pFastBac-GP67-8 × His-GFP-TEV-FgGLS2 和pFastBac-HA-8 × His-GFPTEV-FgGLS2 用于表达重组蛋白GP67-8 × His-GFP-TEV-FgGLS2 和HA-8 × His-GFP-TEV-FgGLS2(载体图谱如图2C 和2D 所示)。载体pFastBac-GP67-6 × His-2 × Strep-TEV-FgGLS2 和pFastBac-HA-8 × His-2 × Strep-TEV-FgGLS2 用于表达重组蛋白GP67-6 × His-2 × Strep-TEV-FgGLS2 和HA-8 ×His-2 × Strep-TEV-FgGLS2 (载体图谱如图2E 和2F 所示)。

图2 昆虫系统表达载体构建图谱Fig.2 Construction maps of insect system expression vectors
2.3 禾谷镰孢菌β-1,3-葡聚糖合成酶催化亚基FgGLS2 和调节亚基FgRHO 蛋白表达
根据分子质量大小对相应蛋白检测结果进行分析。结果表明:FgRHO-TEV-8 × His 可以在昆虫细胞中表达 (图3A);GP67-8 × His-GFP-TEVFgGLS2 和HA-8 × His-GFP-TEV-FgGLS2 可以用GFP 抗体检测到,但His 标签断裂较为严重,无法检测到目的蛋白 (图3B);GP67-6 × His-2 × Strep-TEV-FgGLS2 可以用两个抗体同时检测到表达(图3C ④),而HA-8 × His-2 × Strep-TEV-FgGLS2无法检测到表达 (图3C ⑤)。因此,FgRHO-TEV-8 × His、GP67-8 × His-GFP-TEV-FgGLS2、HA-8 ×His-GFP-TEV-FgGLS2 及GP67-6 × His-2 × Strep-TEV-FgGLS2 均可用于下一步研究,在FgGLS2和FgRHO 共表达条件下,筛选可以用于纯化两种蛋白的去污剂。

图3 SDS-PAGE 检测β-1,3-葡聚糖合成酶调节亚基FgRHO 蛋白表达结果和Western Blot 检测β-1,3-葡聚糖合成酶催化亚基FgGLS2 蛋白表达结果Fig.3 The expression results of β-1, 3-glucan synthetase regulatory subunit FgRHO protein were detected by SDS-PAGE and the expression results of β-1,3-glucan synthetase catalytic subunit FgGLS2 protein were detected by Western Blot
2.4 GP67-8 × His-GFP-TEV-FgGLS2 和FgRHOTEV-8 × His 共表达及去污剂的筛选
GP67-8 × His-GFP-TEV-FgGLS2 和FgRHOTEV-8 × His 共表达结果表明,FgRHO 蛋白稳定了FgGLS2 蛋白的表达,使得FgGLS2 蛋白可同时被两种抗体检测到。用DDM、DM、NM、DDAO、βOG 5 种去污剂对目标蛋白进行提取,发现DDAO处理可以较好地将蛋白从细胞膜上分离出来,并可在洗脱液中检测到FgGLS2 和FgRHO 两种蛋白 (图4B),而NM、βOG 处理仅能将FgRHO蛋白分离出来 (图4B、4C),因此纯化GP67-8 ×His-GFP-TEV-FgGLS2 和FgRHO-TEV-8 × His蛋白使用DDAO 进行分离效果最佳。
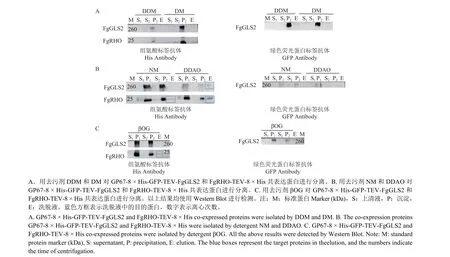
图4 GP67-8 × His-GFP-TEV-FgGLS2 和FgRHO-TEV-8 × His 共表达及去污剂筛选Fig.4 Co-expression of GP67-8 × His-GFP-TEV-FgGLS2 and FgRHO-TEV-8 × His and screening of detergent
2.5 HA-8 × His-GFP-TEV-FgGLS2 和FgRHOTEV-8 × His 共表达及去污剂的筛选
HA-8 × His-GFP-TEV-FgGLS2 和FgRHOTEV-8 × His 共表达结果与GP67-8 × His-GFPTEV-FgGLS2 和FgRHO-TEV-8 × His 共表达结果一致。用5 种去污剂筛选后发现,使用DDM、DM、DDAO 处理,均可在洗脱液中检测到FgGLS2蛋白和FgRHO 蛋白 (图5A、5B),使用NM 处理则仅可以在溶解细胞膜后的上清液中检测到FgGLS2 蛋白,在洗脱液中可以检测到FgRHO 蛋白 (图5C)。综上所述,对于HA-8 × His-GFPTEV-FgGLS2 和FgRHO-TEV-8 × His 蛋白的纯化选择DDM、DM、DDAO 均可。

图5 HA-8 × His-GFP-TEV-FgGLS2 和FgRHO-TEV-8 × His 共表达及去污剂筛选Fig.5 Co-expression of HA-8 × His-GFP-TEV-FgGLS2 and FgRHO-TEV-8 × His and detergents screening
2.6 GP67-6 × His-2 × Strep-TEV-FgGLS2 和FgRHO-TEV-8 × His 共表达及去污剂的筛选
GP67-6 × His-2 × Strep-TEV-FgGLS2 和FgRHOTEV-8 × His 共表达结果与其他蛋白共表达结果一致。去污剂筛选结果表明,用DM 和DDAO 处理,均可在溶解细胞膜后将FgGLS2 蛋白和FgRHO蛋白从膜中提取出来,并在洗脱液中检测到纯化后的蛋白 (图6A、6C),用DDM、NM 处理后可在洗脱液中检测到FgRHO 蛋白 (图6A、6B),而βOG 无法将任何蛋白提取出来 (图6B)。因此,GP67-6 × His-2 × Strep-TEV-FgGLS2 和FgRHO-TEV-8 × His 蛋白的纯化选择DM 和DDAO 效果较好。
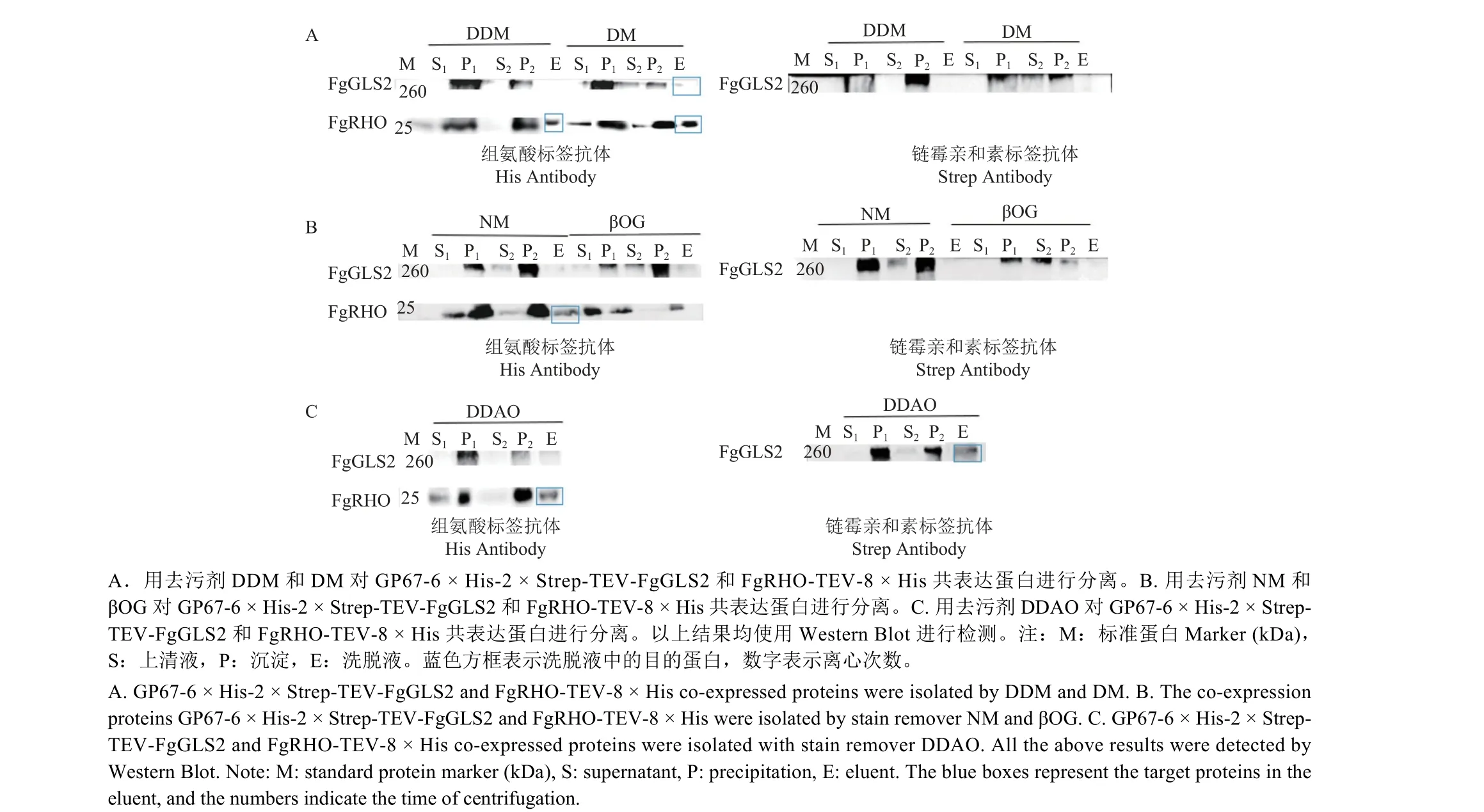
图6 GP67-6 × His-2 × Strep-TEV-FgGLS2 和FgRHO-TEV-8 × His 共表达及去污剂筛选Fig.6 Co-expression of GP67-6 × His-2 × Strep-TEV-FgGLS2 and FgRHO-TEV-8 × His and detergents screening
3 讨论
小麦赤霉病严重威胁我国粮食安全和人畜健康,禾谷镰孢菌作为引起小麦赤霉病的主要病原菌,研究其体内重要蛋白的功能和结构,发现杀菌剂开发的潜在靶标,有助于新型作用机制杀菌剂的创制及该类病害的高效防治。
细胞壁是包围真菌细胞的外部结构,对于细胞的机械保护和维持细胞形状必不可少。在真菌感染期间,细胞壁是病原体与宿主细胞相互作用的界面,因此在真菌致病性和毒力方面起着关键作用[36-38]。大多数真菌的内层由分支的β-1,3-葡聚糖组成[39],因此,抑制β-1,3-葡聚糖的合成对抑制真菌具有重要意义。β-1,3-葡聚糖合成酶催化亚基Fksp 的分子质量超过200 kDa,并含有多个跨膜结构[40],由于原核表达系统的局限性[41],对于该蛋白全长蛋白的异源表达只能选择真核表达系统。本研究在草地贪夜蛾Spodoptera frugiperda昆虫细胞Sf9 表达系统中成功对该酶进行了异源表达,并成功构建了可以在昆虫细胞中表达该酶的载体:pFastBac-GP67-8 × His-GFP-TEV-FgGLS2、pFastBac-HA-8 × His-GFP-TEV-FgGLS2、pFastBac-GP67-6 × His-2 × Strep-TEV-FgGLS2 和pFastBac-FgRHO-TEV-8 × His。β-1,3-葡聚糖合成酶主要包含催化亚基和调节亚基两个亚单位,已有研究表明,从酿酒酵母RHO1 缺失突变体分离的细胞膜,可以在外源添加Rho1p 重组蛋白后恢复β-1,3-葡聚糖合成酶的活性[18]。Mazur 等的研究表明,两个亚单位需要同时在同一系统中表达,才可能得到具有活性的酶复合体[42]。本研究结果也表明,在FgGLS2 蛋白与FgRHO 蛋白共表达时才稳定了GP678 × His-GFP-TEV-FgGLS2 和HA-8 × His-GFP-TEV-FgGLS2 的表达。β-1,3-葡聚糖合成酶催化亚基为细胞膜蛋白,跨膜蛋白的提取需要合适的去污剂将蛋白从膜结构中提取出来[43],本研究结果表明,针对3 种不同的表达载体,DDAO 均对FgGLS2 蛋白的提取具有较好的效果。
β-1,3-葡聚糖合成酶是影响禾谷镰孢菌生长发育的关键蛋白,是杀菌剂开发理想的药物靶标。本研究首次成功地在昆虫细胞中表达了禾谷镰孢菌β-1,3-葡聚糖合成酶催化亚基GLS2,通过筛选异源表达载体和纯化所需的去污剂,有助于进一步研究该蛋白的生化功能及蛋白质三维结构,为后续新型靶向杀菌剂的开发奠定了重要的基础。
