电针预处理对急性肺损伤大鼠炎症反应及PINK1、parkin蛋白表达的影响*
2023-06-19谭金曲孙光华刘丹妮黄夏荣周桂娟屈萌艰曾亚华
谭金曲,周 君,孙光华,刘丹妮,黄夏荣,罗 敷,周桂娟,屈萌艰,彭 婷,曾亚华
(南华大学衡阳医学院附属第一医院,湖南 衡阳 421001)
急性肺损伤(acute lung injury,ALⅠ)是各种原因导致的以低氧血症为特征,最终导致呼吸衰竭的临床病症[1]。ALⅠ的病理核心是炎症反应,PⅠNK1是一种丝氨酸/苏氨酸激酶,与自噬、凋亡、氧化应激、释放突触递质和线粒体钙离子稳态等有密切联系,Parkin 是PⅠNK1 的 下游 蛋白[2]。研 究发 现PⅠNK1/Parkin 介导的线粒体自噬参与ALⅠ炎症反应[3]。调控PⅠNK1/Parkin 表达,促进线粒体自噬,可以抑制炎症反应、细胞焦亡,起到保护肺组织的作用,可作为治疗靶点。电针对ALⅠ有确切的治疗作用,能明显缓解ALⅠ炎症反应、减轻肺水肿[4],但电针治疗急性肺损伤的机制尚未完全阐明。本次研究通过观察经电针预处理后ALⅠ大鼠血清中白细胞介素-6(interleukin-6, ⅠL-6)和转化生长因子-β1(transforming growth factor-β1,TGF-β1)等炎症因子水平及肺组织中PⅠNK1、parkin 蛋白表达的变化,探讨电针对ALⅠ的疗效及机制,为电针防治ALⅠ提供一定实验依据。
1 材料与方法
1.1 实验动物24 只3 月龄清洁级雄性大鼠,体质量(327.0±10.7)g,购买自湖南省斯莱克景达实验动物有限公司,合格证号为SYXK(湘)2020-0002。饲养于南华大学实验动物中心,动物分笼饲养,盒笼备有垫料、饲料和饮水,将室温调至20-26 ℃,将湿度调至50-60%,模拟正常昼夜更替。常规饲养1 周后开始实验。实验所需操作均符合我国《实验动物管理条例》及我院伦理委员会( 批准号:202012100289)的相关规定。
1.2 主要试剂与仪器 试剂:常规化学试剂、Tween-20、APS:中国上海国药(货号:71033942、10002618、30189328);Tris、甘 氨 酸:美 国Sigma(货 号:Ⅴ900483、Ⅴ900144);蛋白酶抑制剂、蛋白磷酸酶抑制剂:上海爱必信生物科技有限公司(货号:583794、P1260);显影液、定影液:中国上海佳信(BW-61、BW-62);LPS:北京百奥莱博科技有限公司(货号:BK-001)。仪器:台式冷冻离心机:济南童鑫生物科技有限公司(货号:H1650R);电泳仪、电泳槽、转膜仪:中国北京六一(货号:DYY-6C、DYCZ-24DN、DYCZ-40D);电子天平:美国双杰(货号:JJ224BC);普通冰箱:中国奥克斯(货号:BCD-196A);PCR 仪、荧光PCR 板:湖南中美仪器有限公司(货号:HD4925、GL-88B)。
1.3 分组及造模24 只大鼠参照随机数字表法进行分组,分别为空白对照组、ALⅠ组和电针预处理组,每组8 只。ALⅠ造模参照脂多糖(lipopolysaccharide,LPS)尾静脉注射方法[5-6],具体操作:选取大鼠尾静脉1/3 处进行碘酒消毒,扩张局部血管,1 ml 注射器抽取溶解好的LPS 溶液(剂量5 mg/kg,浓度5 mg/ml),斜45°进针后平行进针,回抽见静脉血后注入LPS。
1.4 电针预处理操作 电针预处理组于大鼠造模前进行电针预处理。具体操作:选取双侧“尺泽”、“足三里”穴,参照中国针灸学会实验针灸研究制定的《动物针灸穴位图谱》进行定位,“尺泽穴”在大鼠肘弯横纹偏外的凹陷中,“足三里”穴在膝关节后外侧,在腓骨小头下约3mm 处。采用长度40 mm、直径0.25 mm 的华佗牌一次性无菌针灸针刺入,进针后,针柄接电针,波形为疏密波,疏波频率3 Hz,密波频率15 Hz;强度以局部肌肉轻微收缩为度(约1.0 mA)。每次30 min,每天1次,共预处理5天。
1.5 实验过程 各组大鼠适应性喂养1 周后开始正式实验。电针预处理组进行电针预处理5 天,空白对照组和ALⅠ组常规饲养5 天。5 天后电针预处理组和ALⅠ组开始造模,空白对照组不造模。造模6 h后,三组大鼠进行麻醉取材。
1.6 实验取材
1.6.1 血清10%水合氯醛(3ml/kg)腹腔注射麻醉大鼠,眼眶采血约1 mL,放入离心机,以转速3000 r/min 离心30 min,使用移液枪取上清液至冻存管,并保存于-80 ℃冰箱,用于ELⅠSA检测。
1.6.2 肺组织 大鼠取血后处死,并将其仰卧于鼠板上,胸前及上腹部剪毛备皮,局部皮肤碘酒消毒,用剪刀逐层剪开胸腔取出肺组织,取1/2 左下肺组织进行HE 染色;1/2 右下肺组织放入冻存管,并保存于液氮罐中,用于荧光定量PCR和WB检测。
1.7 标本检测
1.7.1 HE 染色及病理评分 将大鼠左上肺组织进行包埋、切片,脱蜡、复水;滴加苏木精染色液染色,清洗后返蓝,再冲洗,取伊红试剂染色,晾干固定好,光学显微镜下观察形态变化后,根据以下肺组织病理变化评分标准进行评分。评分标准[7]:①肺泡充血;②出血;③肺泡腔或血管壁中性粒细胞浸润或聚集;④肺泡壁增厚和(或)透明膜形成。分别依病变轻重评为0-4分:0分指无病变或非常轻微病变;1分为轻度病变;2 分为中度病变;3 分为重度病变;4分为极重度病变。
1.7.2 血清ⅠL-6 和TGF-β1 含量检测 采用ELⅠSA 检测方法,严格按照试剂说明书操作,检测血清ⅠL-6和TGF-β1水平。
1.7.3 PⅠNK1、parkin 的mRNA 表达 采用荧光定量PCR 检测PⅠNK1、parkin 的mRNA 表达。具体操作:提前准备好RNA 提取所需器械和试剂后。Trizol 提取组织总RNA,然后RNA 反转录以组织总mRNA 为模板,逆转录cDNA,逆转录产物用于PCR 反应和荧光定量PCR 反应。以cDNA 为模板加入靶基因上下游引物进行扩增,β-actin 为内参,引物序列见表1。实验之后记录PCR 仪测定的Ct值,按2-△△Ct(目的基因的相对表达量)方法进行实验数据处理,分析PⅠNK1、parkin的mRNA表达情况。引物信息见表1。
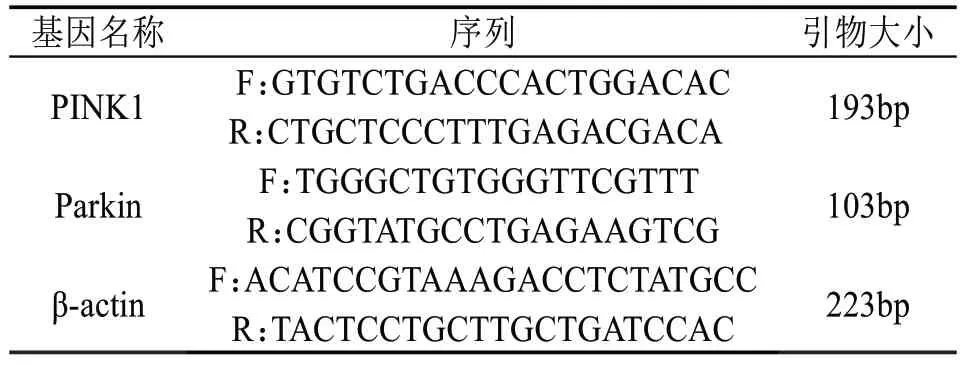
表1 引物信息
1.7.4 PⅠNK1、parkin 的蛋白 表达 采用WB 检测PⅠNK1、Parkin 蛋白在细胞中的表达。具体操作:剪取0.025 g组织,经PBS清洗、研磨、裂解、离心后,取上清液移入离心管存于液氮罐中;取160 μL 蛋白上清液进行WB 检测,经电泳(电泳恒定电压75 Ⅴ,时间为130 min)、转膜(转膜300 mA 恒定电流,Parkin 约72 min,PⅠNK1 约83 min)、封闭、一抗及二抗孵育,孵育后用滤纸吸尽液体,用塑封膜将膜包裹杂交膜,在暗盒内与X 胶片曝光1-30 min,最后显影冲洗。扫描底片,分析细胞中PⅠNK1、parkin 蛋白表达含量。
1.8 统计学分析 符合正态分布的计量资料均使用均数加减标准差(±s)表示,不符合正态分布用四分位数和四分位数间距表示。应用SPSS 23.0 软件进行数据分析,多组间采用单因素方差分析。两两比较方差齐时,事后检验采用LSD 检验;方差不齐时,则采用Dunnett T3检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠实验完成情况 实验过程顺利,动物无脱失、死亡,取材时正常组因麻醉过量死亡1 只大鼠,缺少一个血清标本,其余标本均送检,进行数据分析。
2.2 电针预处理对ALⅠ大鼠肺组织病理结构改变的影响 肺组织HE 染色结果显示,ALⅠ组大鼠肺组织有明显的充血及出血表现,部分肺泡结构消失、融合,其内渗出明显,伴大量炎性细胞聚集,部分肺泡壁显著增厚。电针预处理组的肺组织轻度充血,肺泡有部分融合,但大部分结构清晰可见,肺泡腔内无透明膜形成,肺泡隔内少量炎性细胞聚集。空白对照组的肺组织结构正常,无明显损伤、炎性细胞浸润,见图1。肺组织病理评分结果显示,ALⅠ组的肺损伤评分较空白对照组增高(P<0.01);电针预处理组较ALⅠ组显著降低(P<0.01),见图2。
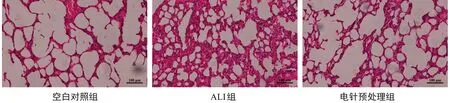
图1 各组大鼠造模6 h后肺组织的病理切片(HE染色×200倍)
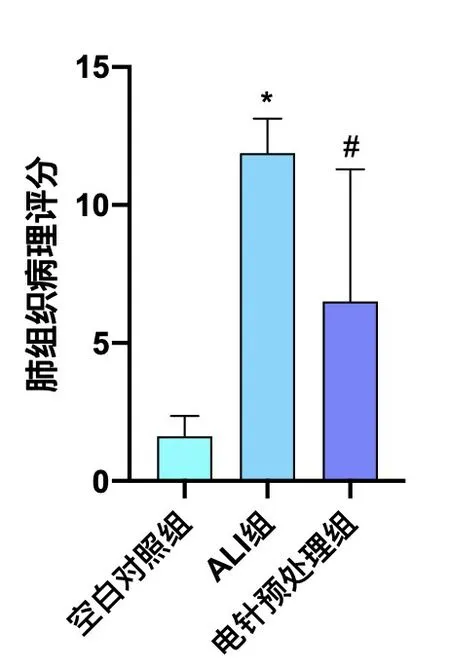
图2 各组大鼠造模6 h后肺组织病理评分的比较(± s,8只鼠/组)
2.3 电针预处理对ALⅠ大鼠血清ⅠL-6 和TGF-β1 含量的影响ALⅠ组血清TGF-β1 表达较空白对照组明显降低(P<0.01),血清ⅠL-6 较空白对照组有升高趋势,但差异无统计学意义(P>0.05);电针预处理组血清TGF-β1较ALⅠ组有上升趋势,但差异无统计学意义(P>0.05),血清ⅠL-6较ALⅠ组有下降趋势,但差异无统计学意义(P>0.05)。见图3。
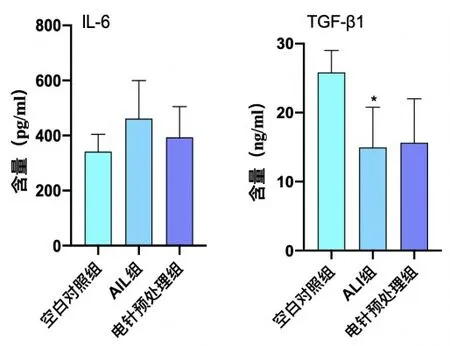
图3 各组大鼠造模6 h后血清ⅠL-6和TGF-β1含量比较(± s,7只鼠/组)
2.4 电针预处理对ALⅠ大鼠肺组织中PⅠNK1、parkin mRNA 表达的影响ALⅠ组PⅠNK1 mRNA 表达较空白对照组显著增高(P<0.01),parkin mRNA 表达较空白对照组明显增高(P<0.01);电针预处理组PⅠNK1 mRNA 表达较ALⅠ组降低(P<0.01),parkin mRNA表达较ALⅠ组显著降低(P<0.01)。见图4。
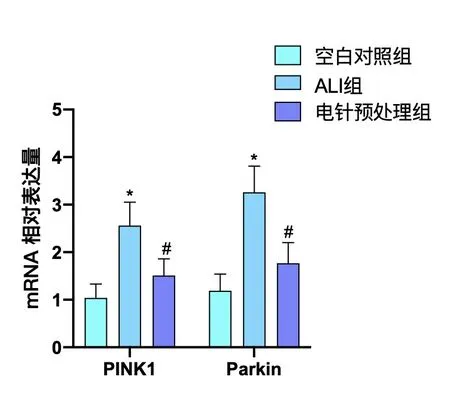
图4 各组大鼠造模6 h后肺组织PⅠNK1、parkin的mRNA表达水平的比较(± s,8只鼠/组)
2.5 电针预处理对ALⅠ大鼠肺组织中PⅠNK1、parkin蛋白表达的影响ALⅠ组PⅠNK1 蛋白表达较空白对照组明显增高(P<0.01),parkin 蛋白表达较空白对照组明显增高(P<0.01);电针预处理组PⅠNK1 蛋白表达较ALⅠ组降低(P<0.01),parkin蛋白表达较ALⅠ组有降低趋势,但组间差异无统计学意义(P>0.05)。见图5、图6。
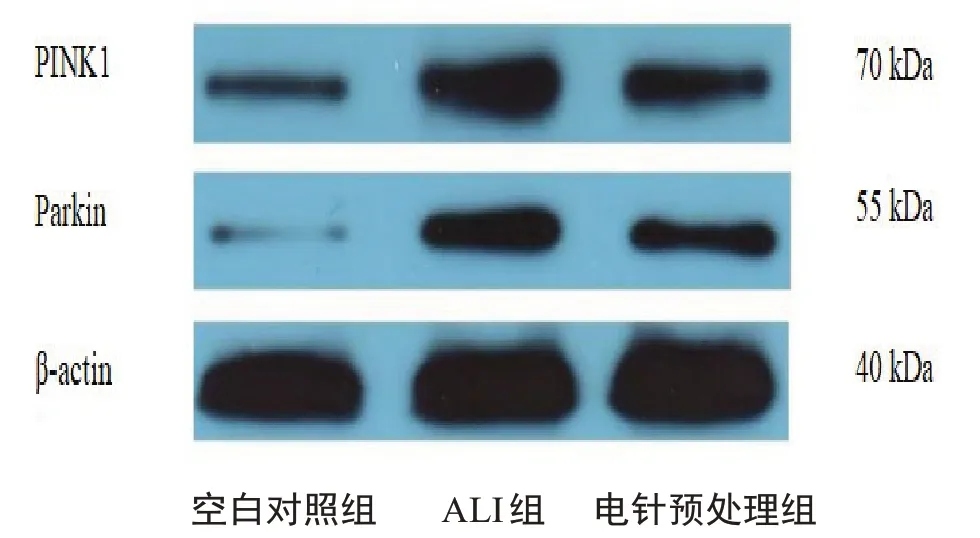
图5 各组大鼠造模6 h后肺组织PⅠNK1、parkin蛋白表达水平的比较(± s,8只鼠/组)(WB蛋白检测)

图6 各组大鼠造模6 h后肺组织PⅠNK1、parkin的蛋白相对表达量的比较(± s,8只鼠/组)
3 讨论
ALⅠ高发病率、死亡率,严重威胁病人生命安全,寻找安全有效治疗手段有重要意义[8]。目前,临床上引起ALⅠ最常见的原因为革兰氏阴性细菌所致的重症感染[9],而LPS 作为革兰阴性菌细胞壁主要成分之一[10]。LPS 进入体内,激活免疫反应,促炎与抑炎平衡失调,爆发炎症反应、肺组织发生充血水肿[11],形成内毒素性ALⅠ[12]。因此,LPS 诱导的ALⅠ的病理机制与过度的炎症反应密切相关[13]。另外,LPS 会增加胶原沉积、羟脯氨酸以及Ⅰ型胶原含量,诱导上皮间质转化过程,刺激肺组织TGF-β1 生成[14],最终形成肺部纤维化及空间重构[15]。
电针具备简便验廉、安全可靠的特点,广泛应用于临床各类疾病,本次实验探究电针在ALⅠ的作用及其机制。研究中电针预处理组中穴位选择双侧“尺泽”“足三里”穴,电针参数选用:波形为疏密波3/15 Hz;强度以局部肌肉轻微收缩为度(约1.0 mA)。疏密波使肌肉有节律的收缩,促进组织代谢,以消除炎症水肿[16]。研究显示,低频率、轻刺激在肺损伤的应用较多,能有效减轻炎症缓解肺损伤[17-22]。穴位处方中“尺泽穴”善治咳喘、气逆等肺部病症,“足三里穴”有扶正、培土生金之功,二穴相配共奏祛邪扶正、标本兼治之效。前期研究[23]发现电针预处理可以减轻ALⅠ大鼠的炎症反应。同样,本次研究结果中也显示,经LPS 复制的ALⅠ大鼠肺组织结构破坏,炎症水肿明显,电针预处理可有效预防损伤,减轻造模后炎症反应。
近年来研究发现多种细胞因子参与肺损伤形成,它们相互协调、相互拮抗。在众多促炎性细胞因子中,ⅠL-6是LPS诱导ALⅠ的重要炎性因子之一,在参与ALⅠ炎症反应的同时,能作为中间物质激活其他炎性因子,诱导肺泡上皮细胞和内皮细胞损伤,促进ALⅠ的发生、发展[24]。ALⅠ早期即可见TGF-β1 被激活,激活后的TGF-β1 导致肺泡毛细血管的通透性增加,诱发肺水肿及炎症因子的释放[25]。而且,TGF-β1 可诱导胶原分子生成过量,沉积在上皮进而造成气道重塑。同时,TGF-β 还可激活基质金属蛋白酶分解肺组织细胞外基质,启动上皮间充质化,导致气道上皮屏障功能受损[26]。因此抑制过度炎症反应,阻止肺上皮-间质转化,能有效的控制疾病的发展,造成不可逆损伤,降低病死率。研究发现,LPS 诱导形成ALⅠ过程中,PⅠNK1 以及Parkin蛋白含量明显上升,细胞焦亡数量增加,线粒体自噬能力增强[27]。可以清除受损肺组织细胞、减轻炎症反应。同时也有发现PⅠNK1/Parkin 蛋白不断增加,会加重肺部损伤,促进肺上皮细胞坏死凋亡[2,28-29]。本次研究结果显示,ALⅠ大鼠血清中ⅠL-6含量增加,血清中TGF-β1 含量降低,经电针预处理的ALⅠ大鼠血清中ⅠL-6 表达减少、TGF-β1 含量上升。本次结果中TGF-β1 的表达与以往研究结果不一致,可能跟数据少有关,需进一步实验验证。ALⅠ组PⅠNK1、Parkin 蛋白表达明显上升,说明造模后的大鼠肺组织中自噬蛋白表达增加,电针预处理组较ALⅠ组含量减少,同时血清中炎症因子(ⅠL-6)表达下调,可能是电针预处理后的ALⅠ大鼠消耗自噬蛋白吞噬炎性细胞、焦亡细胞,从而改善炎症反应。
综上所述,电针预处理能减轻LPS 诱导的大鼠ALⅠ炎症反应,可能与PⅠNK1/Parkin蛋白表达有关,该实验结果可为电针防治ALⅠ提供依据,为治未病思想提供实验基础,同时也可将针灸用于急危重症中。但结论仍需更多的实验论证,以及进一步研究其相关通路,以期更加全面的证实电针在ALⅠ中的防治作用。
