硼替佐米治疗复发/难治性血栓性血小板减少性紫癜一例
2023-06-14高慧徐文君张英豪徐启璐夏炳森
高慧 徐文君 张英豪 徐启璐 夏炳森
患者,男,76岁,因“诊断为血栓性血小板减少性紫癜1年,鼻腔出血伴全身乏力3日”于2020年7月11日收入潍坊市人民医院血液科。3日前患者出现鼻腔出血,伴全身乏力,无发热、头晕、头疼、视物模糊、血尿等,自行口服“牛黄解毒片”效果不佳,于当地医院查血常规示PLT计数10×109/L(100~300×109/L,括号内为正常参考值范围,以下相同)。为进一步诊断来我院就诊。既往史:1年前患者因皮肤紫癜并烦躁不安就诊于我院,确诊为血栓性血小板减少性紫癜(TTP)后予激素、血浆置换(TPE)、环磷酰胺(CTX)、利妥昔单抗(RTX)治疗,出院后PLT计数稳定在170×109/L左右。冠心病2年,不规律服药,具体不详;2型糖尿病2年,应用“谷赖胰岛素7 U三餐前注射,甘精胰岛素16 U睡前1次”,空腹血糖控制在7~8 mmol/L。个人史:吸烟史50年,每日30支,已戒烟1年。无相关家族遗传病史。入院体格检查:T 36 ℃,P 100次/分,R 19次/分,Bp 150/72 mmHg。身高170 cm,体重80 kg,体表面积1.90 m2。神志清楚,精神可,皮肤黏膜少量出血点,心肺腹体格检查大致正常。辅助检查:实验室检查:Hb 119 g/L(120~160 g/L),PLT计数7×109/L,网织红细胞百分比4.05%(0.50%~1.50%),网织红细胞绝对值0.159 7×1012/L(0.024 0~0.084 0×1012/L),凝血酶原时间14.2S(8.8~13.8 S),D-二聚体 2 220 ng/ml(0~2 000 ng/ml),红细胞沉降率54 mm/h(0~15 mm/h),乳酸脱氢酶(LDH)670 U/L(103~198 U/L),凝血酶原国际标准化比值、间接胆红素、尿素氮、肌酐检查结果均正常;尿常规示尿红细胞+++;抗核抗体谱示抗核抗体1∶100阳性、核型核颗粒型、胞浆颗粒型,抗U1-snRNP抗体弱阳性;抗中性粒细胞胞浆抗体、抗心磷脂抗体、抗β2糖蛋白1抗体、TORCH、EB病毒、巨细胞病毒、呼吸道病原体、Coombs试验结果均为阴性。颅脑CT检查示腔隙性脑梗;肺部CT检查示双肺间质性纤维化、双上肺炎症;心电图、肝胆胰脾肾彩色超声检查均正常。患者既往有TTP病史,成人血栓性微血管快速筛查(PLASMIC)评分7分,考虑TTP复发可能性大,病情严重且进展快,遂转入重症医学科,立予TPE 2 400~3 200 ml/d及甲泼尼龙(MP)40 mg/次、每日2次、丙种球蛋白30 g/d、头孢他啶静脉注射抗感染治疗。血管性血友病因子裂解蛋白酶(ADAMTS13)相关检查示ADAMTS13活性1.88%(70.00%~120.00%,<10.00%提示严重缺乏),ADAMTS13抑制物滴度0.63 BU(0~0.60 BU),明确为TTP复发,治疗第6日PLT计数升至58×109/L,转入血液内科。TPE频率调整为隔日1次,期间PLT计数最高升至68×109/L,治疗第9日PLT计数呈下降趋势,于治疗第13、22日予RTX(375 mg/m2/周、700 mg/周)共两次治疗。期间长春地辛(VDS)2 mg/次静脉注射2次,TPE频率调整为每日1次,PLT水平维持在10~24×109/L,遂于治疗第28、31、35、38、53日分别使用硼替佐米(BTZ,1.3 mg/m2、2.4 mg)皮下注射治疗后,PLT计数升高至82×109/L,复查ADAMTS13活性69.4%,ADAMTS13抑制物滴度0 BU。治疗第54日PLT计数回升至82×109/L后出院。TPE治疗期间Hb、PLT、LDH水平变化及MP、RTX、VDS、CTX使用情况见图1。出院诊断:1.复发TTP;2.肺炎 肺间质纤维化;3.2型糖尿病;4.冠状动脉粥样硬化性心脏病 高血压病(Ⅰ级,高危) 5.腔隙性脑梗。出院后第1个月、3个月分别电话随访,患者于当地医院监测PLT计数持续上升并稳定在150×109/L左右。
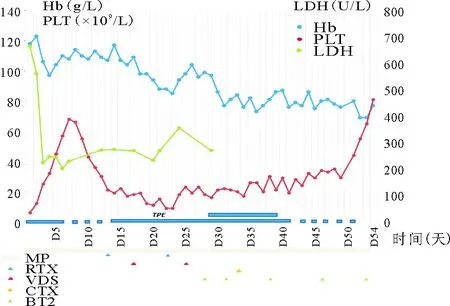
图1 Hb、PLT计数、LDH在TPE治疗中的变化
讨 论
TTP是一种罕见的血栓性微血管性疾病,主要以微血管病性溶血性贫血、PLT计数减少、神经精神症状的三联征或加上肾脏损害和发热的五联征为特征。TTP是血液疾病中的一种危重症,治疗后TTP复发率约为30%,多出现在疾病首次发作后1年内[1]。本例患者为TTP第1次复发,应用激素、TPE先后联合RTX、CTX、VDS等可治疗,PLT计数升高后再次下降,无明显回升趋势,后接受BTZ治疗,PLT计数回升。国外有使用BTZ治疗复发/难治性TTP的散在报道,国内鲜见报道。Yates等[2]报道了1例复发8次的TTP患者,在出现RTX耐药性后应用BTZ治疗,ADAMTS13活性持续上升且未检测到抑制物。Eskazan[3]发现12例患者应用BTZ前均接受过RTX治疗,其中6例应用BTZ同时继续接受RTX治疗,11例在急性发作期存活并保持缓解状态,证明BTZ在复发/难治性TTP患者中有一定疗效。复发/难治性TTP患者应用利妥昔未缓解主要考虑为RTX与CD20+B淋巴细胞结合直接破坏B淋巴细胞,但对浆细胞无用,以致其继续产生抗体,延缓ADAMTS13活性的恢复。
BTZ是第一个被美国食品药品监督管理局(FDA) 批准上市的蛋白酶体抑制剂,目前只正式批准用于多发性骨髓瘤及复发/难治性套细胞淋巴瘤,近年也被应用于治疗TTP。BTZ一方面通过细胞周期阻滞和凋亡消除自身反应性B淋巴细胞和浆细胞,降低抗体水平,提高ADAMTS13活性;另一方面通过抑制自身抗原呈递的树突状细胞的激活,进而减少活化CD4+T淋巴细胞的生成,减轻自身免疫作用[5]。BTZ在治疗TTP中获得了一定疗效,但并不能将全部获益归于它,不能排除RTX联合BTZ的共同疗效,但可确定BTZ可能缩短PLT反应时间并增加ADAMTS13活性,具体机制还需更多的数据进一步研究。
除本例患者应用的治疗方法外,近些年随着对TTP机制的进一步研究,用于治疗TTP的药物越来越多。这些药物包括:(1)N-乙酰半胱氨酸:能够降解超大血管性血友病因子(vWF)多聚体并抑制vWF依赖PLT活化,对于治疗TTP有一定获益[5];(2)重组ADADTS13:中和内源性ADAMTS13抑制物,恢复自身ADAMTS13活性[6];(3)Caplacizumab:是首个由FDA在2019年批准上市的纳米抗体药物,能够靶向作用于VWF的A1结构域并阻断VWF多聚体与PLT的相互作用,从而降低vWF介导的PLT黏附和PLT消耗,有效抑制血栓形成[7];(4)安菲博肽:是一种PLT血小板膜糖蛋白(GP)Ib受体拮抗剂,通过抑制PLT-vWF聚合形成,抑制血栓形成,但在人体的有效性需进一步研究[8]。
综上所述,BTZ治疗本例复发/难治性TTP患者是获益的,尤其是应用激素、TPE、RTX治疗效果不佳时。但因TTP发病率低,复发/难治性TTP病例数量更少,小型案例分析居多,需更多样本数据进一步总结研究。
