紫草素对糖尿病小鼠中性粒细胞胞外诱捕网表达的影响
2023-06-13马慧可姚文涛王正春何秀娟
马慧可,姚文涛,刘 欣,陈 佳,王正春,林 燕,李 萍,何秀娟
糖尿病足溃疡(diabetic foot ulcer,DFU)是糖尿病的常见并发症[1-2]。中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)是中性粒细胞受到刺激活化后释放到胞外的三维DNA 网状结构,其上镶嵌着瓜氨酸化组蛋白H3(citrullinated histone H3, Cit -H3)、髓过氧化物酶(myeloperoxidase, MPO) 和弹性蛋白酶(neutrophil elastase, NE) 等杀菌蛋白,可捕获并清除病原微生物,发挥免疫防御功能[3]。然而,过多或持续存在的NETs 可导致DFU 创面愈合迟缓[4]。
紫草素是紫草的主要成分,具有杀菌、抗炎、抗肿瘤、促进伤口愈合、抗氧化和抗感染等多种生物活性,可用于治疗银屑病、系统性红斑狼疮及皮肤肿瘤等,具有广泛的应用前景[5]。最新研究发现,紫草素可提高间隙连接蛋白(connexin,Cx)家族中Cx26、Cx30 和Cx43 水平,促进慢性皮肤溃疡大鼠创面愈合,促进人角质形成细胞与成纤维细胞增殖,并因此加速慢性创面愈合、激活磷酯酰激醇3-激酶( phosphoinositide 3- kinases,PI3K)/丝氨酸苏氨酸蛋白激酶(serine threonine protein kinase,Akt)信号通路,发挥抗炎作用,进而促进小鼠烧伤性创面愈合,但其对糖尿病性创面愈合的机制尚未明确[6-7]。本实验用佛波酯(phorbol 12-myristate 13-acetate,PMA) 刺激糖尿病小鼠骨髓来源的中性粒细胞诱导体外NETs 模型[8],通过研究紫草素对中性粒细胞NETs生成及其标志物表达的影响,探讨其促进创面修复的机制,以期为其临床应用提供实验依据。
1 实验与材料
1.1 材料
1.1.1 动物 30 只SPF 级雄性C57BL/6J 小鼠(8周,体质量18~22 g),购自斯贝福(北京)生物技术有限公司,动物生产许可证号: SCXK(京)2019-0010。饲养于首都医科大学附属北京中医医院、北京市中医药研究所SPF 级动物室,无菌饲料单笼饲养,自由进食食物和水,室温22~24 ℃,相对湿度50%~60%,12 h 明暗交替,适应性饲养1 周。本动物实验经北京市中医药研究所动物伦理委员会批准,项目批准号:2020120203。
1.1.2 药物 紫草素(批号:517-89-5,纯度≥98%),购自成都瑞芬思生物科技有限公司。
1.1.3 主要试剂与仪器 小鼠骨髓来源中性粒细胞分离试剂盒(天津灏洋生物制品科技有限责任公司,货号TBD2013NM);DMEM 培养基(葡萄糖浓度为 5.5 mmol/L,美国 HyClone 公司,货号SH30243.01);CCK-8 试剂盒(日本同仁化学研究所,货号TR733);Quant-iTTMPicogreenTMdsDNA Assay Kit(美国Invitrogen 公司,货号P7589);胎牛血清(美国Gibco 公司,货号10100154)、核酸染料Sytox Green(美国Thermo 公司,货号S7020);PMA、DNase I(美国Sigma 公司,货号分别为16561-29-8、DN25-100MG);Cit-H3 兔重组多克隆抗体(英国Abcam 公司,货号ab281584);活性氧(reactive oxygen species, ROS)检测试剂盒、DAPI 染色液、Alex Fluor®488 标记山羊抗兔抗体(上海碧云天生物技术研究所,货号分别为S0033S、ZLI-9557、S8802);链脲佐菌素、红细胞裂解液(中国索莱宝公司,货号分别为S8050、R1010);MCo-15AC 型二氧化碳培养箱、全自动酶标仪(美国Thermo 公司,型号分别为371、SYNERGY H1);激光共聚焦显微镜(德国ZEISS 公司,型号LSM780)。
1.2 方法
1.2.1 糖尿病小鼠骨髓来源中性粒细胞的分离与培养 30 只小鼠腹腔注射0.1%链脲佐菌素(0.1 mol/L 柠檬酸盐缓冲液,pH 值4.5,40 mg/kg),连续注射5 d;注射结束1 周后,隔天尾静脉采血并检测随机血糖,血糖值>16.6 mmol/L 提示糖尿病小鼠模型造模成功。
在无菌条件下,体外剥离糖尿病小鼠的股骨和胫骨,冲洗内腔骨髓,70 μm 细胞筛网过滤,离心,弃上清;使用红细胞沉降液重悬细胞,于无菌硅化管中依次加入3 mL 中性粒细胞分离液及1.5 mL 80%浓度中性粒细胞分离液;吸取1 mL 细胞悬液,缓慢加于80%浓度中性粒细胞分离液上,离心。吸取中性粒细胞层,加入清洗液充分混匀,离心;弃上清,加入红细胞裂解液充分混匀,离心;弃上清,加DMEM 培养基重悬细胞,37 ℃,5%CO2培养待用。
1.2.2 药物配制 使用DMEM 培养基将紫草素粉末配成工作液(16 μg/mL,DMSO 终浓度<0.1%),过滤除菌,-80 ℃冰箱储存。DMSO 作为助溶剂时,其终浓度控制在0.1%以内,对细胞活性无影响[9]。
1.2.3 CCK-8 法检测细胞活性 将细胞以3×105个/孔的密度接种于96 孔板,加入不同浓度的紫草素培养8 h后,加入10 μL CCK-8 溶液,37 ℃避光孵育2 h,用酶标仪在450 nm 处测定光密度(OD)值。
1.2.4 细胞分组 将细胞分为对照组、模型组、阳性对照组、紫草素高、中、低浓度组。对照组中加入DMEM 培养基;其余组中均加入PMA(100 nmol/L);DNase I 阳性对照组中加入DNase I(0.1 mg/mL);紫草素高、中、低浓度组中分别加入紫草素溶液(1、0.5、0.25 μg/mL)。
1.2.5 NETs 检测 将中性粒细胞以2×106/mL 接种于24 孔培养板。模型组加入100 nmol/L PMA,药物处理组同时加入1、0.5、0.25 μg/mL 紫草素,阳性对照组加入0.1 mg/mL DNase I,培养8 h,收集上清。取上清,加入Sytox Green(1 μmol/L)染色,使用荧光酶标仪检测荧光强度。
1.2.6 dsDNA 检测 将中性粒细胞以2×106/mL 接种于24 孔培养板。如上处理细胞,培养8 h,收集上清。按照PicoGreen 双链DNA 荧光定量测定试剂盒方法检测细胞上清中游离DNA 含量。稀释标准品及样品,每孔100 μL 加入到96 孔板,每孔加入100 μL 稀释的PicoGreen 工作液,混匀,室温避光2~5 min,采用荧光酶标仪检测信号强度,激发、发射光波长分别为480 nm、520 nm。利用标准品绘制标准曲线并计算各组dsDNA/NETs 含量。
1.2.7 Cit-H3 检测 将中性粒细胞以1×106/mL 接种于激光共聚焦小皿。如上处理细胞,培养6 h,加入4%多聚甲醛固定20 min。弃上清,PBS 洗涤3次。使用5% FBS 的封闭缓冲液,37 ℃孵育1 min;使用Cit-H3 兔重组多克隆抗体(1∶250),4 ℃孵育过夜。PBS 洗3 次,加入Alex Fluor®488 标记山羊抗兔抗体(1∶600),室温孵育1 h。PBS 洗3 次,加入DAPI,激光共聚焦显微镜检测Cit-H3 表达。
1.2.8 活性氧检测 将中性粒细胞以2×106/mL 接种于6 孔板,如上处理细胞培养3 h,1 000 r/min 离心5 min,弃上清;将收集的细胞重悬于1 mL 的DCFH-DA 探针(1∶1 000) 中培养20 min;洗涤后将重悬细胞接种于96 孔板,采用荧光酶标仪检测信号强度,激发、发射光波长分别为485 nm、530 nm。
1.3 统计学方法 实验数据采用SPSS 20.0 进行统计分析,计量资料以均数±标准差表示,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 紫草素对中性粒细胞活性的影响 紫草素在0.125~1 μg/mL 浓度范围内对中性粒细胞活性无影响,见表1。与对照组比较,2 μg/mL 紫草素组OD 值有降低趋势,差异无统计学意义,但依然存在一定抑制作用。1、0.5、0.25 μg/mL 紫草素组OD 值与对照组较为接近,因此,后续实验采用1、0.5、0.25 μg/mL作为紫草素高、中、低浓度组。
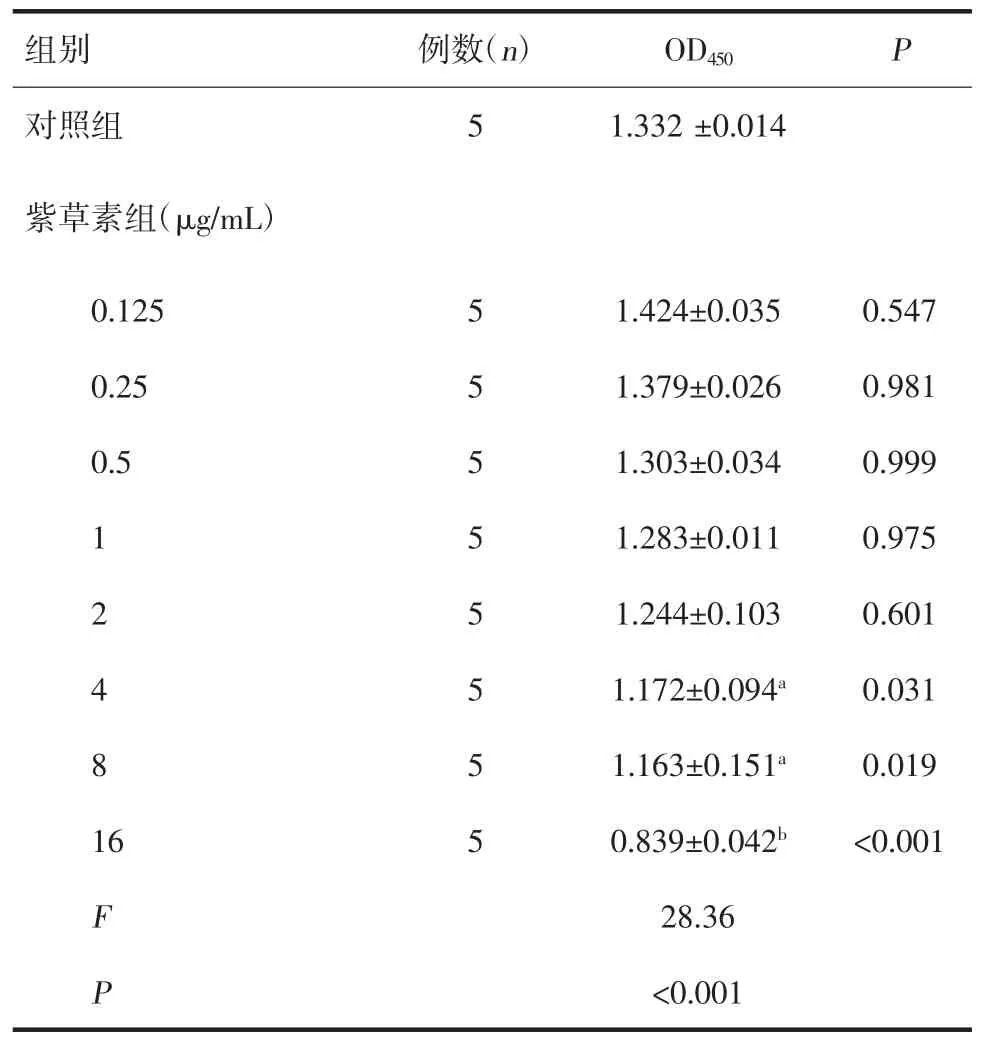
表1 不同浓度紫草素干预8 h 对中性粒细胞活性的影响
2.2 紫草素对中性粒细胞NETs 的影响 与对照组比较,模型组中NETs 相对荧光强度显著升高,差异有统计学意义(P<0.01)。与模型组比较,DNase I组及紫草素高、中、低浓度组的中NETs 相对荧光强度显著降低,差异有统计学意义(P<0.01),见表2。
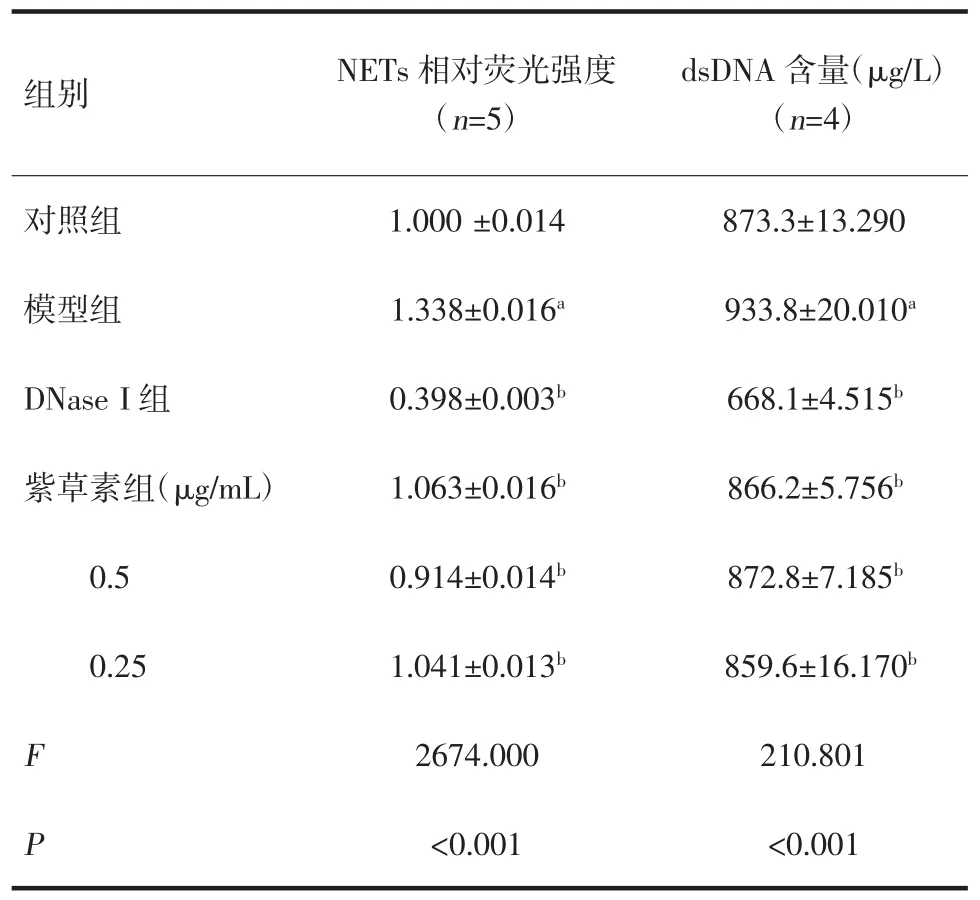
表2 不同浓度紫草素对中性粒细胞NETs 水平及dsDNA 含量的影响
2.3 紫草素对中性粒细胞dsDNA 含量的影响 与对照组比较,模型组dsDNA/NETs 含量显著增高,差异有统计学意义(P<0.01)。与模型组比较,DNase I组及紫草素高、中、低浓度组的dsDNA/NETs 含量显著降低,差异有统计学意义(P<0.01),见表2。
2.4 紫草素对中性粒细胞Cit-H3 表达的影响 与对照组比较,模型组中性粒细胞绿色荧光显著增强,Cit-H3 表达水平显著上调,差异有统计学意义(P<0.01)。与模型组比较,DNase I 组及紫草素高、中、低浓度组的中性粒细胞绿色荧光显著减弱,Cit-H3 表达水平显著下调,差异有统计学意义(P<0.01)。见图1、表3。
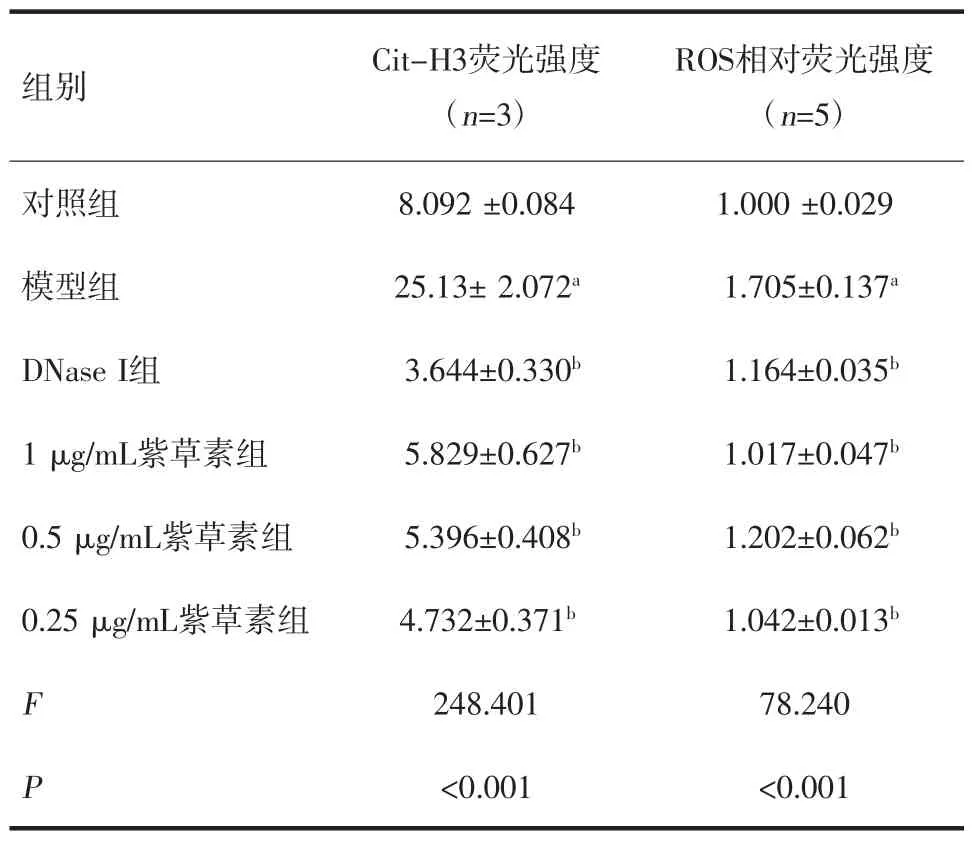
表3 不同浓度紫草素对中性粒细胞Cit-H3 表达及ROS 水平的影响
2.5 紫草素对中性粒细胞ROS 生成的影响 与对照组比较,模型组中性粒细胞ROS 生成显著升高,差异有统计学意义(P<0.01)。与模型组比较,DNase I 组及紫草素高、中、低浓度组的ROS 水平显著降低,差异有统计学意义(P<0.01),见表3。
3 讨论
糖尿病微环境激活中性粒细胞并释放大量NETs[10]。NETs 是一把双刃剑,高浓度的NETs 成分(组蛋白、杀菌肽、蛋白酶和ROS)可造成组织损伤,从而导致糖尿病创面愈合迟缓[11]。与健康人的中性粒细胞相比,糖尿病足溃疡患者的中性粒细胞更容易形成NETs,研究发现糖尿病足溃疡患者血液中NETs 及其相关生物标志物(Cit-H3、NE)的表达显著升高[12]。因此,抑制NETs 生成对于治疗糖尿病足溃疡至关重要。
PMA、细菌、损伤相关分子模式(DAMP)和细胞因子可通过TLR2、TLR4 或蛋白激酶1(RIPK1)/RIPK3/混合系激酶区域样蛋白(MLKL)途径激活PAD4,也可通过蛋白激酶C(PKC)、RAF/MEK/ERK途径诱导ROS 和MPO 生成并激活PAD4[13-15]。GMCSF、脂多糖、病原相关分子模式(PAMP)和C5a 诱导ROS 和MPO 产生并激活PAD4。以上途径均导致中性粒细胞PAD4 的激活,从而促进NETs 的形成[13]。此外,细胞外冷诱导RNA 结合蛋白(eCIRP)与髓系细胞触发受体1(TREM-1)结合并诱导细胞间黏附分子-1(ICAM-1)的表达,ICAM-1 介导Rho 激活,从而促进NETs 的释放[16]。此外,无论是无菌性创面中DAMP 介导的NETs 生成,还是感染性创面中PAMP 介导的NETs 生成,各种途径产生的ROS均可激活PAD4,引起染色质解聚并释放NETs。
目前以NETS 为靶向的治疗正成为促进伤口愈合的潜在趋势。DNase I 可降解NETs 结构,促进糖尿病小鼠创面再上皮化,从而加速伤口愈合[17]。治疗性抗瓜氨酸蛋白抗体(tACPA)可特异性地与组蛋白2A(Cit-H2A)和Cit-H4 中Cit3 的瓜氨酸结合,通过抑制中性粒细胞NETs 生成或促进巨噬细胞对NETs 的摄取与清除,减轻慢性炎症和局部组织损伤[18]。抗氧化剂硫化氢通过抑制ROS 介导的丝裂原活化蛋白激酶(MAPK)信号通路中细胞外信号调节激酶(ERK)1/2 和p38 的激活来抑制NETs 生成,并改善糖尿病创面的愈合[19]。含有PAD4 酶抑制剂的海藻酸-明胶甲基丙烯酰胺-支架可以抑制Cit-H3 表达,从而促进糖尿病小鼠创面愈合[20]。
皮肤伤口愈合是多因素共同参与,并高度协调、相互调控的复杂过程,包括止血、炎症、增殖和重塑四个阶段,涉及中性粒细胞、巨噬细胞、成纤维细胞和内皮细胞等多种细胞[21-22]。紫草具有凉血、活血、解毒透疹之功效,常用于治疗湿疹、皮炎、皮肤创面(疮疡、水火烫伤)及黏膜损伤等多种炎症性疾病。紫草素作为紫草的有效成分,通过抑制炎症介质的分泌,上调细胞因子如血管内皮生长因子(VEGF)、转化生长因子β(TGF-β)、血小板衍生生长因子(PDGF)和表皮生长因子(EGF)的产生,促进成纤维细胞增殖和迁移。紫草素可通过TLR4/核转录因子-κβ(NF-κβ)信号通路抑制脂多糖诱导的巨噬细胞炎症、下调氧化应激、降低半胱天冬氨酸酶-1(Caspase-1)活性抑制NLRP3 和AIM2 炎症小体的活化,发挥抗炎效应,促进人角质形成细胞和成纤维细胞增殖,有助于皮肤创伤愈合[7,23-25]。
中性粒细胞激活后,ROS 的生成是NETs 释放的关键[18]。PAD4 促使组蛋白上的精氨酸残基发生瓜氨酸化,这对于随后的染色质解聚和NETs 释放到细胞外环境中是必要的。本研究表明紫草素可抑制PMA 诱导的糖尿病小鼠中性粒细胞ROS 的生成,下调Cit-H3 水平从而抑制NETs 的生成,抑制炎症反应,来促进糖尿病创面愈合。
目前已知的靶向NETs 的药物主要是干扰NETs 结构和组分蛋白,包括DNase I、抗组蛋白抗体、PADs 抑制剂、NE 抑制剂以及ROS 清除剂等[26]。DNase I 只能清除已经生成的NETs,并不能从根本上阻止NETosis 的发生和蛋白水解导致的组织损伤[27]。PADs 抑制剂Cl-amidine 对PAD 缺乏选择性,体内半衰期短,活性相对较低、生物利用度有限且不良反应未知[28]。以NETs 为靶点的生物制剂具有稳定性差、制备复杂、价格昂贵等局限性,其治疗作用、毒性和耐药性仍有待大样本研究证实[29]。相比以上生物制剂,紫草素具有多靶点、多途径、疗效好、可持续、资源易得等优点[30],有望作为NETs抑制剂用于糖尿病创面的治疗。
本研究结果提示,紫草素在体外可通过下调PMA 诱导的糖尿病小鼠骨髓来源的中性粒细胞ROS 水平,抑制Cit-H3 表达,从而抑制NETs 释放,发挥抗炎作用,提示紫草素可用于与NETs 相关的糖尿病足溃疡等疾病的治疗,为临床进一步开发应用紫草素提供了实验依据。
