黄芩素对脑缺血性眩晕大鼠的影响及相关机制
2023-06-11刘峰李祥平项艳
刘峰 李祥平 项艳*
眩晕为临床上常见的症状,循环缺血是导致眩晕的常见原因,缺血性眩晕患者可发生脑部神经细胞受损,严重情况下能引起器质性改变和持久性神经功能障碍[1]。因此,如何解决缺血性眩晕患者脑部供血问题具有重要的临床意义。黄芩素具有广泛的药理作用,主要包括抗菌、抗病毒、抗氧化、抗肿瘤及保护心脑血管等[2]。黄芩素具有降低脑血管阻力,改善脑循环,增加脑血流量的作用,对脑血管和神经系统具有保护作用[3]。但黄芩素是否对缺血性眩晕具有治疗作用还不清楚。本研究通过手术和眩晕处理建立缺血性眩晕大鼠模型,观察黄芩素对缺血性眩晕大鼠的作用及潜在机制,为临床治疗缺血性眩晕提供理论支持。
1 材料与方法
1.1 实验动物 健康雄性SD 大鼠160 只,清洁级(SPF),体重180~200 g,购自杭州子源实验动物科技有限公司,SCXK(浙)2019-0004,本研究获医院伦理委员会批准。所有动物饲养于SPF 级动物房中,饲养时每笼3~4 只动物,自由饮水、摄食,12 h 光照/12 h 黑暗,温度20℃~25℃,相对湿度40%~70%。
1.2 主要试剂与仪器 黄芩素(批号:20200725,纯度:98%)购自成都德思特生物技术有限公司;盐酸氟桂利嗪购自美国MCE 公司;乳酸(LAC)、乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒购自南京建成生物工程有限公司;α-氨基丁酸B 受体R1(GABABR1)抗体和谷氨酸脱羧酶67(GAD67)抗体购自美国Santa 公司;GAPDH 抗体购自上海爱必信公司。VMR 小动物专用吸入麻醉机(美国Matrx);均质仪器(美国Omni 公司);H1850R 台式高速冷冻离心机(湖南湘仪);GelDoc XR 凝胶成像仪(美国Bio-rad)。
1.3 方法 (1)实验分组及给药:实验均分为假手术组、模型组、盐酸氟桂利嗪(0.5 mg/kg)组、盐酸氟桂利嗪(2 mg/kg)组、黄芩素(50 mg/kg)组、黄芩素(200 mg/kg)组,每组8 只SD 大鼠。盐酸氟桂利嗪以10%DMSO+40%聚乙二醇300+5%吐温-80+45%生理盐水配制0.2 mg/mL 和0.05 mg/mL 盐酸氟桂利嗪溶液。黄芩素以10% DMSO+40%聚乙二醇300+5%吐温-80+45%生理盐水配制20 mg/mL 和5 mg/mL 黄芩素溶液。所有药物均按10 mL/kg 进行腹腔注射给药。给药1 次/d,连续给药4 d。所有给药剂量均由预实验确定。(2)跳台逃避电刺激反射训练:每次给药后2 h 进行跳台逃避电刺激反射训练,开启5 个实验通道,刺激电压为32 V,实验时长为5 min。跳台潜伏期为大鼠对电刺激反应跳上平台并30 s 不跌落的时间。(3)迷宫逃避电击反射训练:每次给药后2 h 和6 h 进行迷宫逃避电击反射训练。设置刺激电压为50 V,电击延迟为5 s。将大鼠置于迷宫中适应3 min,而后进行训练并建立起稳定逃避电刺激反射。(4)脑缺血性眩晕模型大鼠构建:给药第4 天,大鼠采用异氟烷持续吸入麻醉。将大鼠仰卧位固定,剃去颈部毛,75%酒精消毒,剪开颈部皮肤,钝性分离右侧颈总动脉和右侧锁骨下动脉,穿线结扎,缝合皮肤。待脑缺血成功的大鼠清醒1 h 后给药,后禁食休息1 h。将大鼠固定于离心机转子架上,设置转速500 r/min,离心30 s 后骤停,模型构建完成。(5)各组大鼠跳台潜伏期检测:将模型大鼠放入跳台自动测试进行测试,记录大鼠跳台潜伏期。(6)各组大鼠迷宫逃避电击实验:将模型大鼠置于迷宫中适测试,记录大鼠成功逃避电击所用时间。(7)各组大鼠前庭神经核组织血流量检测:最后1 次给药1 h 后麻醉大鼠并分离右侧颈总动脉和右侧锁骨下动脉,穿线备用。大鼠在持续麻醉过程中仰卧位固定于脑立体定位仪上,定位大鼠右前庭神经核部位,以激光多普勒血流仪进行血流量检测,当记录正常血流量曲线后结扎右侧颈总动脉和右侧锁骨下动脉(除假手术组),记录第5 min、10 min、15 min、20 min、25 min、30 min 时血流量值,计算前庭神经核组织血流量降率。(8)各组大鼠LAC、LDH、SOD 及MDA 检测:实验结束后将大鼠脱臼处死,切取0.1 g 右脑组织于含有磁珠的非增强管中,加入1 mL 提取液(0.86%冷生理盐水),于均质仪上按4.85 m/s 匀浆20 s,随后3,000 r/min 离心10 min,取上层液,参照说明书检测上层液LAC、LDH、SOD 及MDA 水平。(9)蛋白印记实验检测脑GABABR 和GAD67 蛋白表达变化:提取各组大鼠脑组织蛋白并制备蛋白样品。通过SDS-PAGE电泳将蛋白样品的蛋白分离,而后将蛋白转至PVDF 膜上,封闭液封闭4 h。按需求加入GABABR1(1 ∶1,000)、GAD67(1 ∶1,000)或GAPDH 抗体(1 ∶4,000),摇床室温孵育2 h 后放于4℃冰箱孵育过夜。次日,洗去一抗,再加入相应的抗兔IgG-HRP 二抗(1:2,000)孵育1 h,PVDF 膜以ECL 发光试剂盒进行显色,凝胶成像仪下成像并读取灰度值。
1.4 统计学分析 采用SPSS17.0 统计软件。计量资料以(±s)表示。两组间比较采用t检验,多组间比较采用单因素方差分析,两两多重比较方法用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠跳台潜伏期比较 与假手术组比较,模型组大鼠跳台潜伏期增加(P<0.01);与模型组比较,盐酸氟桂利嗪和黄芩素各剂量组大鼠跳台潜伏期均缩短(P<0.01)。见表1。
表1 旋转刺激后各组大鼠跳台潜伏期变化[n=8,(±s)]
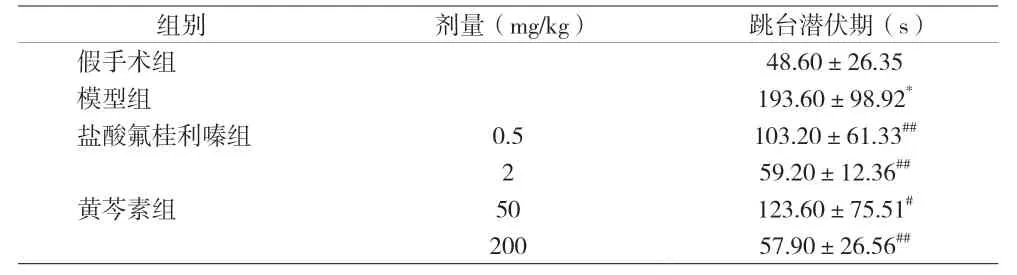
表1 旋转刺激后各组大鼠跳台潜伏期变化[n=8,(±s)]
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 剂量(mg/kg) 跳台潜伏期(s)假手术组 48.60±26.35模型组 193.60±98.92*盐酸氟桂利嗪组 0.5 103.20±61.33##2 59.20±12.36##黄芩素组 50 123.60±75.51#200 57.90±26.56##
2.2 各组大鼠迷宫逃避电击时间和进食量比较 与假手术组比较,模型组大鼠迷宫逃避电击时间增加(P<0.01);与模型组比较,盐酸氟桂利嗪和黄芩素各剂量组大鼠迷宫逃避电击时间缩短(P<0.01)。见表2。
表2 旋转刺激后各组大鼠迷宫逃避电击时间变化[n=8,(±s)]
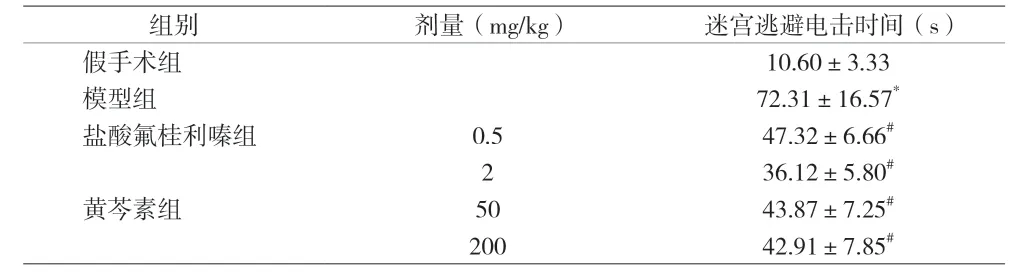
表2 旋转刺激后各组大鼠迷宫逃避电击时间变化[n=8,(±s)]
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.01
组别 剂量(mg/kg) 迷宫逃避电击时间(s)假手术组 10.60±3.33模型组 72.31±16.57*盐酸氟桂利嗪组 0.5 47.32±6.66#2 36.12±5.80#黄芩素组 50 43.87±7.25#200 42.91±7.85#
2.3 各组大鼠前庭神经核血流量比较 与假手术组比较,模型组大鼠前庭神经核组织血流量下降(P<0.01)。与模型组比较,盐酸氟桂利嗪各剂量组和黄芩素(200 mg/kg)组大鼠前庭神经核组织血流量增加(P<0.01),黄芩素组大鼠前庭神经核组织血流量增加(P<0.01)。见表3。
表3 各组大鼠前庭神经核血流量变化[n=8,(±s)]

表3 各组大鼠前庭神经核血流量变化[n=8,(±s)]
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.01
前庭神经核组织血流量降率(%)5 min 10 min 15 min 20 min 25 min 30 min假手术组 0.98±0.08 1.86±0.09 1.88±0.15 2.72±0.23 2.96±0.25 3.18±0.28模型组 19.26±1.25* 21.23±1.86* 23.58±2.12* 26.38±2.33* 29.93±2.25* 33.71±3.01*盐酸氟桂利嗪组 0.5 12.52±1.21# 14.38±0.86# 15.25±1.23# 17.89±1.35# 17.56±1.55# 20.31±1.82#2 8.63±0.62# 8.98±0.90# 7.37±0.71# 8.93±1.02# 10.65±1.03# 12.12±1.10#黄芩素组 50 18.30±1.62 20.12±2.10 20.37±2.00# 19.67±1.80# 21.36±1.91# 22.25±2.20#200 9.79±0.70# 10.58±2.02# 8.37±1.35# 9.39±1.25# 11.57±1.46# 13.20±1.55#组别 剂量(mg/kg)
2.4 各组大鼠LAC、LDH、SOD 及MDA 比较 与假手术组比较,模型组大鼠右侧脑组织LAC、MDA 及LDH含量增加,SOD 含量下降(P<0.01);与模型组比较,盐酸氟桂利嗪和黄芩素各剂量组大鼠LDH 和MDA 含量下降(P<0.01),黄芩素(200 mg/kg)组大鼠右侧脑组织LAC 含量降低,SOD 活力增加(P<0.01)。见表4。
表4 各组大鼠LAC、LDH、SOD及MDA变化[n=8,(±s)]
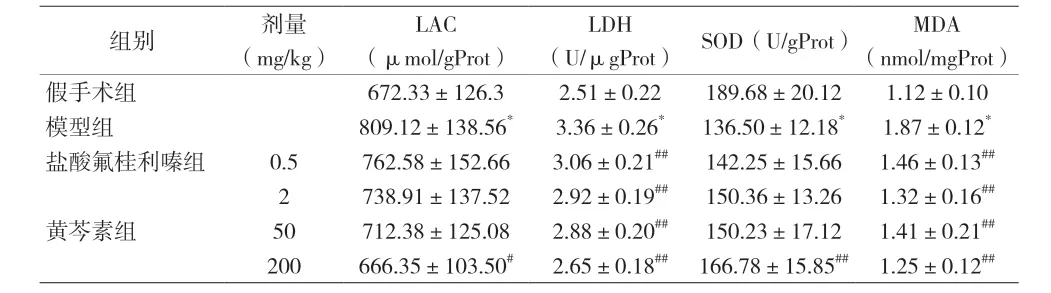
表4 各组大鼠LAC、LDH、SOD及MDA变化[n=8,(±s)]
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01
(U/μgProt) SOD(U/gProt) MDA(nmol/mgProt)假手术组 672.33±126.3 2.51±0.22 189.68±20.12 1.12±0.10模型组 809.12±138.56* 3.36±0.26* 136.50±12.18* 1.87±0.12*盐酸氟桂利嗪组 0.5 762.58±152.66 3.06±0.21## 142.25±15.66 1.46±0.13##2 738.91±137.52 2.92±0.19## 150.36±13.26 1.32±0.16##黄芩素组 50 712.38±125.08 2.88±0.20## 150.23±17.12 1.41±0.21##200 666.35±103.50# 2.65±0.18## 166.78±15.85## 1.25±0.12##组别 剂量(mg/kg)LAC(μmol/gProt)LDH
2.5 各组大鼠GABABR 和GAD67 蛋白表达比较 模型组GABAB R1 和GAD67 蛋白表达下调(P<0.01);与模型组比较,盐酸氟桂利嗪各剂量组对上述两种蛋白表达无影响,而黄芩素两个剂量组均能上调GABAB R1和GAD67 蛋白表达(P<0.01)。见图1 和表5。
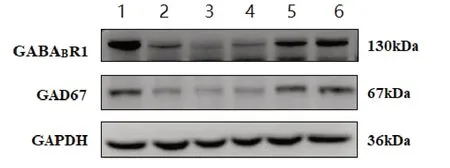
图1 各组大鼠GABAB R1和GAD67相对蛋白表达变化
表5 各组大鼠GABAB R1和GAD67相对蛋白表达变化(±s)
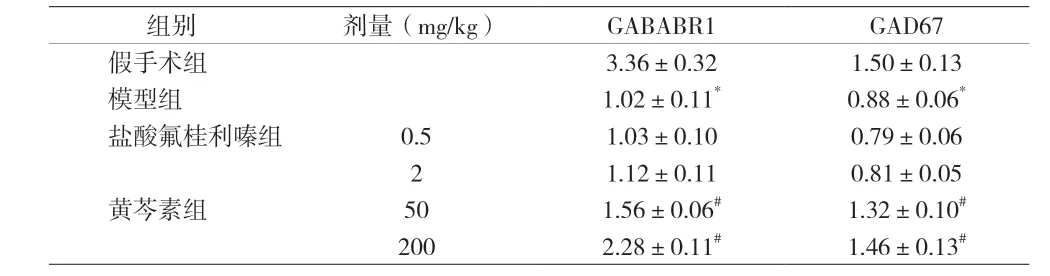
表5 各组大鼠GABAB R1和GAD67相对蛋白表达变化(±s)
注:与假手术组比,*P<0.01;与模型组比,#P<0.01
组别 剂量(mg/kg) GABABR1 GAD67假手术组 3.36±0.32 1.50±0.13模型组 1.02±0.11* 0.88±0.06*盐酸氟桂利嗪组 0.5 1.03±0.10 0.79±0.06 2 1.12±0.11 0.81±0.05黄芩素组 50 1.56±0.06# 1.32±0.10#200 2.28±0.11# 1.46±0.13#
3 讨论
缺血性眩晕患者一般会出现平衡失调、站立不稳、指物偏向等伴随症状,明显影响患者的生活质量。本研究构建的缺血性眩晕模型大鼠跳台潜伏期和迷宫逃避时间增加,前庭核血流量降低。跳台潜伏期和迷宫逃避电击能力是反映模型大鼠眩晕程度的重要行为学指标;而前庭缺血会导致前庭功能紊乱而引起眩晕。提示,缺血性眩晕大鼠模型构建成功。黄芩素缩短缺血性眩晕大鼠的跳台潜伏期和迷宫逃避电击时间的作用与阳性药盐酸氟桂利嗪相类似。二者还能增加缺血性眩晕大鼠的前庭核血流量。提示,黄芩素对缺血性眩晕大鼠具有较好的治疗作用。
通常认为,脑缺血涉及氧化应激损伤、能量代谢异常及神经细胞凋亡等多个方面。研究显示,缺血缺氧可产生大量氧自由基及其降解产物(如MDA),内源性自由基清除物(如SOD)不足以将过多的氧自由基清除。而过多的氧自由基可导致细胞膜脂质过氧化,细胞通透性增加,引起氧化损伤。研究显示,缺血性眩晕大鼠脑组织LAC、LDH、SOD、MDA 异常[4]。本研究发现,缺血性眩晕大鼠脑组织LDH、MDA 及LAC 活性/含量升高,而SOD 活力降低。而盐酸氟桂利嗪和黄芩素均能减弱LDH 和MDA 活性/含量,同时黄芩素还能增强SOD 活力并降低LAC 含量。提示黄芩素相较于盐酸氟桂利嗪,对缺血性眩晕大鼠脑部氧化损伤的保护作用可能更强。
GABAB R 是一种代谢相关受体,由GABAB R1和GABAB R2 异二聚体构成,主要存在中枢神经系统中[5]。GABAB R 可介导GABA 的生物学作用,其功能亢进或下降均会导致多种神经系统疾病,如癫痫、抑郁及认知障碍等[6]。值得注意的是,GABAB R 参与大鼠的认知发育,并通过介导蛋白激酶A(PKA)信号传导通路对空间学习进行严格控制[7]。还有研究显示GABAB R 参与改善脑部缺血缺氧小鼠的运动能力[8]。提示,GABAB R 可能在脑缺性眩晕中发挥作用。同时观察GABABR1 亚基的表达变化,结果发现脑缺血性眩晕大鼠GABABR1 表达下降,而黄芩素可上调该亚基水平。本研究还发现GAD67 蛋白在脑缺血性眩晕大鼠中表达下调,而黄芩素可逆转GAD67 表达。GAD67 是谷氨酸脱羧的异构体,是合成GABA 的主要限速酶[9]。提示,黄芩素可能通过促进GABA 合成,并上调GABAB R 表达而增强GABAB R 的介导作用,从而改善脑缺血眩晕大鼠的症状。
总之,黄芩素对脑缺血性眩晕大鼠具有治疗作用,该作用可能与增加前庭核血流量、降低氧化损伤及上调脑组织GABABR 和GAD67 蛋白表达有关。
