调节小胶质细胞反应性:糖尿病视网膜病变新见解
2023-06-10易静静圈启芳
易静静, 圈启芳,马 婕
(1. 青海大学 研究生院,青海 西宁 810000; 2.青海大学附属医院 a.内分泌科;b.血液科,青海 西宁 810000)
糖尿病视网膜病变(diabetic retinopathy,DR)是一种影响微血管和视网膜神经元的疾病,是导致个体视力丧失的重要原因。由于DR的临床特征主要涉及视网膜微血管的变化,一直以来,DR都仅被认为是一种由代谢紊乱导致内皮细胞损伤而引起的微血管疾病[1]。然而随着研究的不断深入,人们发现炎症在高血糖诱导DR的发病机制中起着关键作用,促使人们开始重新评估DR的触发因素[2-3]。随后发现,视网膜神经元在微血管损伤之前已经发生了病理变化,尤其是视网膜小胶质细胞的激活在DR的病理生理过程中起重要作用[2]。研究显示,视网膜局部炎症反应由位于视网膜丛状层的活化小胶质细胞介导,当遇到危险信号时,小胶质细胞从监视状态转变为激活状态,用于中和有害刺激并恢复组织内稳态[4]。然而,长期的组织应激使小胶质细胞过度活化,产生大量促炎细胞因子和趋化因子,从而导致神经炎症[5]。因此,为探究小胶质细胞是否是预防和治疗视网膜神经退行性疾病的重要靶点,本文就DR发生发展相关的小胶质细胞的激活及其对DR的影响,讨论了调节小胶质细胞介导的炎症反应在治疗该疾病中的可能性。
1 小胶质细胞
小胶质细胞作为中枢神经系统中常驻的免疫应答细胞,能产生和释放多种细胞因子、趋化因子、神经营养因子和神经递质,从而能与多种细胞类型相互作用,并根据组织环境在一定程度上发挥细胞毒性或细胞保护作用[6]。同时,小胶质细胞可以适应中枢神经系统的不同区域,在这些区域内小胶质细胞表现出不同的表面标记、密度和所占区域的形态。事实上,小胶质细胞基因的表达因脑组织的不同区域而有很大差异[7]。近来,利用脑小胶质细胞单细胞RNA序列测定,发现了9种不同转录状态的小胶质细胞,它们分别表达了独特的标记物[8]。类似地,在视网膜中,小胶质细胞同样被发现占据不同的区域,具有不同的功能,从而揭示了它们在稳态和疾病中的异质性。但在神经退行性变过程中,它们会重新定位到视网膜下间隙诱导疾病发生[9]。
小胶质细胞具有双重表型即促炎型(M1样表型)与抗炎型(M2样表型)。M1样表型主要是通过Th-1细胞因子、γ-干扰素或脂多糖等途径诱导,释放高水平的促炎因子,如肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1β、IL-6等[10]。在许多情况下,这种炎症对视网膜环境有益,一旦损伤或病原体得到处理,小胶质细胞就会下调促炎症反应,从而恢复到监视状态。与M1样表型相比,M2样表型表达与抑制炎症和恢复体内平衡有关的细胞因子和受体,包括IL-4、IL-10和精氨酸酶1在内的抗炎细胞因子,负责清除细胞碎片和坏死或凋亡细胞以维持内环境稳定[11]。同时,有研究表明,在体内,小胶质细胞似乎存在中间表型,当细胞表面受体检测到有害刺激时,小胶质细胞激活,从长而薄突起的分支状态,变为有更大的细胞体和更厚、更短突起的阿米巴样状态[12]。表明小胶质细胞可以通过调整其表型以满足需求,暗示着小胶质细胞可以作为预防和治疗视网膜神经退行性疾病的关键靶点。
2 DR中的小胶质细胞激活
小胶质细胞作为视网膜的常驻单核细胞,由于视网膜不同细胞类型和不同病理途径之间的复杂相互作用而被激活。一些动物模型已经被用于研究糖尿病中小胶质细胞的激活。例如:在链脲佐菌素诱导的糖尿病大鼠中,小胶质细胞从长而薄突起的分支状态,变为大而短的阿米巴样,并迁移至外丛状层和外感光层内[13]。在2型糖尿病的db/db小鼠模型中,在内核层发现活化的视网膜小胶质细胞,并在疾病早期从抗炎表型转变为晚期的促炎表型[12]。在氧诱导视网膜病变(oxygen-induced retinopathy, OIR)的小鼠模型中,发现具有增殖和迁移表型的常驻小胶质细胞占据了视网膜的缺血和新生血管区域[14]。同时使用OIR小鼠视网膜冷冻切片进行的研究表明,阿米巴样小胶质细胞存在于视网膜浅层和神经纤维层,并与新生血管有关[15]。而临床研究也证实了,DR患者的视网膜中同样存在小胶质细胞的激活[16]。此外,在DR患者视网膜内、外层中均观察到了活化的小胶质细胞聚集体,这表明活化小胶质细胞可能与视网膜病变的进展有关。
高血糖是糖尿病的典型特征,在DR进展过程中视网膜内葡萄糖水平升高参与诱导小胶质细胞激活,同时小胶质细胞也被认为是高血糖早期信号的第一个检测器, 见图1。一项BV-2小胶质细胞活性影响的研究中发现,从正常葡萄糖(5.5 mmol/L)到高葡萄糖(25 mmol/L)的转变促进了细胞生长,并诱导了氧化/炎症应激和小胶质细胞活化[17]。随着视网膜内葡萄糖浓度的增加,导致多元醇和己糖胺路径通量增加、细胞氧化应激、蛋白激酶C激活、线粒体电子传递链产生超氧化物以及晚期糖基化终产物(advanced glycation end products,AGEs)的增加和激活,在线粒体中产生大量自由基,进一步增加氧化应激,诱导小胶质细胞活化,导致视网膜的慢性低度炎症[18-19]。同时,AGES和AGES受体之间的相互作用可诱导小胶质细胞的促炎表型,从而导致炎性细胞因子如TNF-α等的分泌增加[20]。高血糖环境也可通过活性氧诱导小胶质细胞活化,活性氧的增加介导活化B细胞核因子-κB(nuclear factor kappa-B,NF-κB)轻链增强子核移位和小胶质细胞中的细胞外信号调节激酶(extracellular regulated protein kinases,ERK)磷酸化,从而产生多种细胞因子,如TNF-α、IL-1β、IL-6、血管细胞黏附分子-1和血管内皮细胞黏附分子1,诱发视网膜内皮细胞功能障碍和白细胞停滞,导致多种免疫细胞在血管表面聚集,使视网膜血管阻塞、缺血和血-视网膜屏障(blood-retinal barrier,BRB)功能障碍[3]。高血糖还可以激活血管内皮生长因子表达、低氧诱导因子-1向细胞核的移位以及小胶质细胞中的ERK1/2NF-κB信号通路[21-22]。此外,在OIR小鼠模型的病理性血管生成过程中,发现糖酵解增加导致乙酰辅酶A产生增加,诱导组蛋白乙酰化,并将小胶质细胞重新编程为支持新生血管形成的血管生成表型,表示促炎小胶质细胞产生细胞因子的维持依赖于糖酵解[23]。总之,高血糖诱导由小胶质细胞协调的一系列细胞事件,驱动了DR相关的病理生理学,在触发小胶质细胞激活和导致DR炎症介质释放的分子事件中起着关键作用。
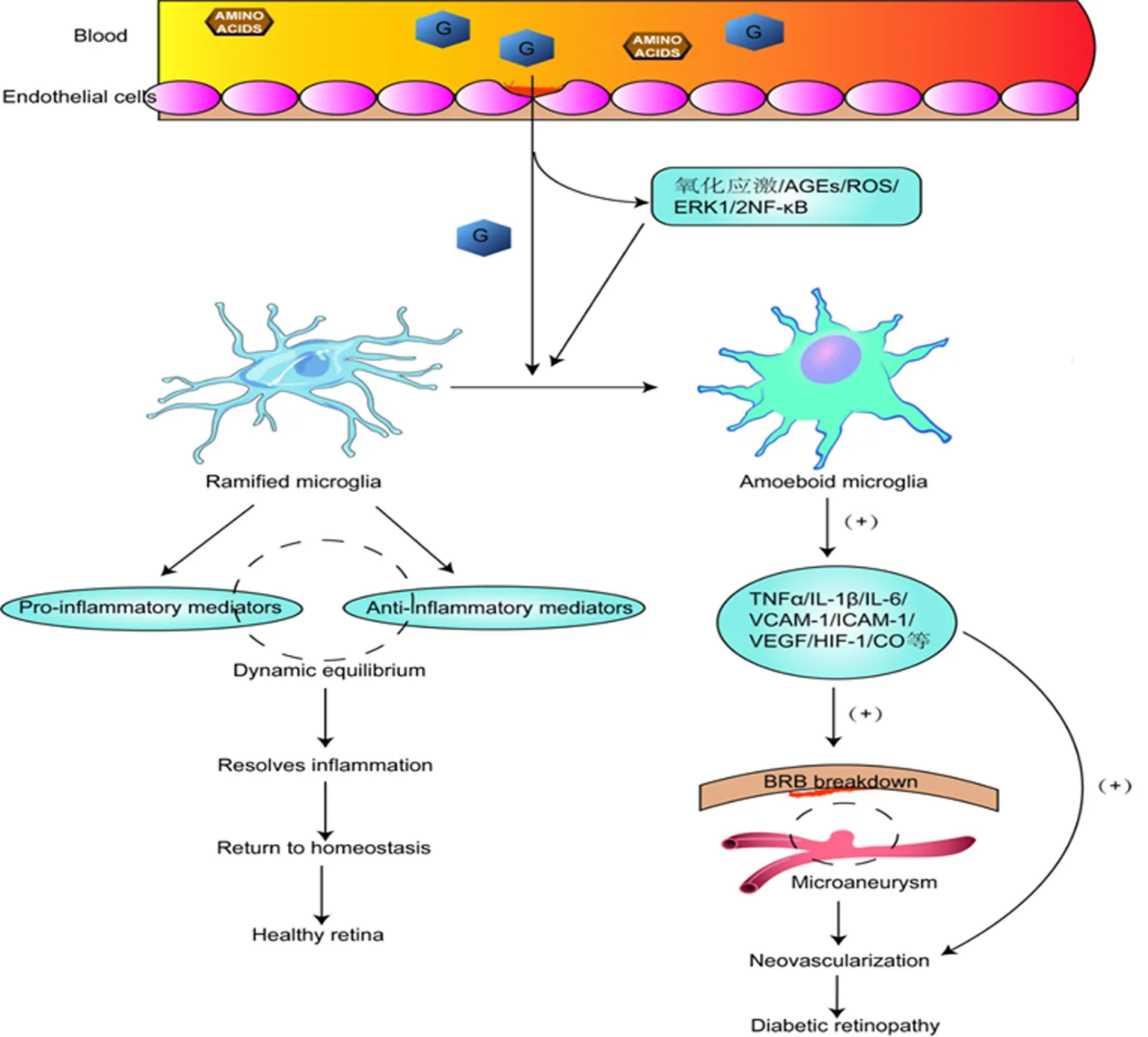
图1 DR中小胶质细胞激活及其炎性作用
3 小胶质细胞相关炎症对DR的影响
在DR开始时,BRB提供了一个物理屏障,阻止循环细胞进入视网膜,这使得小胶质细胞和其他视网膜细胞成为视网膜的唯一免疫哨兵[10]。正常情况下,小胶质细胞活化具有保护作用,但在某些情况下导致小胶质细胞活化紊乱便会产生严重影响,包括血管破裂、细胞功能障碍和神经元死亡等[24]。在DR的早期阶段,小胶质细胞的炎症反应是纠正性的,以维持循环中促炎细胞因子和抗炎细胞因子共存为特征,解决炎症并提高神经元的存活率[25]。然而,随着葡萄糖浓度的增加,高血糖状态和其他组织损伤,包括各种细胞因子介导的炎症反应在糖尿病视网膜细胞中高度表达,使小胶质细胞激活失调产生反作用,触发已经具有神经毒性的小胶质细胞过度分泌促炎因子阻止抑制炎症的能力。此时,小胶质细胞倾向于极化为M1促炎型而不是M2抗炎型,从而加剧炎症,导致BRB受损和DR的病理恶化[26-27]。
3.1小胶质细胞活化对BRB破坏的影响 在DR中,活化的小胶质细胞参与BRB的破坏。在实验性DR研究中,与视网膜血管内皮细胞紧密接触的变形样小胶质细胞增多,同时活化的小胶质细胞穿透内层BRB的基膜并吞噬内皮细胞,导致内层BRB分解[28]。在糖尿病小鼠模型中发现,视网膜色素上皮(retinal pigment epithelium,RPE)可分泌大量血管内皮生长因子,进而触发小胶质细胞向RPE的募集;同时,小胶质细胞衍生的TNF-α降低了RPE细胞中闭塞带的蛋白质水平,从而破坏DR中外部BRB[29]。BRB分解后,使循环细胞因子和趋化因子进入视网膜实质,这些细胞与过度激活的小胶质细胞一起推进DR的发病。
3.2小胶质细胞活化对视网膜神经元的影响 在糖尿病动物模型中,神经元细胞丢失早在高血糖诱导后5周就开始了,但周细胞毛细血管的密度没有差异,表明神经退行性变先于已确定的临床和形态学血管变化[30-31]。视网膜中神经保护介质和和神经毒性因子的生成失衡参与了DR神经退行性变的发展。活化的M1型小胶质细胞分泌大量神经毒性因子,如谷氨酸、半胱氨酸天冬氨酸蛋白酶-3、基质金属蛋白酶和氧化亚氮等,导致神经细胞功能障碍以及周细胞和内皮细胞损伤[32]。尤其是谷氨酸,其对视网膜神经节神经元危害极大,谷氨酸在细胞外的堆积使得离子型谷氨酸受体过度激活,引起细胞内钙超载和细胞死亡,进而导致神经元的凋亡[33]。然而,在视神经挤压模型中发现,2型小胶质细胞吞噬的轴突碎片比1型小胶质细胞多[34]。故小胶质细胞活化与视网膜神经元损伤之间的关系仍需进一步研究。
4 调节小胶质细胞反应性在DR中的作用
在神经退行性疾病中,小胶质细胞增殖并改变其形态,这一过程被称为“反应性小胶质细胞增生”。有学者提出,调节小胶质细胞反应性可作为对抗神经退行性疾病的治疗策略。例如,在阿尔茨海默症中,n-3多不饱和脂肪酸的抗炎和抗氧化作用与其将小胶质细胞表型从M1转换为M2的能力有关[35]。
鉴于小胶质细胞相关炎症在DR中的临床重要性,小胶质细胞反应性的调节被视为治疗糖尿病性黄斑水肿和DR的一种有前途的策略。有研究发现,合成的孕酮类似物去甲孕酮通过存在于小胶质细胞上的孕酮受体发挥作用,在rd10小鼠色素性视网膜炎模型中减少促炎M1并刺激抗炎M2表型,保护感光细胞的活力和视觉功能[36]。此研究为通过将小胶质细胞转变为M2表型来靶向治疗神经炎症提供了新的见解。随后Al-Dosary等[37]发现,姜黄素,槲皮素和高良姜素作为有效的小胶质细胞调节剂,它们均有效改善了小鼠DR模型的疾病结局。此外,米诺环素是一种半合成四环素类似物,属于抑制小胶质细胞活化的药物,通过抑制TNF-α、IL-1β、一氧化氮、环氧合酶和前列腺素的表达,在小胶质细胞上显示出抗炎和抗凋亡特性[38]。在另一项视网膜光损伤研究中,米诺环素抑制小胶质细胞增生及光诱导的视网膜损伤,抑制转运体蛋白的表达[39]。芝麻素同样作为小胶质细胞调节剂,一项研究中提到其可以抑制高葡萄糖诱导的炎性细胞因子的mRNA水平,激活NF-κB信号通路,通过降低活性氧水平和增加视网膜小胶质细胞中的抗氧化酶来降低氧化应激,缓解BRB分解,减少炎症[40]。同时,Fang等[41]在链脲佐菌素诱导的糖尿病大鼠实验中发现,积雪草酸通过TLR4 / MyD88 / NF-κB p65等途径抑制M1和促进M2,从而调节小胶质细胞极化来改善早期DR。
5 小结
小胶质细胞的过度激活及促炎细胞因子、趋化因子水平升高是DR病理学的重要标志。调节小胶质细胞反应性有望改变视网膜的免疫环境,从而防止神经退行性变和与DR进展相关的后续异常。抑制M1和促进M2可能在未来的DR管理中具有重要的临床意义。然而,将小胶质细胞作为DR进展阶段的关键调节因子,未来仍需要进行大量临床前研究。
