罕见肾上腺神经纤维瘤1例并文献复习
2023-06-10罗杰,吴强,李忠,郑硕
罗 杰,吴 强,李 忠,郑 硕
(1.河北医科大学 研究生院,河北 石家庄 050000; 2.河北医科大学第一医院 泌尿外科,河北 石家庄 050000)
神经纤维瘤起源于神经外膜、束衣、神经内膜或轴索,可能发生在神经末端或沿神经干的任何部分,常见于皮肤、头部和颈部、躯干和四肢,按肿瘤国际组织分类,属于良性肿瘤[1]。出现在肾上腺的情况极为罕见, 为进一步了解神经纤维瘤的临床特点,提高对其的诊治水平,本文回顾性分析我院收治的1例神经纤维瘤患者的临床资料,并结合已发表的相关文献进行总结复习,现报道如下。
1 临床资料
患者男,21岁,未婚,汉族,消防员。因“右侧腰腹部疼痛10 d,检查发现右侧肾上腺肿物8 d”于2021年9月23日入院。入院记录:患者10 d前无明显诱因出现右侧腰腹部疼痛,为胀痛,外院行腹部平扫CT提示右侧肾上腺占位。住院体检:体温37.0 ℃;脉搏71次/min;呼吸18次/min;血压131/61 mmHg。双肺呼吸音清,心律规则,腹平坦,无压痛。专科体检:双侧肋脊角对称无隆起,未触及包块,右肾区轻度敲击痛。自发病以来未出现心绞痛、心悸、心率加快、全身疲倦等症状。既往体健。检查血、尿常规,凝血功能和生化指标均正常。肾上腺功能检查:皮质醇8时为9.83 μg/dl。醛固酮卧位56.76 ng/L,立位82.66 ng/L。血管紧张素Ⅱ卧位28.82 ng/L,立位37.42 pg/ml。直接肾素卧位9.92 mIU/L,立位51.57 mIU/L。促肾上腺皮质激素卧位19.32 ng/L,立位14.78 ng/L,均在正常范围内。心电图、心脏彩色超声、胸部CT无异常。腹部增强CT示:左侧肾上腺大小、形态均在正常范围内。右侧肾上腺显示不清,右侧肾上腺区可见团块影,边界清晰,其内可见斑点状致密影,增强后呈持续性不均匀强化,CT值约47 HU、50 HU、64 HU, 见图1。影像诊断:右侧肾上腺占位性病变,考虑良性肿瘤性病变可能性大。根据患者病史、体检及辅助检查,初步诊断为右肾上腺肿瘤。
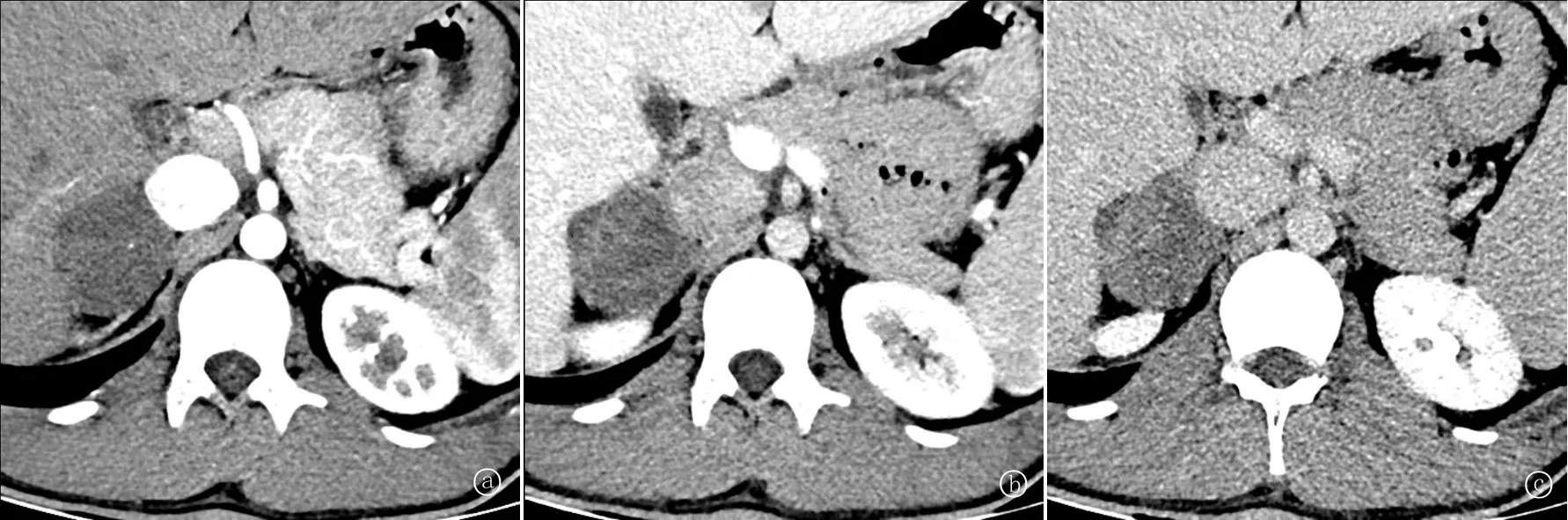
图1 增强CT检查 a:动脉期,右侧肾上腺区可见团块影,边界清晰,紧邻下腔静脉,其内可见斑点状致密影,CT值约47 HU;b:门脉期,肿物与右肾上级毗邻,分界较清,CT值约50 HU;c:延迟期,CT值约64 HU
治疗及预后:拟行手术治疗,按照嗜铬细胞瘤的术前准备,口服酚苄明并积极扩容2周,在此期间,血压维持在125/75 mmHg(1 mmHg=0.133 kPa),心率维持在70次/min。完善术前准备,患者于2021年9月28日在全身麻醉下行腹腔镜下右肾上腺肿瘤切除术。于右肾上极可见约6.0 cm椭圆形肿物,有包膜,质韧,活动度差。肿物与肾上腺、腹膜、下腔静脉粘连较重,分离困难,沿肿物仔细分离后,用Hem-o-Lock夹夹毕并离断肾上腺中央静脉,超声刀配合Hem-o-Lock夹离断肾上腺上动脉,完整切除肿物及少部分右肾上腺,包膜完好无损,肿瘤无破裂或残留物。手术顺利,手术期间血压和心率无波动。术后病理报告:右侧肾上腺肿瘤,灰黄灰红组织一块,大小6.5 cm×5.5 cm×4.0 cm。可见包膜,临床已切开,切面呈多结节状,灰白实性、质软,局部结节质硬,可见少许肾上腺组织,见图2。免疫组化结果:CK(-),CD34(血管+),Vim(+++),CD117(-),ALK(-),SMA(-), actin(-), Ki-67(+),Bc1-2(-), Dog-1(-), Melan-A(-), Myogenin(-)。符合肾上腺神经纤维瘤(adrenal neurofibroma, ANF)。患者术后予以肾上腺皮质激素补充治疗3 d,复查肾上腺CT检查提示:右侧肾上腺正常术后变化,拔除引流管并好转出院。患者在手术后1个月首次到医院进行随访,总体情况良好,无心绞痛、疲劳、意识模糊、心率加快、血压下降等。复查激素水平均在正常范围,目前仍在随访中。
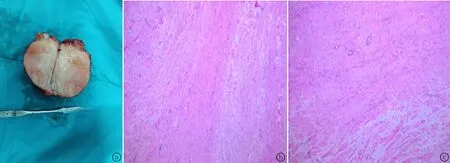
图2 肿瘤剖面及病理图片 a: 手术切除肿物,大小约6.5 cm×5.5 cm×4.0 cm,可见包膜,切面呈多结节状,灰白实性质软,局部结节质硬,可见少许肾上腺组织;b~c:术后病理图片,光镜见梭形细胞及神经纤维末梢,间质黏液样变,未见异常核分裂及细胞异型性(HE染色,×100)
2 讨 论
检索2021年9月前发表的ANF相关国内外文献报道,并列举其基本临床信息[2-24]。ANF发病年龄为16~71岁,但以青中年发病率最高。其中女性病例占61%(17/28),男女比例为11∶17。大多数肿瘤无内分泌功能,有功能的肿瘤占32%(9/28)。肿瘤位于右侧肾上腺占60%(18/30)。瘤体均为单发,直径为2~16 cm。30例患者均行开腹或者腹腔镜手术切除肿物。病理均证实为ANF,其中免疫组化提示有S-100(+),CD34(+),Vim(+),Ki-67(+),CD68(+), Pcatenin(浆+),STAT6(+),GFAP(+),CD99(+),EMA(+/-),Syn(+),SMA(+),NF(+),NSE(+),S-100阳性率达87%(13/15)。术后0.5~84个月的随访,无复发或转移的报道。见表1。
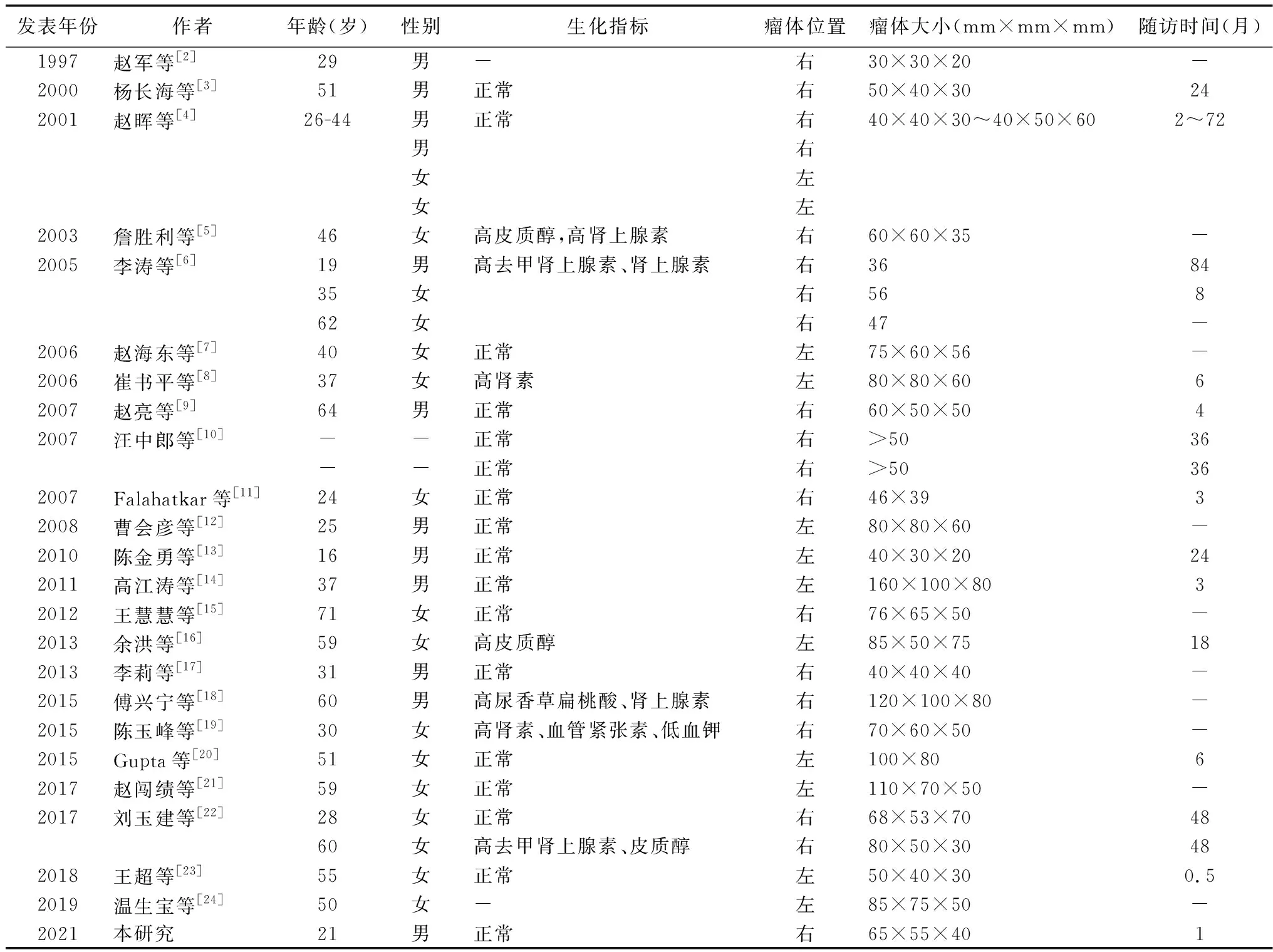
表1 肾上腺神经纤维瘤相关病例报道
本病生长十分缓慢,大多数患者没有临床表现,很难发现病灶,导致临床上容易出现误诊及漏诊情况[19]。查阅并总结以往文献发现,ANF因体检发现而入院占57%(17/30),本组患者为青年男性,因右侧腰腹部疼痛,检查发现右侧肾上腺肿物入院。ANF患者大多体健,无相关基础疾病。而2017年刘玉建等[22]报道了1例60岁女性患者高血压3级极高危,但手术已明确与肿瘤本身无关。2007年赵亮等[9]报道1例64岁男性患者体检发现血压升高5年, 给予络活喜治疗后血压恢复正常,术中见右肾上腺附着于瘤体,考虑为肿瘤压迫肾上腺所致。当ANF患者合并有一些基础疾病时,应行详细的相关检查或请专科会诊,避免影响手术进展或者预后,可为患者带来更多受益。
结合本例CT的影像结果,并根据有关文献报道,总结出ANF的基本影像表现:平扫多表现肾上腺区域单发类圆形或不规则形肿块影,大多呈稍低密度或等密度,少数可见点状、片状钙化,大多数肿瘤与相邻组织分界清,肿块内部密度均匀或不均匀,包膜基本完整,平扫CT值一般为30 HU左右。增强扫描无或有连续不均匀强化,无区域淋巴结转移。以往文献报道中有7例提示肿瘤与邻近组织关系密切,占23.3%,左侧提示左肾上极、腹主动脉、胰腺、脾脏等器官受压移位,右侧提示右肾上极、肝脏、下腔静脉受压移位改变。大多数肿瘤与相邻组织分界清,且增强扫描提示轻中度或明显强化,可呈细线状、结节状。然而刘玉建等[22]发现1例CT增强扫描可见肿瘤内小血管穿行影及腹膜后小淋巴结显示,临床极为罕见。温生宝等[24]也发现1例增强扫描可见左膈下动脉进入病灶,临床也很少见到。虽然CT不能明确诊断肿瘤性质,但依然是术前必做检查之一。因ANF临床少见,这对影像科医生专科经验要求高,行肾上腺良性肿物CT判断时,应想到ANF的可能,有时也需注意动静脉与肿物的关系。
由于MRI、超声、尿路平片和静脉尿路造影在评估腰腹部疾病中也开始得到广泛应用。ANF的MRI显示T1加权像的信号相同或略低,T2加权像的信号相同或略高。增强扫描显示病变表面明显增强和快速廓清,但没有内部增强。超声波检查显示相应区域包块有实质轻度低回声,边缘完整并且光滑,肿瘤中没有明显的血流信号。尿路平片和静脉尿路造影检查可有轻度同侧肾脏下降。超声、CT及MRI通常情况下均可发现病灶,行上述检查可提高术前对肿瘤的诊断及评估,对患者预后有积极作用。
ANF是腹膜后罕见肿瘤,一般情况下主要与肾上腺瘤、皮质腺癌、嗜铬细胞瘤、节细胞神经瘤等相鉴别:①肾上腺瘤[25]:通常具有明确边界的单侧类圆形肿块。由于细胞中脂肪含量高,普通扫描通常密度低且均匀,CT值一般小于10 HU。大多数增强扫描显示瞬态快速增强,具有快速清除的特点;②肾上腺皮质腺癌:肿瘤体型大,形状不规则,与周围组织边界不明确,密度不均匀。肿瘤有囊性退化、坏死和出血,常见斑点和节点状钙化,肿瘤很容易侵入、包围周围的血管或形成肿瘤栓塞,可见外周淋巴结的部分入侵和转移;③嗜铬细胞瘤:肾上腺常见疾病,由于肿瘤可以分泌激素,典型的阵发性或持续性高血压和代谢紊乱经常出现在临床上,CT扫描肿瘤往往为圆形、类圆形包块、体积较大,大多形态规则,边界清晰,包膜完整,CT扫描显示等密度或密度略低。增强扫描显示明显的不均匀增强;④节细胞神经瘤:肾上腺罕见疾病,CT检查通常显示低密度,肿瘤通常是圆形,且显示有针点钙化,有包膜和可见的边界,并且经常推动或包围周围的组织及血管,增强扫描上并不明显。鉴别诊断是临床一大难点,不仅要从CT上详细分辨肿物,还需根据疾病病因、症状、体征等多方面考虑。
目前大多数学者认为手术是ANF的主要治疗措施。如果肿瘤没有内分泌功能或影像学无恶变征象,且直径小于3 cm,应辅助CT随访3~6个月。Bertagna等[26]认为对于无内分泌功能的肾上腺肿瘤,如果直径大于6 cm,有恶变可能,建议手术切除。Poyhonen等[27]报道ANF以良性病变为主,少数可恶变神经鞘瘤,尤其是肿瘤直径大于6 cm高度怀疑恶性,恶变率可达8%。Isler等[28]还报道了药物、放射治疗对ANF通常无效,并且还有诱发肿瘤恶变的潜在危险。因此手术为本病的首选治疗方法,随着泌尿外科腔镜技术的提高及应用指征在不断放宽,目前手术治疗的金标准是腹腔镜肾上腺肿瘤切除术。和以往的开放手术切除相比,腹腔镜手术具有损伤小、视野宽敞、减少了住院时间、相关并发症低等众多优点。ANF也可通过后腹腔镜技术安全有效地切除肾上腺肿物[29],经腹膜后入路游离并切除肾上腺及肿物更方便,多采用侧卧位,腹膜后入路因不受腹腔脏器的压迫或者干扰,术中对腹膜内位器官损害更少,且术后并发症更少。手术范围根据肿瘤与肾上腺或者周围组织粘连情况决定,和术者手术经验及熟练程度也有很大关系,目前有单纯肿物切除或联合肾上腺全切术两种基本术式。近些年,许多学者认为应尽可能保留正常肾上腺组织,这样可以保证患者肾上腺功能,还能减少因长期激素使用带来的不良反应。若无法避免全切,术后应密切观察激素水平及临床表现,必要时补充激素治疗,以免出现肾上腺危象。
ANF确诊需病理检查,ANF是一种无包膜的肿瘤,主要由外周神经的相关成分混合组成,包括施万细胞、神经鞘细胞、轴突、成纤维细胞和神经束细胞,呈纺锤形,细胞核呈波浪形,散在含有不同量黏蛋白和胶原的细胞外基质中,常显示S-100蛋白呈强阳性和弥漫性阳性。Gupta等[20]认为ANF病理上主要与神经鞘瘤、平滑肌瘤和嗜铬细胞瘤相鉴别。神经鞘瘤有清楚的包膜,细胞细长,核两端尖,呈蛇状排列,可见Verocay小体,常有少细胞和富细胞两个区域。平滑肌瘤细胞排列成平行束状、交错状,细胞核两端钝,免疫组化显示平滑肌肌动蛋白和结蛋白呈阳性。嗜铬细胞瘤是激素活跃的肿瘤,突触素和嗜铬粒蛋白均呈阳性,缺乏S-100蛋白反应性。
总之,ANF是极其罕见的良性神经源性肿瘤,因其大多数无临床症状,容易误诊和漏诊,且影像学无法定性而导致术前诊断困难,最终诊断需依靠病理检查。发现肿瘤后可行手术完整切除,后腹腔镜在治疗此病时具有一定优势。应该尽可能保留正常的肾上腺组织,术后可预防使用激素防止肾上腺功能低下[28]。ANF预后良好,但不能排除恶性转化和复发的可能性。仍需定期复查超声、CT和生化功能,以免延误病情。
