白藜芦醇对动脉粥样硬化模型动物血脂、斑块面积及炎症因子影响的Meta分析
2023-06-09王秋燕潘兴寿
王秋燕,潘兴寿
(1.右江民族医学院附属医院心内科,广西百色 533000;2.右江民族医学院研究生学院,广西百色 533000)
动脉粥样硬化(atherosclerosis,AS)可致心肌梗死、中风等严重威胁人类生命健康的疾病[1],给社会经济及健康造成沉重负担。AS的发病机制仍未完全阐明,目前认为主要与内皮细胞受损、脂质沉积、泡沫细胞产生、炎症、氧化应激、平滑肌细胞(SMCs)增殖等相关[2]。AS的临床治疗以他汀类、贝特类、盐酸类药物调节血脂水平,阿司匹林、氯吡格雷抗血小板聚集等为主。在药物应用中,他汀类药物地位举足轻重,但长期和过量使用会出现肝损害、肝坏死、肾损害、肌病、体外细胞毒性等不良反应[3]。而双抗药物会引起消化道出血的风险。AS作为一种慢性疾病,大多数患者需要长期甚至终身服用这些相关药物,长期使用药物增加了副作用发生的风险,同时随着使用时间延长,可能出现药物耐受,治疗效果减退。AS患者多为老年人,基础疾病多,身体各器官功能下降,长期药物的使用降低了用药安全性[4]。因此研制新的抗AS药物具有重要意义。中药因其多靶点、多通道的治疗优势,在预防及治疗AS中的作用被日益重视。白藜芦醇是一种天然的多酚类化合物,在葡萄、花生、虎杖、红酒中均有丰富含量。其具有抗炎、抗氧化、改善血脂等作用[5]。动物实验是临床试验的基础,可为临床用药的指导提供证据,目前较多研究认为白藜芦醇抗AS有显著效果,但研究较为分散、独立,为进一步研究白藜芦醇对AS的作用,本研究拟通过系统评价的方法梳理白藜芦醇对AS动物模型血脂、粥样斑块面积、炎症因子的影响,为白藜芦醇在临床的应用提供证据。
1 资料与方法
1.1 文献检索策略通过计算机检索中国知网、万方、中国生物医学文献数据库(CBM)、PubMed、EMBASE、Cochrane图书馆数据库。搜集白藜芦醇治疗动脉粥样硬化模型动物实验文献,检索时限从建库至2022年9月15日,通过主题词和自由词进行检索。中文数据库检索词为:动脉粥样硬化、动脉硬化、粥样动脉硬化、白藜芦醇。英文数据库检索词为:Atherosclerosis、Atheroscleroses、Atherogenesis、Resveratrol、trans Resveratrol、Resveratrol 3 sulfate、cis Resveratrol、trans Resveratrol 3 O sulfate。
1.2 文献筛选及资料提取由两位研究员独立进行文献检索,按照文献的纳入标准及排除标准独立筛选文献并进行资料提取,若结果不一致或存在分歧,则进行讨论或咨询第三方解决。资料提取内容如下:①第一作者,发表年份;②实验对象:动物品种、性别、体重;③造模方式;④动物模型;⑤实验组与对照组已排除实验过程中死亡的数量;⑥实验组的干预措施;⑦结局指标;⑧干预时间。
1.3 纳入研究的偏倚分析通过对动物实验偏倚风险评估工具SYRCLE中的10个条目进行分析。包括:①分配序列的产生或应用;②各组基线是否相同或是否对混杂因素进行调整;③分配隐藏;④实验过程中动物是否被随机安置;⑤是否对动物饲养者和研究者施盲;⑥结果评价中动物是否经过随机选择;⑦是否对结果评价者采用盲法;⑧不完整的数据是否被报告;⑨研究报告是否与选择性结果报告无关;⑩是否不存在明显会产生高风险偏倚的其他问题。低风险偏倚用“是”表达, 高风险偏倚用“否”表达,不确定风险偏倚用“不确定”表达。
1.4 纳入标准①研究对象为动物品种、雌雄不限,AS建模方式不限,AS模型动物于主动脉肉眼或病理切片染色观察到AS斑块可认为造模成功;②研究类型为随机对照的动物实验;③实验对象的干预措施:实验组采用白藜芦醇,剂型、剂量不限,若研究中选用不同剂量的白藜芦醇,则选用最高剂量。对照组为不同造模方式的AS动物模型组。
1.5 排除标准①非RCT文献;②体外试验、临床研究和综述类、经验总结、评论及讲座文献;③重复发表的文献或同一研究;④不包含结局指标的文献;⑤动脉粥样硬化合并其他疾病模型;⑥原始资料无法提取,无法获取全文的文献;⑦与其他方式结合治疗的治疗方式。
1.6 结局指标主要指标:血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、主动脉斑块面积。 次要指标:肿瘤坏死因子(TNF-α)、白介素1β(IL-1β)。
1.7 统计学方法采用RevMan 5.4软件进行Meta分析。本研究纳入的结局指标均为连续型变量资料,采用标准化均数差(SMD)及95%可信区间(CI)为效应量。纳入的研究使用卡方检验进行异质性检查,若I2≤50%,则表明异质性小,采用固定效应模型。若I2>50%,则表明异质性大,采用随机效应模型,并进行敏感性分析、亚组分析找出异质性来源,结果使用森林图表达。最后绘制漏斗图进行发表偏倚的评估。
2 结 果
2.1 纳入的文献情况通过检索数据库,共检索出文献614篇,中文文献416篇,英文文献198篇。其中中国知网132篇,万方284篇,EMBASE14篇,PubMed 87篇,Cochrane图书馆10篇,CBM 87篇。使用NoteExpress文献管理软件排除重复文献143篇,阅读题目、摘要后排除430篇,阅读全文后根据纳入标准、排除标准,排除文献28篇,最终纳入13篇文献[6-18]。文献检索流程见图1。

图1 文献筛选流程图
2.2 纳入文献基本特征纳入的文献均采用随机对照的动物实验,4项研究[9-11, 17]使用新西兰兔,1项研究[6]使用日本大耳兔,2项研究[13-14]使用SD大鼠,3项研究[8, 15, 18]使用ApoE-/-小鼠,1项研究[7]使用SPF级ApoE-/-小鼠,1项研究[12]使用SPF级小鼠,1项研究[16]使用Wistar大鼠。在造模方面,10项研究[6-11, 14-17]采用高脂饮食喂养方式进行AS模型建立,2项研究[12-13]采用高脂饮食+腹腔注射维生素D的方式进行造模,1项研究[18]使用喂养AIN-76饮食进行造模。在干预措施上,实验组使用白藜芦醇进行治疗,若研究中选用不同剂量的白藜芦醇,则选用最高剂量组的实验数据。纳入文献的基本信息见表1。
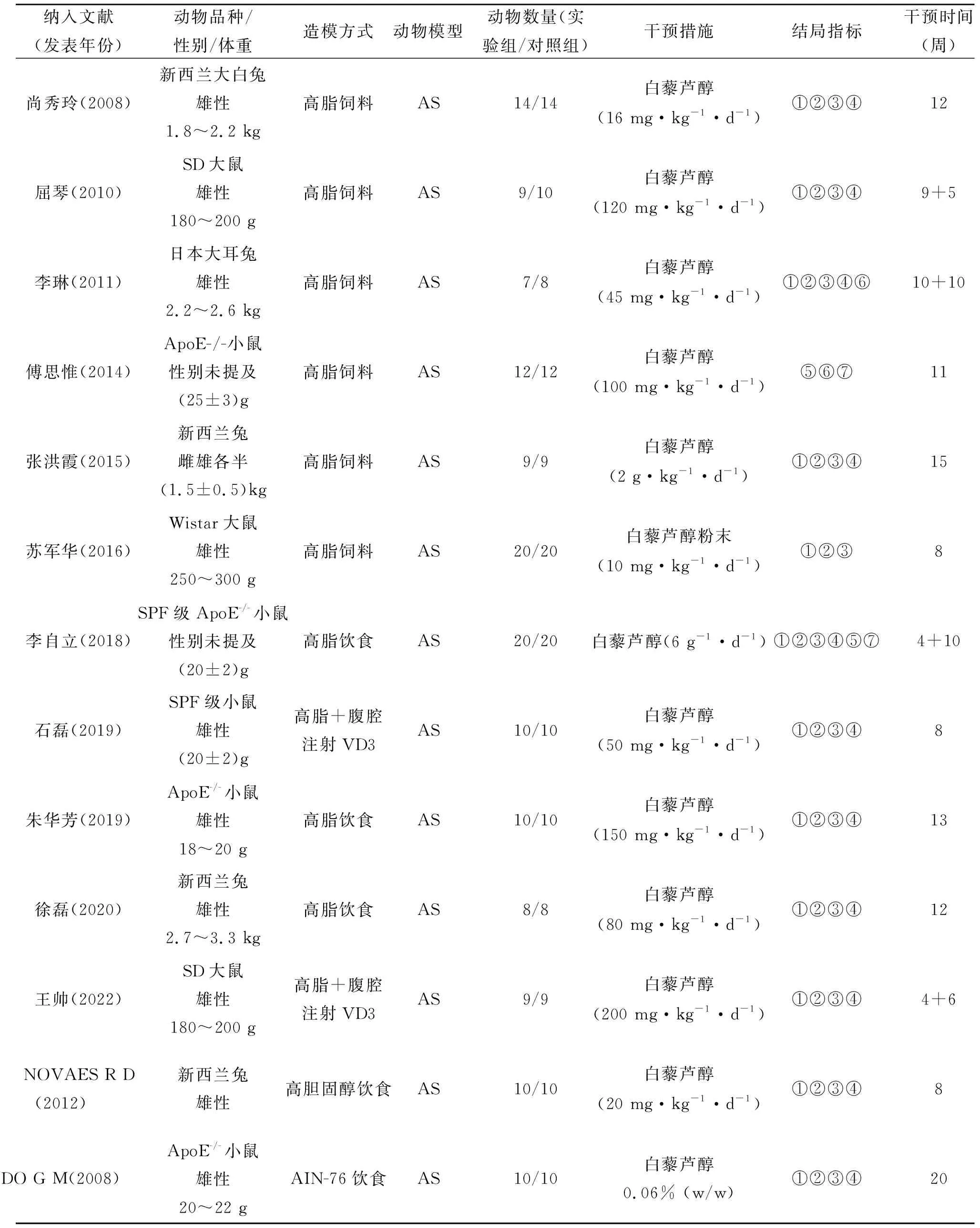
表1 纳入文献的基本信息
2.3 纳入研究的偏倚风险评估本研究纳入动物实验研究共13个,其中中文文献11篇[6-16],英文文献2篇[17-18]。见表2。
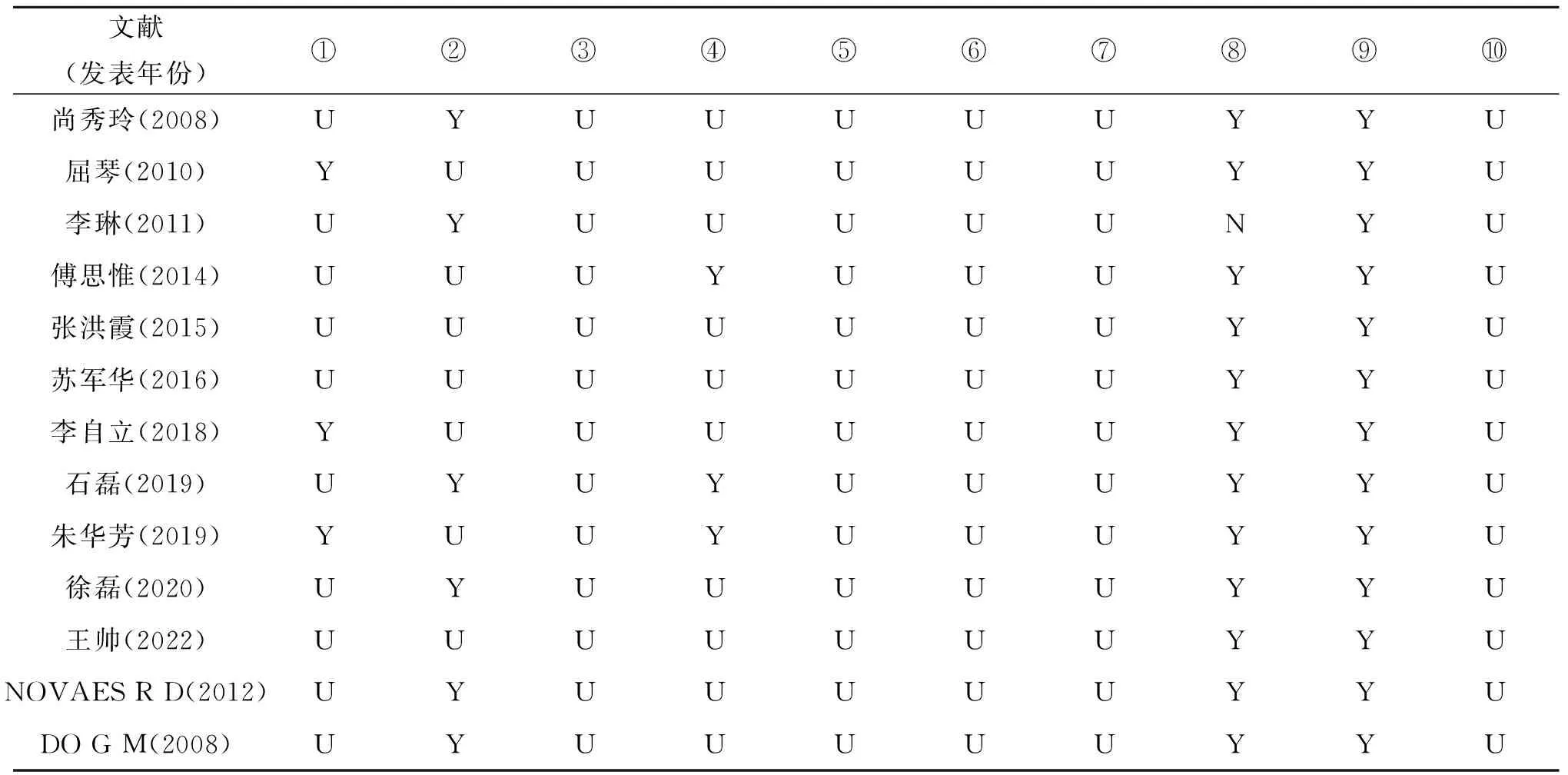
表2 纳入研究的偏倚风险评估结果
2.3 Meta分析结果
2.3.1 TC结果分析12项研究[6-14, 16-18]报告了AS动物模型血液TC水平的变化,各研究之间异质性较大(P<0.00001,I2=86%),采用随机效应模型,Meta分析结果显示:实验组血液TC水平低于对照组,差异有统计学意义[SMD=-2.68,95%CI(-3.63,-1.74),P<0.01]。提示白藜芦醇可以降低血液TC水平。见图2。

图2 两组TC比较的森林图
2.3.2 TG结果分析共12项研究[6-14, 16-18]报告了AS动物模型血液TG水平,研究之间异质性较大(P<0.0001,I2=88%),采用随机效应模型,Meta分析结果显示:实验组血液TG水平低于对照组,差异有统计学意义[SMD=-2.20,95%CI(-3.13,-1.27),P<0.01]。提示白藜芦醇可以降低血液TG水平。见图3。
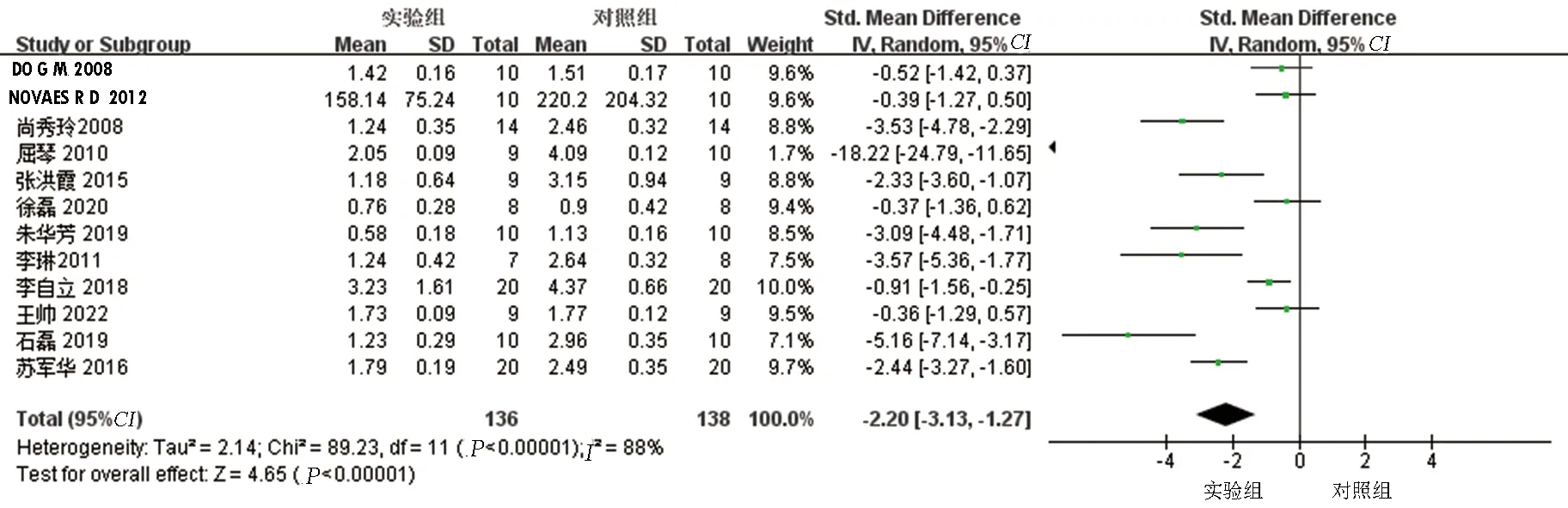
图3 两组TG比较的森林图
2.3.3 LDL-C结果分析共12项研究[6-14, 16-18]报告了AS动物模型血液LDL-C水平,研究之间异质性较大(P<0.00001,I2=93%),采用随机效应模型,Meta分析结果显示:实验组血液LDL-C水平低于对照组,差异有统计学意义[SMD=-4.00,95%CI(-5.53,-2.47),P<0.01]。提示白藜芦醇可以降低血液LDL-C水平。见图4。

图4 两组LDL-C比较的森林图
2.3.4 HDL-C结果分析共11项研究[6-14, 17-18]报告了AS动物模型血液HDL-C 水平,研究之间异质性较大(P<0.00001,I2=92%),采用随机效应模型,Meta分析结果显示:实验组血液HDL-C水平高于对照组,差异有统计学意义[SMD=2.79,95%CI(1.45,4.13),P<0.01]。提示白藜芦醇可以提高血液HDL-C水平。见图5。
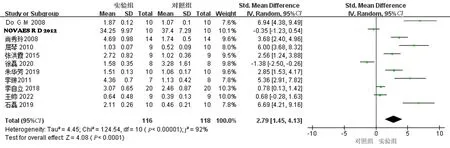
图5 两组HDL-C比较的森林图
2.3.5 主动脉斑块面积结果分析共2项研究[7,15]报告了AS动物模型主动脉斑块面积的变化,研究之间异质性大(P=0.05,I2=75%),采用随机效应模型,Meta分析结果显示:实验组主动脉面积低于对照组,差异有统计学意义[SMD=-2.84, 95%CI(-4.29,-1.38),P<0.01]。见图6。
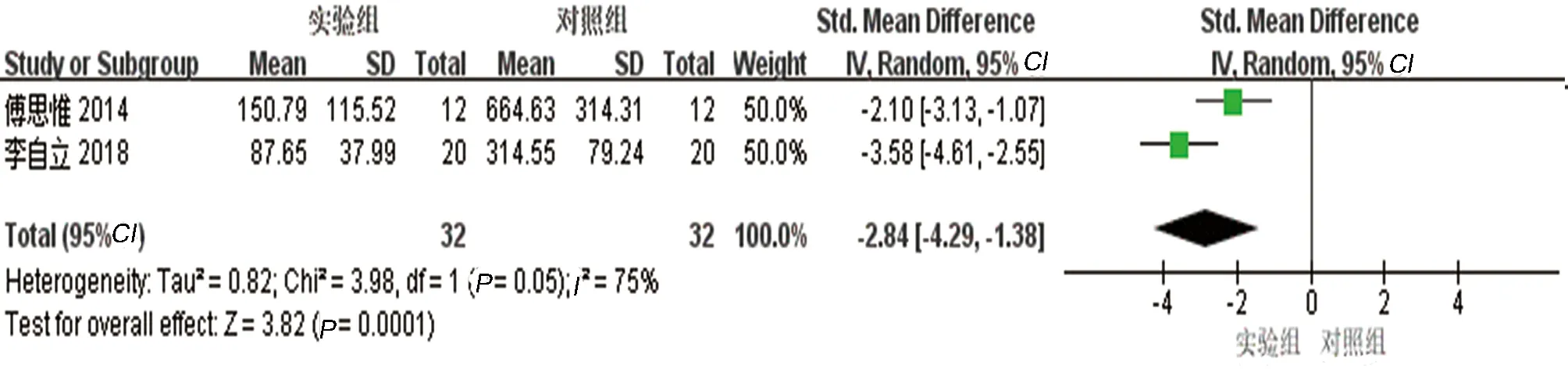
图6 两组主动脉斑块面积比较的森林图
2.3.6 TNF-α结果分析共2项研究[6,15]报告了AS动物模型血液TNF-α水平,研究之间异质性较大(P<0.0001,I2=94%),采用随机效应模型,Meta分析结果显示:实验组TNF-α水平与对照组相比,差异无统计学意义[SMD=-43.97,95%CI(-118.41,30.47),P=0.25]。见图7。

图7 两组TNF-α比较的森林图
2.3.7 IL-1β结果分析共2项研究[6,15]报告了AS动物模型血液IL-1β水平,研究之间异质性较大(P=0.0004,I2=92%),采用随机效应模型,Meta分析结果显示:实验组IL-1β水平与对照组相比,差异无统计学意义[SMD=-38.79,95%CI(-88.28,10.70),P=0.12]。见图8。
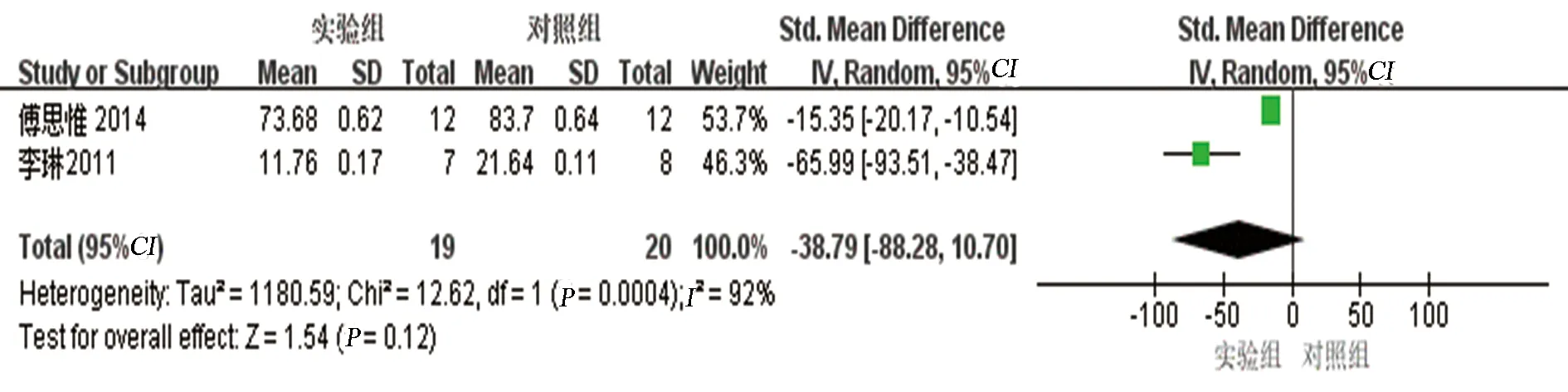
图8 两组IL-1β比较的森林图
2.4 敏感性分析TC、TG、LDL-C、HDL-C通过逐一删除文献的方法寻找异质性来源,结果显示异质性无显著降低,表明该Meta分析结果是相对稳健的。余指标因纳入文献数量少,无需进行敏感性分析。
2.5 亚组分析在AS血脂管理中,主要的靶目标降低LDL-C水平,其降低被广泛认为可减少心血管疾病的发生。本研究对LDL-C水平进行亚组分析以寻找异质性来源。通过不同实验动物种属分为兔子、小鼠、大鼠三组,结果提示各亚组间仍存在异质性(见图9)。提示不同种属的动物不是异质性来源。通过不同时期的干预分为预防性研究及治疗性研究2组,结果提示亚组间仍有异质性(见图10)。提示异质性不来源于白藜芦醇不同时期的干预。通过干预时间不同分为≤8周、9~16周、≥17周三个亚组,结果提示≥17周这一亚组无明显异质性,但其他两组仍存在较高异质性(见图11)。提示干预时间可能为异质性高的原因之一。
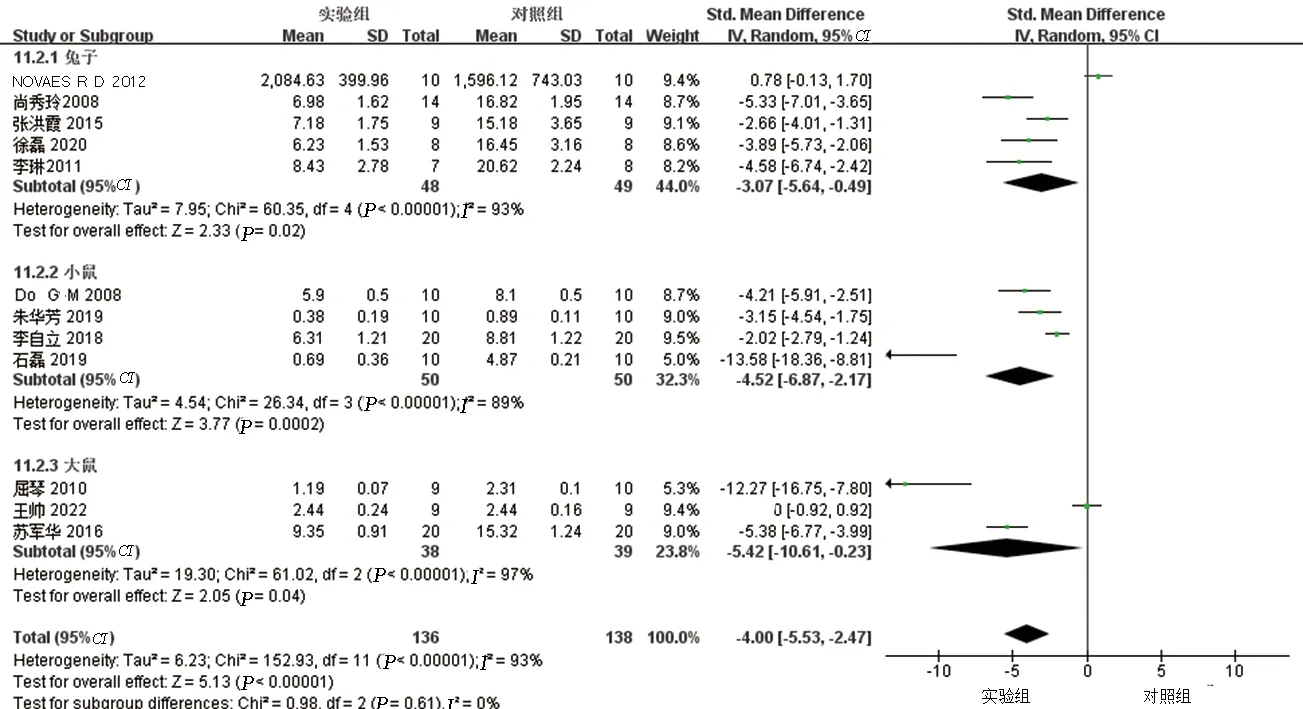
图9 LDL-C不同种属动物亚组分析森林图
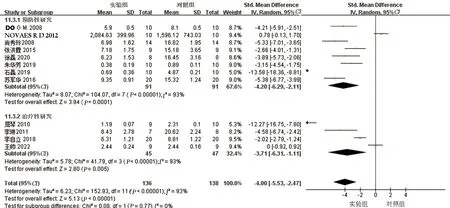
图10 LDL-C不同干预时期亚组分析森林图
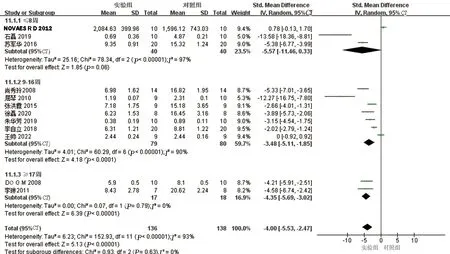
图11 LDL-C不同干预时间亚组分析森林图
2.6 偏倚风险分析对TC、TG、LDL-C、HDL-C结局指标进行漏斗图绘制进行偏倚风险分析,结果提示,各结局指标漏斗图呈现出不完全对称分布,不除外存在一定程度的偏倚,考虑可能与纳入研究质量低、样本量少、相对于阳性结果,阴性结果较难发表有关。见图12-图15。
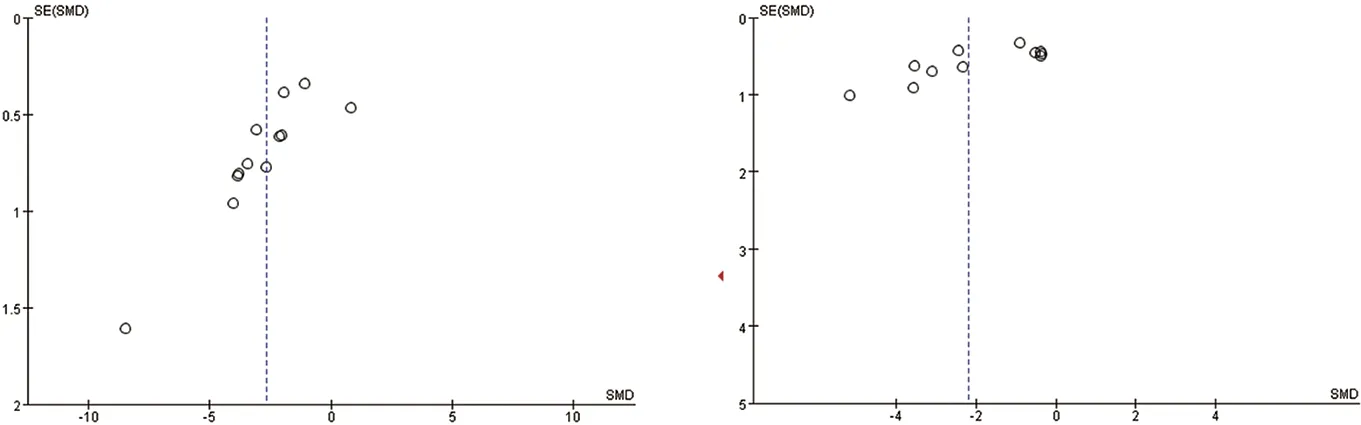
图12 TC漏斗图 图13 TG漏斗图
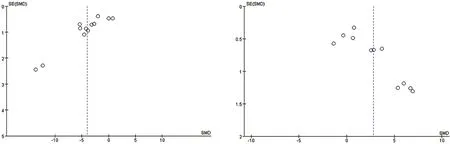
图14 LDL-C漏斗图 图15 HDL-C漏斗图
3 讨 论
AS是一种炎性疾病,作为心脑血管疾病的病理基础,是心肌梗死、脑血管意外等疾病发生的重要因素,严重威胁人类生命健康,给社会经济带来巨大负担,因此AS的治疗一直备受关注。目前AS以西药治疗为主,西药治疗具有起效迅速的特点,但长期使用副作用大、安全性低,具有局限性。AS发病机制多样,也使得具有多靶点、多途径治疗优势的中药备受关注,越来越多的中药被用于抗AS。且中药多来源于天然植物,副作用小。而白藜芦醇可在AS的不同阶段,通过调脂、抑制炎症等途径发挥抗AS的作用[19]。
在此次研究中观察到,白藜芦醇实验组与AS动物模型对照组相比,白藜芦醇可降低AS动物模型血液中TC、TG、LDL-C的水平。同时观察到白藜芦醇可升高AS动物模型血液的HDL-C水平。结果表明在AS动物模型中,白藜芦醇在调节血脂上具有显著效果,可以很好地改善AS动物血脂水平。TC、TG、LDL-C的异常是形成、加重AS的发生发展的重要因素,其中,LDL-C是公认的AS血栓性心血管疾病的致病风险因素,LDL-C被氧化修饰成氧化低密度脂蛋白(oxLDL)后可刺激血液中的单核细胞进入内膜并向巨噬细胞分化,巨噬细胞吞噬oxLDL产生泡沫细胞,而泡沫细胞是形成斑块的重要细胞。LDL-C也是AS治疗的重点关注指标。HDL-C通过胆固醇逆转运,可发挥抗AS的作用,因此升高HDL-C 在改善AS的发生及发展中有重要意义。
在此次研究中,白藜芦醇实验组与AS动物模型对照组相比,白藜芦醇组主动脉粥样斑块面积减少。提示白藜芦醇可以有效抑制斑块的形成或发展。粥样斑块糜烂、破溃、血栓是导致心脑血管等意外事件的病理生理基础,引起心脑血管急症的高发病率、致残率、病死率,促进粥样斑块的逆转,在AS的治疗中有重要意义。
本研究发现,白藜芦醇可降低AS动物模型TNF-α、IL-1β的水平,但实验组与对照组比较差异无统计学意义,考虑与纳入研究数量较少有关。AS作为一种炎性疾病,炎症反应在AS发生发展的各个阶段均有参与。TNF-α、IL-1β是NF-κB信号通路下游常用于表达炎性程度的炎症因子。TNF-α与血管炎症反应相关,是强的促炎因子,可通过介导多个途径促进AS的发展,其可通过诱导多种炎症因子的产生扩大炎症反应,与AS的病变程度相关。IL-1β为高效致炎因子,可通过上调内皮细胞上黏附分子的合成及增加血管平滑肌细胞的活化和增殖促进AS的发展。因此促进炎症因子的下降有助于AS的治疗。
本次研究的局限性:①纳入研究中未对白藜芦醇的自身特性进行相关描述,可能会影响结果的准确性。②纳入研究中AS建模方式不同,使用动物品种不一,干预剂量不一,干预周期不同。不同种属的动物,使用不同的造模方法会导致所形成斑块存在一定的差异,可能会造成选择上的偏倚。③纳入的研究中,只有3项研究提及分配隐藏及动物随机安置,均未提及盲法,存在研究方法质量较低的现象,可能出现测量偏倚及选择性偏倚等潜在的偏倚风险。④纳入研究的中文文献居多,可能造成语言、地域上的偏倚。⑤纳入研究数量及样本量较少,个别结局指标相关报道少,对该部分结果需持谨慎态度。
虽然本研究仍存在着不足,但通过运用Meta分析的方法,显示白藜芦醇具有改善AS动物模型血脂代谢、斑块面积及炎症反应的作用。但本研究因纳入的研究方法学质量不高、样本量少的限制,今后仍需更为科学、高质量的研究进行数据的补充及进一步的验证,以及开展大样本、高质量、设计严谨的实验进行更为深入的研究探索。
