敲低WTAP表达抑制脑胶质瘤干细胞的增殖、迁移和侵袭
2023-06-09赵海洋吴环立李琳坤
刘 祯 赵海洋 吴环立 李琳坤
胶质瘤是颅内最为常见的原发性恶性肿瘤,大约占中枢神经系统恶性肿瘤的80%。在胶质瘤中,一半以上为恶性程度最高的胶质母细胞瘤,以快速侵袭生长和反复复发为特点,临床预后极差[1]。同其他恶性肿瘤一样,胶质母细胞瘤存在异质性,其中胶质瘤干细胞(glioma stem cell,GSC)是胶质瘤起始和复发的来源,也是胶质瘤侵袭生长和对放化疗抵抗的重要原因[2]。研究显示,GSC 是胶质瘤治疗的关键,只有针对GSC 的治疗方法才能有效遏制胶质瘤的 生 长[3]。Wilms 肿 瘤 抑 制 因 子(Wilms tumor suppressor factor,WTAP)是一种在人体内广泛表达的核蛋白。有研究显示WTAP在胶质瘤中高表达且能通过调控AKT 通路来影响胶质瘤细胞的生长、侵袭[4]。本文探讨敲低WTAP表达对GSC增殖、迁移和侵袭的作用。
1 材料与方法
1.1 GSC 分离及鉴定术中获得胶质瘤标本后,将标本组织尽可能剪碎至形成悬浊液,然后300 g 离心5 min,取沉淀并用5 ml 已活化的木瓜蛋白酶溶液(生工生物工程有限公司)重悬,混匀后37 ℃培养箱中消化30 min,每10 min 取出重悬混匀1 次,消化完毕后过40 μm 滤膜,取过滤液300 g 离心5 min,GSC 培养基重悬沉淀后置于培养箱中培养。GCS培养基为无血清培养基,由DMEM/F12(美国Gibco公司)中加入1%N2(美国Gibco 公司)、2%B27(美国Gibco 公司)、0.04%EGF(美国Invitrogen 公司)、0.02%FGF2(美国Invitrogen 公司)配置,GSC 贴壁培养时需预先应用laminin(美国Sigma 公司)包被培养皿。应用定量PCR 检测干细胞标记物SOX2 的表达量,通过加入TGF-β促进分化后检测其SOX2、血管周细胞标记物α-SMA和PDGFRb 的表达检测其分化能力。HU⁃VEC 细胞购自武汉普诺赛生命科技有限公司,并使用该公司提供培养基培养。
1.2 转染实验应用lipofectamine2000(美国Invitro⁃gen 公司)将WTAP shRNA 和阴性对照shRNA(由武汉金开瑞生物有限公司提供)转染GSC。将GSC 接种24 孔板(5×104个/孔),培养箱孵育过夜,应用50 μl无血清培养基分别稀释0.5 μg的质粒和1 μl的li⁃pofectamine2000 转染试剂,将两者充分混匀后分散滴加到细胞中,qRT-PCR检测转染效率。
1.3 qRT-PCR 检测mRNA 表达量应用RNA 提取试剂盒[天根生化科技(北京)有限公司]提取细胞总RNA,应用M-MLV逆转录酶体系(日本Takara公司)逆转录为cDNA,应用SYBR Green I 嵌合荧光法(美国Bio-rad 公司)进行荧光定量分析,以β-actin 为内参,应用2-ΔΔCt法计算目标基因的相对表达量。引物序列:内参β-actin 正义链5'-CTCTTCCAGCCTTCC TTCCT- 3',5'- AGCACTGTGTTGGCGTACAG- 3';WTAP 正义链5'-GCCAACTGCTGGCGTGTCT-3',反义链5'-ATGGCGAAGTGTCGAATGCT-3';SOX2 正义 链5'-CACAACTCGGAGATCAGCAA-3',反 义 链5'-CGGGGCCGGTATTTATAATC-3';α-SMA 正义链5'- CAATGAGCTTCGTGTTGCCC- 3',反 义 链5'-GCAAGGCATAGCCCTCATAGA-3';PDGFRb 正义链5'-GCTGTTACCCACTCTGGGAC-3',反义链5'-TG⁃GTGTCCTTGCTGCTGATG-3'。
1.4 细胞增殖实验应用MTT试剂盒(上海碧云天生物技术有限公司)检测细胞增殖能力。将GSC 接种96孔板,每孔1 000个细胞,培养基100 μl每孔,培养至预定时间后加入5 μl MTT(5 mg/ml)培养4 h,加入100 μl 裂解液、37 ℃裂解4 h,测定570 nm 波长处吸光度。
1.5 细胞侵袭、迁移实验应用Transwell 小室(美国Corning公司,8 μm膜)检测细胞迁移及侵袭能力,小室下层提前铺入HUVEC细胞以诱导GSC迁移,迁移实验直接进行实验,侵袭实验上下两层小室之间铺基质胶(美国Corning公司),培养至预定时间后对发生转移的底部细胞进行DAPI 染色计数。迁移实验时间为24 h,侵袭实验为3 d。
1.6 免疫印迹实验收取待测定细胞六孔板,吸出培养基并用PBS 洗涤后每孔加入200 μl RIPA 裂解液(北京Biosharp 公司)裂解,超声裂解细胞后10 000转/min 离心10 min,离心温度4 ℃,取上清液应用BCA试剂盒(上海碧云天生物技术有限公司)测定蛋白浓度,加入上样缓冲液配置为蛋白样本,100 ℃煮10 min,行SDS-PAGE 电泳(恒压电泳80 V、30 min,之后120 V),电泳分离满意后200 mA 恒流转膜,蛋白转移到PVDF 膜,5%脱脂牛奶封闭液封闭1 h,一抗4 ℃孵育过夜,二抗室温孵育2~4 h 后显影分析。应用Image J 软件进行灰度值分析。内参GAPDH 抗体购自武汉三鹰生物技术有限公司(1:100 000),AKT 抗体(1:1 000)及pAKT 抗体(1:2 000)购自美国Cell Signaling Technology 公司,二抗购自武汉三鹰生物技术有限公司(1:5 000)。
1.7 统计学方法应用SPSS 21.0软件分析;计量资料以±s表示,采用t检验;计数资料用χ2检验;P<0.05为差异有统计学差异。
2 结果
2.1 GSC的鉴定GSC高表达干性标记物并具备一定条件下分化的能力。GSC 完全培养基和用TGFβ替换EGF 和FGF 的培养基分别培养GSC,两种培养条件下GSC的SOX2、α-SMA和PDGFRb mRNA表达量均有显著差异(P<0.001)。胶质瘤手术标本中提取的肿瘤细胞在GSC 培养基中培养,其高表达干细胞标记物SOX2,证实这些细胞具备GSC的“干性”。将培养基中EGF、FGF2替换为TGFβ,发现其干细胞标记物SOX2的表达量明显下降,而血管周细胞标记物α-SMA 和PDGFRb 的表达量显著上调(图1),证实这些细胞具有分化为其他细胞的潜能。以上结果说明这些胶质瘤细胞具备GSC 的特征,可满足GSC 的实验要求。

图1 GSC 完全培养基(DMED/F12+EGF+FGF2)和用TGFβ替换EGF和FGF的培养基(DMEM/F12+TGFβ)培养进行鉴定GSC
2.2 WTAP 敲低效率的检测与阴性对照shRNA 相比,转染WTAP shRNA 质粒的GSC 中WTAP mRNA表达量显著下降(P<0.05;图2)。

图2 GSC中WTAP敲低效率检测结果
2.3 敲低WTAP 表达对GSC 增殖的影响与阴性对照shRNA相比,转染WTAP shRNA质粒后,GSC的增殖、侵袭、迁移能力均显著下降(P<0.05;图3、4)。
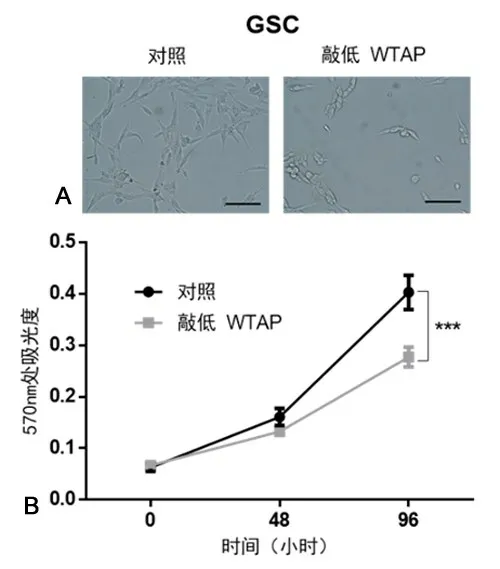
图3 敲低WTAP表达显著抑制GSC的增殖

图4 敲低WTAP显著抑制GSC的迁移和侵袭
2.4 敲低WTAP表达对GSC中AKT磷酸化水平的影响与阴性对照shRNA 相比,转染WTAP shRNA 质粒后,pAKT/AKT比值显著下降(P<0.05;图5)。

图5 敲低WTAP抑制GSC中AKT磷酸化的水平
3 讨论
胶质瘤是成人中枢神经系统最常见的原发性恶性肿瘤,高级别胶质瘤以生长迅速、侵袭性强和反复复发为临床特点,临床预后极差,是临床上亟待解决的难题。GSC 被认为是胶质瘤治疗的关键,其主要特征是能够高表达干细胞生物标记物,可以自我更新并具备分化能力。有研究显示WTAP在多种肿瘤的发生发展中具有重要作用,可以调节Wnt 信号通路促进直肠癌的发生发展;通过结合CDK2 转录本促进肾细胞癌细胞增殖;促进弥漫大B 淋巴瘤细胞的增殖并降低其化疗效果[5,6]。有研究对WTAP在胶质瘤普通细胞系增殖和迁移中的作用进行探究,结果显示敲低WTAP 抑制胶质瘤细胞系的增殖和迁移,值得注意的是,在10%胎牛血清的培养条件下敲低WTAP 可以抑制U87 细胞增殖,但对胶质瘤原代细胞的增殖无影响,在1%胎牛血清的条件下敲低WTAP,明显抑制U87细胞和原代胶质瘤细胞的增殖[4]。本研究GSC 是在无血清调节下培养的,敲低WTAP表达后增殖受到明显抑制。由于无血清培养是维持GSC 干性的必要条件,无法验证培养基胎牛血清浓度与WTAP 对GSC 增殖影响之间的关系,另一方面,这种差异也可能是由于该项研究中提取的原代细胞的异质性导致。
有研究显示WTAP可能通过调控AKT通路抑制卵巢癌细胞和胶质瘤普通细胞系的增殖和迁移[4,7]。AKT 信号通路是影响肿瘤增殖和迁移的经典通路,在GSC 的自我更新、迁移和成瘤能力等多方面发挥重要调控作用[8,9]。本研究观察到敲低WTAP表达后GSC的AKT磷酸化水平明显降低。
总之,WTAP 在胶质瘤中高表达,敲低WTAP 表达显著抑制GSC的增殖、迁移和侵袭,其作用机制可能与调控AKT磷酸化水平有关。
