胶质母细胞瘤铜死亡相关lncRNA预后模型的构建
2023-06-09邓云良
邓云良
胶质母细胞瘤是最常见的颅内原发性恶性肿瘤,预后极差[1,2]。探讨胶质母细胞瘤的发病机制,对提高胶质母细胞瘤的诊治水平具有重要意义。2022年,Tsvetkov 等[3]发现一种新的细胞死亡方式,其称之为cuproptosis,中文译名为铜死亡,这是不同于细胞凋亡、坏死性凋亡、焦亡和铁死亡的新型细胞死亡方式[4,5]。本文采用生物信息学方法分析胶质母细胞瘤差异表达的铜死亡相关长链非编码RNA(long non-coding RNA,lncRNA)并构建预后模型。
1 资料和方法
1.1 数据的下载计算机检索TCGA 数据库(https://portal.gdc.cancer.gov/),下载胶质母细胞瘤的RNAseq数据及其临床信息。
1.2 铜死亡基因相关lncRNA的筛选查阅文献发现17 个铜死亡基因参与铜死亡过程[3,5];然后,进行铜死亡基因和lncRNA的共表达分析,筛选标准为相关系数≥|±0.4|,P≤0.001。
1.3 预后模型的构建和验证应用单因素Cox分析和LASSO 回归筛选预后预测模型的铜死亡相关ln⁃cRNA,并计算风险评分=基因系数×基因表达量,以风险评分中位数分为低风险组和高风险组。将胶质母细胞瘤样本随机分为测试组和训练组,再进行整合生物信息学分析。
1.4 差异表达lncRNA的GO 和KEGG 富集分析 通过对所有样本的高、低风险组进行差异表达分析,得到差异表达基因(筛选标准为LogFC≥|±0.585|,FDR<0.05),然后进行GO和KEGG富集分析。
2 结果
2.1 胶质母细胞瘤铜死亡相关lncRNA 的筛选共下载胶质母细胞瘤样本169 例,对照样本5 例,共表达分析发现791个铜死亡相关lncRNA,其中正相关ln⁃cRNA有753个,负相关lncRNA有38个。
2.2 胶质母细胞瘤预后预测模型的构建单因素Cox分析发现22 个显著差异表达的lncRNA(P<0.05;表1),LASSO回归分析筛选9个差异表达的lncRNA,根据基因系数计算风险评分=(0.537×AC025171.1基因表达量)+(0.890×LINC02449基因表达量)+(-0.469×SOX21-AS1 基因表达量)+(-0.503×AL136366.1 基因表达量)+(0.861×AL117332.1 基因表达量)+(-0.485×AL133523.1 基因表达量)+(0.652×GS1-124K5.4 基因表达量)+(0.819×LINC02328 基因表达量)+(3.00×AC010641.2基因表达量),根据风险评分中位数分为高分险组、低分险组。

表1 单因素Cox 分析发现22 个显著差异表达的胶质母细胞瘤铜死亡相关lncRNA
将169 例TCGA 胶质母细胞瘤样本随机分为测试组和训练组,两组临床特征无统计学差异(P>0.05;表2)。

表2 TCGA数据库样本测试组与训练组临床特征比较无统计学差异
多因素Cox 回归分析显示风险评分增高是胶质母细胞瘤预后不良的独立危险因素(P<0.05,表3)。生存曲线分析显示,无论是训练组,还是测试组,高风险组总体生存期和无进展生存期显著缩短(图1;P<0.05)。ROC 曲线分析显示模型对1、2、3 年生存期具有良好的预测价值(图2A),而且风险评分预测效能显著优于其他临床信息(图2B)。
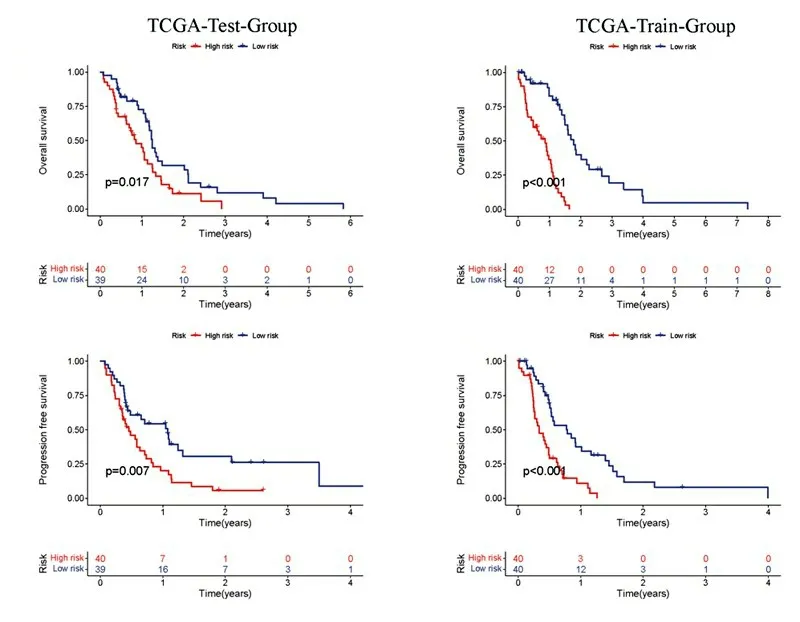
图1 生存曲线分析铜死亡相关lncRNA的风险评分与胶质母细胞瘤病人生存预后的关系

图2 ROC曲线分析模型预测胶质母细胞瘤病人1、2、3年生存率的效能

表3 胶质母细胞瘤预后不良风险因素的Cox比例回归风险模型分析
2.3 差异表达基因的富集分析所有样本进行差异分析发现上调差异基因247 个,下调差异基因74个。GO 分析显示生物过程主要富集于趋化因子和细胞因子的激活、细胞成分主要富集于细胞质、分子功能主要富集于结合活性;KEGG 富集分析主要富集在NF-κB 信号通路、TNF 信号通路和癌症中的转录错调中。这表明铜死亡相关lncRNA 可能通过相关肿瘤通路促进肿瘤的发生和进展。
3 讨论
铜死亡是由铜触发的,铜可以刺激受调节的相关依赖细胞增殖,并且参与线粒体呼吸、抗氧化、自噬、激酶传递等一系列细胞过程[6]。铜是人体的基本营养素,其富含在种子、坚果等食物中,成人推荐摄入量约为0.9 mg,铜吸收主要依赖于铜转运蛋白1(copper transporter 1,CTR1),排出主要依赖铜转运ATP 酶α多肽[6~9]。铜代谢异常可能与癌症具有相关性。研究发现恶性神经胶质瘤铜浓度显著增高,而铜是一种重要的血管生成因子,并在恶性胶质瘤中蓄积[10]。Tsvetkov等[3]发现铜在线粒体的累积可导致铜驱动三羧酸循环中的脂酰化过程,最终引起铜死亡。另外,Brem 等[11]在胶质母细胞瘤中的一项2 期药物试验中发现低血清铜水平可以抑制肿瘤生长和肿瘤血管生成,但使用青霉胺治疗或降低血铜水平,胶质母细胞瘤病人的生存率并没有明显改善。这表明铜参与肿瘤的发生和发展。
研究发现,SOX21-AS1 基因在胶质瘤中可海绵化miR-144-3P,上调PAK7表达,促进肿瘤细胞增殖和侵袭[12]。Wang 等[13]通过SOX21-AS1、HOTAIR、STEAP3-AS1 等lncRNA 构建胶质母细胞瘤外泌体的预后预测模型。本文通过Cox分析和LASSO回归分析筛选出9 个铜死亡相关lncRNA,通过整合生物信息学分析,构建预后预测模型,发现预测模型能有效预测胶质母细胞瘤病人的预后。此外,预后模型差异基因的GO分析显示其主要富集在趋化因子,这可能是由于肿瘤衍生趋化产生[14]。另外,KEGG通路分析显示差异基因富集在多条肿瘤相关通路,如NF-κB 信号通路,该通路与胶质母细胞瘤放疗不敏感、侵袭和转移有关[15,16]。
