LED绿光处理对甘蓝采后品质及抗氧化活性的影响
2023-06-08郭峰孙莹安容慧罗淑芬李鹏霞
郭峰 孙莹 安容慧 罗淑芬 李鹏霞
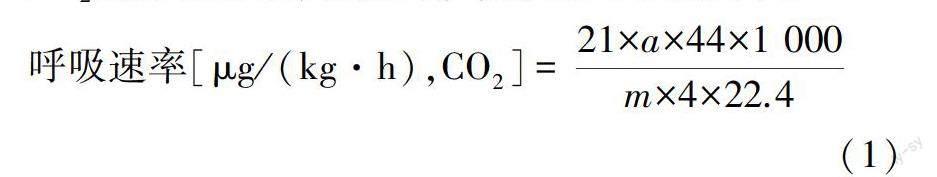
摘要: 為探明LED光照处理对绿甘蓝采后品质及抗氧化活性的影响,首先以不同颜色(白色、红色、蓝色和绿色)和光照度[3.5~25.0 μmol/(m2·s)]的LED光对绿甘蓝进行处理,筛选出延长绿甘蓝贮藏期的适宜光色及光照度;进一步以筛选出的光色及光照度,分析其对采后常温(23~25 ℃)贮藏的绿甘蓝品质和抗氧化活性的影响。结果表明,光照度为25.0 μmol/(m2·s)的绿光条件下贮藏的绿甘蓝外观品质佳,及叶绿素含量高;与对照(避光处理)相比,LED绿光处理有效降低了绿甘蓝采后呼吸速率,维持了其叶片较好的色泽,保持了较好的外观品质,提高了其叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶的活性,保持了较高的抗坏血酸和总酚含量,降低了H2O2、超氧阴离子(O2·-)等活性氧的生成速率和丙二醛(MDA)的积累。因此,LED绿光处理可有效保持甘蓝较好的品质和较高的抗氧化能力,将甘蓝常温保鲜期延长5~6 d。
关键词: LED光照;甘蓝;贮藏品质;抗氧化
中图分类号: TS255.3 文献标识码: A 文章编号: 1000-4440(2023)02-0489-09
Effects of green light-emitting diode light treatment on the quality and antioxidant capacity of postharvest green cabbage (Brassica oleracea var. capitata L.)
GUO Feng1,2, SUN Ying1,2, AN Rong-hui2,3, LUO Shu-fen2,3, LI Peng-xia1,2,3
(1.School of Food Science, Shenyang Agricultural University, Shenyang 110866, China;2.Institute of Agricultural Facilities and Equipment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;3.Key Laboratory of Cold Chain Logistics Technology for Agro-product, Ministry of Agriculture and Rural Affairs, Nanjing 210014, China)
Abstract:In order to explore the effects of light-emitting diode (LED) irradiation treatment on the quality and antioxidant capacity of green cabbages after harvest, the green cabbage samples were treated with different colors (white, red, blue and green) and intensities [3.5-25.0 μmol/(m2·s)] of LED lights. The suitable light color and light intensity for prolonging the storage period of green cabbages were screened out firstly. With the screened light color and intensity, the effects of LED light on the quality and antioxidant capacity of green cabbage stored at room temperature (23-25 ℃) were further investigated. The results showed that the appearance quality and chlorophyll content of green cabbage stored under 25.0 μmol/(m2·s) green light were higher. Compared with the control, green LED irradiation treatment effectively reduced the respiration rate of green cabbage after harvest, the production rate of reactive oxygen species such as H2O2and superoxide anion(O2·-) and the accumulation of malonaldehyde (MDA). Also green LED light treatment maintained the better color of leaves and appearance quality, improved the activities of antioxidant enzymes such as superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT), and maintained the higher contents of ascorbic acid and total phenol. Therefore, green LED irradiation treatment can effectively maintain good quality and high antioxidant capacity of cabbage, and extend the shelf life of cabbage at room temperature by 5-6 d.
Key words: light-emitting diode (LED) light;cabbage;storage quality;antioxidant capacity
甘蓝(Brassica oleracea var. capitata L.)又称包菜、卷心菜,是一种十字花科芸薹属蔬菜,富含抗坏血酸、总酚、叶酸、硫代葡萄糖苷等营养物质及活性成分,具有增强免疫系统功能,消炎止痛、抗肿瘤、抗癌等功效[1]。甘蓝是一种常见的农作物,在世界范围内有着广泛的种植。中国的甘蓝年产量位居世界第一,其在全国蔬菜供应及出口贸易中占有十分重要的地位。但甘蓝在常温下贮藏时易发生叶片黄化、腐烂等现象,导致其营养品质及活性成分含量在短时间内迅速下降,货架期仅6~8 d,这远不能满足当前甘蓝流通及销售的需求。因此,研制有效、安全的甘蓝采后保鲜技术,对延长甘蓝货架期、提高其附加值有着重要意义。当前,已有学者对甘蓝贮藏方法进行了研究。Hu等[2]研究结果表明,1-甲基環丙烯(MCP)处理可抑制甘蓝乙烯释放和呼吸强度,从而延缓其采后衰老。Zhu等[3]采用真空预冷的方法处理,与对照相比,显著提高了贮藏后甘蓝的抗坏血酸和叶绿素含量。Rozpadek等[4]用臭氧熏蒸的方法,有效提升了贮藏后甘蓝抗氧化酶活性和生育酚、硫代葡萄糖苷的含量。
光是作物生长及发育过程中十分重要的环境因素,能够有效调控作物的物质代谢、光合作用等,是作物产量和品质形成的基础。同样,光对果蔬采后的贮藏保鲜也有重要作用。适宜条件的光照处理可有效控制果蔬组织的黄化、软化和腐烂。例如,Dhakal等[5]研究结果表明蓝光处理有效保持了西红柿组织的硬度;刘泽松等[6]、Hasperué等[7]和张娜等[8]人分别发现适宜的UV-C结合红光处理、蓝光结合白光处理和红光处理皆可保持西兰花采后品质,延缓其采后衰老;Yan等[9]和Song等[10]分别采用白光和红光对青菜进行处理,发现两种光照条件都可延缓青菜叶片黄化,并且白光处理还能够促进青菜中硫苷和叶绿素的合成。针对甘蓝,Harbaum-Piayda等[11]发现UV-B光照处理能够有效提高白甘蓝多酚类物质和硫代葡萄糖苷的含量;Yang等[12]用不同光照处理紫甘蓝,发现红蓝黄复合光处理可有效提升其叶片花青素含量和营养品质。但目前仍未见光照处理对绿甘蓝采后品质影响的相关报道。
发光二极管(light emitting diode,LED)光谱性能好,与植物光合作用光谱范围基本吻合,并且拥有低能耗、光谱灵活多变易控制、无污染、寿命长等多种特点,在果蔬的生长和贮藏保鲜中发挥越来越多的作用[13-14]。本研究以绿甘蓝为试验材料,首先通过不同颜色及光照度对绿甘蓝采后品质变化的影响,筛选出能延长绿甘蓝贮藏期的光色及光照度。进一步以筛选出的光色及光照度,研究了常温(23~25 ℃)条件下,LED光照处理对绿甘蓝采后品质及抗氧化活性的影响,旨在为绿甘蓝采后保鲜贮藏提供新思路。
1 材料与方法
1.1 材料与试剂
本试验新鲜的绿甘蓝采收于江苏省农业科学院甘蓝种植基地,品种为苏甘27,采收后1 h内运至实验室。选取无明显机械损伤、去除外叶后单颗鲜质量550~650 g、球高11~12 cm、球径13~14 cm的甘蓝为试验材料。
三氯乙酸、硫代巴比妥酸、草酸、抗坏血酸购自上海麦克林生化科技有限公司,乙二胺四乙酸二钠、乙酸、盐酸羟胺购自西陇科学股份有限公司,偏磷酸、钼酸铵、愈创木酚购自上海源叶生物科技有限公司,没食子酸购自上海瑞永生物科技有限公司,硫酸钛、过氧化氢、对氨基苯磺酸购自国药集团化学试剂有限公司,α-萘胺购自上海阿拉丁试剂有限公司。
1.2 方法
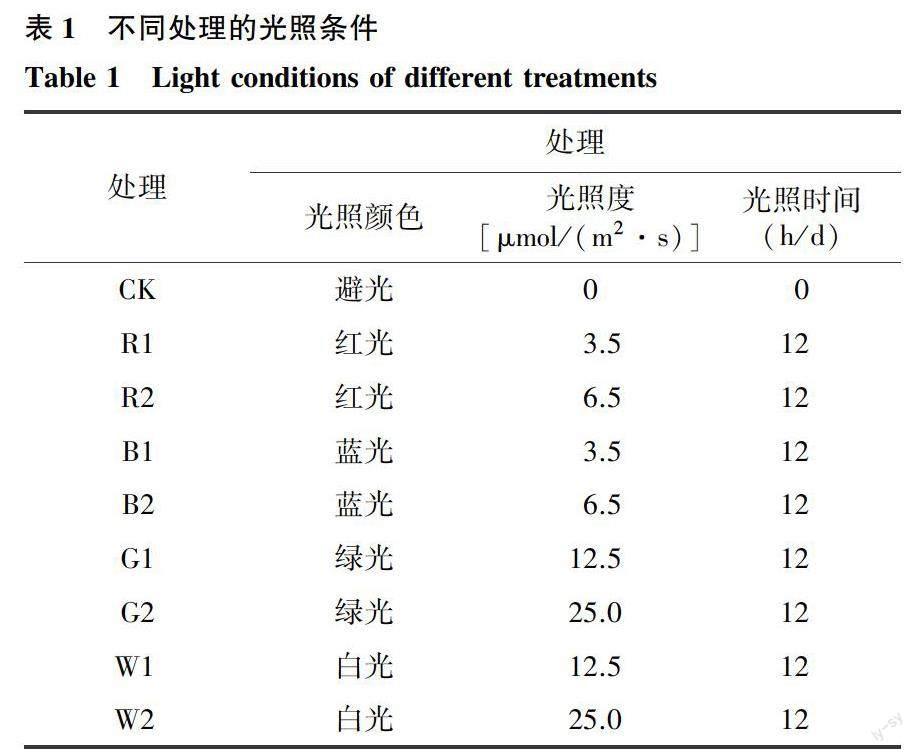
首先以避光处理(处于完全黑暗条件)为对照,采用不同颜色及光照度的LED光照对绿甘蓝进行处理(表1)。将挑选的绿甘蓝每18个为一组(每个平行6个),随机放置到装有LED灯带的货架上,于常温(23~25 ℃)条件下,以光期12 h,暗期12 h对绿甘蓝进行不同条件光照处理,12 d后以绿甘蓝表型及叶绿素含量为标准,筛选出综合效果最佳的光照条件。
以筛选出的综合效果最佳的光照条件为处理组,避光处理为对照组,于常温(23~25 ℃),光期12 h,暗期12 h条件下,研究LED光照处理对绿甘蓝采后品质及抗氧化活性的影响。贮藏期间每隔3 d从处理组和对照组中随机抽取三个平行(每个平行6个甘蓝),分别取样。选取甘蓝外面3层叶片,其中最外层叶片用于测定色差,余下的2叶去除叶柄和叶脉,于液氮中速冻后保存于-80 ℃冰箱,用于各项生理指标的测定。
1.3 指标测定
1.3.1 色差测定 参照纪淑娟等[15]的方法,测定时取每颗甘蓝最外层叶片,避开主叶脉随机挑选3个点,利用CR-400全自动测色色差仪(KONICA MINOLTA,日本)进行测定。
1.3.2 呼吸速率测定 呼吸速率的测定参照文献[16]的方法:每组取5颗绿甘蓝,称质量后置于体积为21 L的密封箱内,在常温下密闭4 h,随后使用Danbell气体分析仪(DANSENSOR,丹麦)测定箱内CO2的体积分数,根据式(1)计算其呼吸速率:
呼吸速率[μg/(kg·h),CO2]= 21×a×44×1 000m×4×22.4(1)
式中,a为密封箱内密闭前后CO2体积分数的增量;m为样品质量。
1.3.3 叶绿素含量测定 参照安容慧等[17]的方法:称取0.2 g甘蓝粉末样品,加入10 ml体积分数为80%丙酮溶液,常温避光浸提8 h,过滤后取上清液,用UV-1102型紫外可见分光光度计(上海天美科学仪器有限公司产品)测定其叶绿素含量,以80%丙酮溶液为空白校零,测定上清液在642 nm和665 nm处的吸光度。
1.3.4 活性氧(Reactive oxygen species,ROS)含量测定 过氧化氢(H2O2)含量测定参照Brennan等[18]的方法。称取0.5 g甘蓝粉末样品,加入2.5 ml预冷的丙酮,匀浆后在4 ℃、10 000 g离心20 min,随后取上清液1 ml加入0.1 ml 5%硫酸钛和0.2 ml浓氨水,待沉淀形成后,再次于相同条件下离心,弃去上清液。沉淀部分使用丙酮多次清洗,直至上清液无色,随后向沉淀加入3 ml 2 mol/L的硫酸,待完全溶解后在415 nm处比色。用H2O2标准样品作标准曲线。
超氧阴离子(O2·-)生成率测定参照王爱国等[19]的方法。取0.5 g甘蓝粉末样品,加入2.5 ml 0.1 mol/L的磷酸缓冲溶液(pH=7.2),匀浆后在4 ℃、10 000 g离心15 min,随后取1 ml上清液加入1 ml 10 mmol/L的盐酸羟胺在25 ℃条件下放置1 h,然后加入1 ml 58 mmol/L的对氨基苯磺酸和7 mmol/L的α-萘胺,在25 ℃下放置30 min,随后在530 nm处比色。用亚硝酸钾标准样品作标准曲线。
1.3.5 丙二醛(MDA)含量测定 丙二醛含量测定参照李合生[20]的方法。取1 g样品,加入2.5 ml体积分数为5%的三氯乙酸溶液,混匀后在4 ℃、10 000 g离心20 min,随后取2 ml上清液加入2 ml体积分数为0.67%的硫代巴比妥酸,涡旋后沸水浴20 min,冷却后再次离心,随后测定其在450 nm、532 nm和600 nm处的吸光值。
1.3.6 抗氧化酶活性测定 粗酶液的制备:称取0.5 g甘蓝粉末样品,加入2.5 ml 0.1 mol/L磷酸缓冲溶液(pH=7.2),混匀后在4 ℃、10 000 g离心20 min,收集上清液用于各项酶活性的测定。
超氧化物歧化酶(SOD)活性测定参照赵世杰等[21]的方法。取50 μl粗酶液,依次加入甲硫氨酸、氮蓝四唑、核黄素和EDTA-Na2各0.3 ml,混匀后在光照度为4 000 lx的日光灯下反应20 min,随后统一用黑色遮光布遮盖避光以停止反应,于560 nm处比色,以磷酸缓冲溶液替换粗酶液作为对照管,随后计算SOD活性。
过氧化物酶(POD)活性测定采用愈创木酚法。取50 μl粗酶液加入2 ml 0.05 mol/L的愈创木酚溶液,在30 ℃水浴中平衡5 min,然后加入1 ml 0.2%的H2O2溶液,于470 nm处扫描,以每分钟470 nm处吸光值变化1为1个POD酶活性单位(U)。
过氧化氢酶(CAT)活性测定采用过氧化氢法。取0.1 ml粗酶液,加入2 ml 0.05 mol/L的磷酸缓冲溶液,在25 ℃水浴下预热5 min,加入1 ml 0.2%的H2O2溶液,于240 nm处扫描,以每分钟240 nm处吸光值变化0.01为1个CAT酶活性单位(U)。
1.3.7 总酚含量测定 总酚含量测定采用福林酚法。以没食子酸标准样品作标准曲线。
1.3.8 抗坏血酸含量测定 抗坏血酸含量测定采用钼蓝比色法[22]。取1 g樣品,加入2.5 ml草酸-EDTA溶液(草酸0.05 mol/L、0.20 mol/L EDTA)后在4 ℃、10 000 g离心20 min,随后取0.1 ml上清液加入0.5 ml偏磷酸-乙酸溶液,1.0 ml 5%的硫酸,2.0 ml 5%的钼酸铵溶液,30 ℃水浴中反应15 min,随后于760 nm处比色,采用抗坏血酸标准样品作标准曲线。
1.4 数据处理与分析
采用Origin 2021作图,采用SPSS 24进行数据分析,处理之间的显著性差异采用Duncans新复极差法分析(P<0.05)。
2 结果与分析
2.1 光照条件的筛选
2.1.1 不同LED光照条件对甘蓝表型的影响 外观品质很大程度上决定了商品的价值。如图1所示,甘蓝在不同条件LED光照处理12 d后表现出不同的品质劣变程度。贮藏12 d后,对照组的甘蓝已出现明显的黄化和腐烂;光照度为3.5 μmol/(m2·s)和6.5 μmol/(m2·s)红光和蓝光处理的甘蓝,皆已呈现明显叶片黄化和腐烂斑点;光照度12.5 μmol/(m2·s)和25.0 μmol/(m2·s)白光处理的甘蓝虽色泽保持较好,但其叶片失水现象严重;绿光处理的甘蓝不仅叶片色泽保持较好,且无明显皱缩现象,其中,光照度为25.0 μmol/(m2·s)绿光处理的甘蓝外观品质更佳。
2.1.2 不同LED光照条件对甘蓝叶片叶绿素含量的影响 由图2可知,经不同条件的LED光照处理12 d后,处理间叶片叶绿素含量差异明显。与对照相比,绿光和白光处理能够显著提高甘蓝叶片叶绿素含量,且光照度25.0 μmol/(m2·s)的白光和绿光处理显著高于12.5 μmol/(m2·s)的绿光处理,但红光和蓝光处理的甘蓝叶片叶绿素含量却显著低于对照。虽然光照度25.0 μmol/(m2·s)白光处理的甘蓝叶片叶绿素含量略高于同样光照度的绿光处理,但两者无显著差异。考虑到绿光处理能更好保持甘蓝表型,因此,本研究认为光照度为25.0 μmol/(m2·s)的绿光对绿甘蓝货架期的延长具有更好的效果。
2.2 绿光处理对甘蓝外观品质的影响
光照度25.0 μmol/(m2·s)的绿光处理对绿甘蓝外观品质的影响如图3所示。对照组甘蓝叶片在贮藏第6 d时已明显黄化,第9 d时出现严重黄化现象,至第12 d时进一步黄化并伴有腐烂现象,已失去商品价值;绿光处理的甘蓝仅在第12 d时出现轻微黄化现象。由此,绿光处理可有效延缓甘蓝叶片黄化和腐烂进程。
2.3 绿光处理对甘蓝叶片色泽的影响
L*、a*和b*是物体色泽的重要指标,分别代表了物体的亮度、红绿度和黄蓝度。不同处理下(绿光和CK)绿甘蓝叶片的叶色指标随处理时间的变化如图4所示。由图4可知,随着贮藏时间延长,对照甘蓝叶片L*逐渐上升,说明甘蓝叶片变白,但绿光处理在整个贮藏期间总体保持稳定;对照|a*|在贮藏第3 d略微上升,随后迅速下降,说明在贮藏期间叶片绿色逐渐褪去,而绿光处理在整个贮藏期间保持了较稳定的|a*|,且在第6 d、9 d和12 d分别高出对照10.75%、36.13%和55.25%;甘蓝叶片b*在贮藏期间逐渐上升,说明甘蓝叶片在贮藏期间逐渐变黄,但对照上升速度较绿光处理更快,至第12 d时,对照甘蓝叶片b*高出绿光处理13.38%。可见,绿光处理可有效地保持甘蓝叶片的色泽。
2.4 绿光处理對甘蓝呼吸速率的影响
呼吸速率对植物衰老有着重要的影响。由图5可知,贮藏期间,对照甘蓝的呼吸速率呈先上升后整体下降的趋势,而绿光处理呈逐渐下降趋势,且对照呼吸速率在整个贮藏期间高于绿光处理,在第3 d、6 d、9 d、12 d时分别高出绿光处理23.57%、6.07%、36.86%和21.74%。因此,绿光处理能够有效抑制甘蓝采后的呼吸速率。
2.5 绿光处理对甘蓝叶片活性氧(ROS)和MDA含量的影响
如图6所示,绿甘蓝采摘后叶片中O2·-生成速率随贮藏时间的增加呈现先下降后上升的趋势。处理3 d后,绿光处理的O2·-生成速率比对照低16.76%~22.07%,两者差异显著;对照甘蓝中H2O2含量在第3 d略微下降,随后迅速上升,至第12 d时又明显下降,而绿光处理在贮藏期间整体处于较稳定水平。对照在第6 d、9 d和12 d时H2O2含量分别为绿光处理的1.8倍、2.2倍和1.6倍。因此,绿光处理能够有效减缓甘蓝叶片活性氧的积累。
甘蓝叶片MDA含量随着贮藏时间的延长而积累。处理3 d内,绿光处理的积累速度低于对照,此后2个处理的积累速度基本一致,但处理3 d后,对照MDA含量显著高于绿光处理,第3 d和6 d时分别比绿光处理高33.36%和27.73%。由此可见,绿光处理可有效减缓甘蓝叶片MDA的积累。
2.6 绿光处理对甘蓝叶片抗氧化酶活性的影响
POD、SOD和CAT等抗氧化酶活性是植物衰老速度的重要指标。图7显示,随着贮藏时间的增加,绿甘蓝叶片POD活性呈波动上升趋势。采摘后3 d内,绿光处理的绿甘蓝叶片POD活性增幅与对照基本一致;6 d后,绿光处理POD活性显著高于对照。
绿光处理的甘蓝叶片SOD活性在处理后6 d内急剧上升,随后迅速下降,在9~12 d趋于稳定;而对照则在处理后6 d内稳中带降,随后迅速上升,9 d后与绿光处理基本一致。贮藏3 d和6 d的绿光处理的甘蓝叶片SOD活性比对照分别增加35.81%和54.90%,但贮藏9 d和12 d时,绿光处理和对照无显著差异。
随贮藏时间的增加,不同处理的绿甘蓝叶片CAT活性总体呈下降趋势。总体来看,绿光处理的绿甘蓝叶片CAT活性下降速度慢于对照,在贮藏第3 d、6 d和12 d时,绿光处理的甘蓝叶片CAT活性都显著高于对照组。总之,绿光处理可有效保持和增强采摘后甘蓝叶片的POD、SOD和CAT活性。
2.7 绿光处理对甘蓝叶片抗氧化物质含量的影响
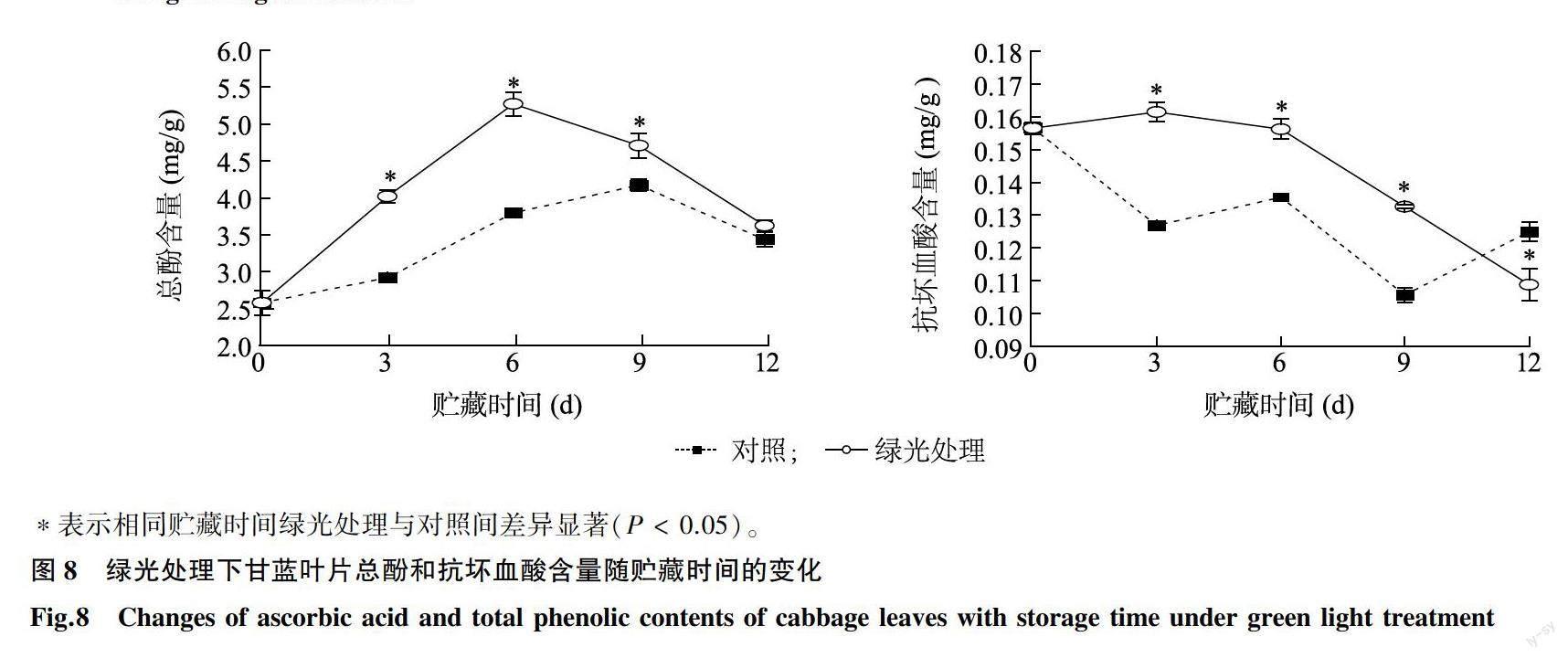
甘蓝富含的抗氧化物质主要是总酚和抗坏血酸。由图8可知,随贮藏时间的增加,不同处理的绿甘蓝叶片总酚含量先上升随后下降。绿光处理下,绿甘蓝叶片总酚含量增加速度快,至第6 d时达到峰值,此后开始下降,而对照叶片总酚含量处理初期增加缓慢,至第9 d时达到最大,此后下降。3 d、6 d、9 d绿光处理总酚含量显著高于对照。对照抗坏血酸含量呈波动下降趋势,而绿光处理后前6 d基本稳定,随后迅速下降,处理后3 d、6 d和9 d时绿光处理抗坏血酸含量分别比对照高27.23%、15.28%和25.46%。因此,绿光处理能够有效提高甘蓝叶片中抗坏血酸和总酚等抗氧化物质的含量。
3 讨论
黄化和腐烂是影响甘蓝采后品质的主要原因。研究结果表明,适宜条件的LED光照可通过调控叶绿素代谢或抑制组织表面微生物繁殖来延缓蔬菜采后品质劣变速度。Liao等[23]采用蓝光对柑橘进行处理,发现40 μmol/(m2·s)的蓝色LED光照可显著抑制其表面微生物繁殖,从而延缓柑橘腐烂变质。Pennisi等[24]和Kasim等[25]也发现绿光处理能够提高芝麻菜总叶绿素含量和降低莴笋叶腐败率,由此保持芝麻菜和莴笋的外观品质。本研究认为,25.0 μmol/(m2·s)的绿光处理可显著抑制绿甘蓝叶片叶绿素降解及呼吸速率,有效延缓其组织黄化和腐烂。
光照处理调控果蔬采后衰老的作用机理依据光照条件及果蔬品种而不同。研究发现,紫光通过下调西兰花叶绿素降解基因BoSGR、BoPAO、BoNYC1、BoCCR的表达量,抑制叶绿素代谢酶活性,从而延缓西兰花叶绿素降解[26];红光能调控西兰花谷胱甘肽-抗坏血酸循坏,提高其抗氧化能力来保持西兰花的品质[27-28];而绿光通过调控西兰花抗氧化系统来提高其抗氧化能力,由此提升其采后品质[29]。蓝光通过抑制蜜柑果实中病原菌的生长,进而延长其货架期[30];在小白菜和辣椒上的研究发现,蓝光分别通过参与调控其谷胱甘肽-抗坏血酸循环和调控花青素合成和成熟相关基因(NCED1、NCED2、NOR、RIN),来减缓小白菜的衰老和保持辣椒的采后品质[31-32]。
本研究发现,25.0 μmol/(m2·s)的LED绿光处理可保持甘蓝贮藏期间较高的抗氧化酶(SOD、POD和CAT)活性,有效减少甘蓝中O2·-和H2O2的累积,并降低其MDA的积累,还有效提高了甘蓝叶片抗氧化物质(抗坏血酸和总酚)的含量。因此,我们认为25.0 μmol/(m2·s) LED绿光处理一方面能抑制甘蓝叶片活性氧的生成,另一方面还通过提高抗氧化能力来提升其ROS清除能力,进而抑制甘蓝叶片细胞产生膜脂过氧化反应,减缓细胞产生氧化损伤,最终延缓甘蓝采后衰老。因此,本研究认为绿光处理是通过提升甘蓝抗氧化能力来延缓其采摘后衰老,这一延缓甘蓝采后衰老机制与Jin等[29]在西兰花中的研究结论类似。
4 结论
常温条件下,光照度25.0 μmol/(m2·s)的LED绿光处理,可有效降低绿甘蓝呼吸速率,延缓其叶绿素降解,提高抗氧化酶(SOD、POD、CAT)活性,维持较高的抗氧化物质(抗坏血酸和总酚)含量,从而减少ROS(H2O2、O2·-)的积累,降低MDA的生成量,进而有效保持绿甘蓝采后品质,将绿甘蓝常温保鲜期延长5~6 d。
参考文献:
[1] KRISTAL A R, LAMPE J W. Brassica vegetables and prostate cancer risk: a review of the epidemiological evidence[J]. Nutrition and Cancer, 2002, 42(1): 1-9.
[2] HU H L, ZHAO H H, ZHANG L G, et al. The application of 1-methylcyclopropene preserves the postharvest quality of cabbage by inhibiting ethylene production, delaying chlorophyll breakdown and increasing antioxidant capacity[J]. Scientia Horticulturae, 2021, 281: 109986.
[3] ZHU Z W, WU X W, GENG Y, et al. Effects of modified atmosphere vacuum cooling (MAVC) on the quality of three different leafy cabbages[J]. LWT-Food Science and Technology, 2018(94): 190-197.
[4] ROZP?DEK P, SLESAK I, CEBULA S, et al. Ozone fumigation results in accelerated growth and persistent changes in the antioxidant system of Brassica oleracea L. var. capitata f. alba[J]. Journal of Plant Physiology, 2013, 170(14): 1259-1266.
[5] DHAKAL R, BAEK K H. Metabolic alternation in the accumulation of free amino acids and γ-aminobutyric acid in postharvest mature green tomatoes following irradiation with blue light[J]. Horticulture Environment & Biotechnology, 2014, 55(1): 36-41.
[6] 劉泽松,史君彦,左进华,等. UV-C和LED红光复合处理对西兰花贮藏品质的影响[J]. 食品科学, 2020, 41(17): 238-245.
[7] HASPERU? J H, GUARDIANELLI L, RODONI L M, et al. Continuous white-blue LED light exposition delays postharvest senescence of broccoli[J]. LWT-Food Science and Technology, 2016, 65: 495-502.
[8] 张 娜,阎瑞香,关文强,等. LED单色红光对西兰花采后黄化抑制效果的影响[J]. 光谱学与光谱分析, 2016, 36(4): 955-959.
[9] YAN Z, ZUO J, ZHOU F, et al. Integrated analysis of transcriptomic and metabolomic data reveals the mechanism by which LED light irradiation extends the postharvest quality of Pak-choi (Brassica campestris L. ssp. chinensis (L.) Makino var. communis Tsen et Lee)[J]. Biomolecules, 2020, 10(2): 252.
[10]SONG Y, QIU K, GAO J, et al. Molecular and physiological analyses of the effects of red and blue LED light irradiation on postharvest senescence of pak choi[J]. Postharvest Biology and Technology, 2020, 164: 111155.
[11]HARBAUM-PIAYDA B, PALANI K, SCHWARZ K. Influence of postharvest UV-B treatment and fermentation on secondary plant compounds in white cabbage leaves[J]. Food Chemistry, 2016, 197: 47-56.
[12]YANG B, ZHOU X, XU R, et al. Comprehensive analysis of photosynthetic characteristics and quality improvement of purple cabbage under different combinations of monochromatic light[J]. Frontiers in Plant Science, 2016, 7: 1788.
[13]BIAN Z H, YANG Q C, LIU W K. Effects of light quality on the accumulation of phytochemicals in vegetables produced in controlled environments: a review[J]. Journal of the Science of Food and Agriculture, 2015, 95(5): 869-877.
[14]崔 瑾,徐志剛,邸秀茹. LED在植物设施栽培中的应用和前景[J]. 农业工程学报, 2008,24(8): 249-253.
[15]纪淑娟,熊振华,程顺昌,等. 1-MCP和CO2自发释放处理对西兰花常温货架期的保鲜作用[J]. 食品与发酵工业, 2014, 40(2): 202-206.
[16]ZHANG D, XU X, ZHANG Z, et al. 6-Benzylaminopurine improves the quality of harvested litchi fruit[J]. Postharvest Biology and Technology, 2018, 143: 137-142.
[17]安容慧,周宏胜,罗淑芬,等. 真空预冷及不同流通方式对上海青货架品质的影响[J]. 食品科学, 2021, 42(13): 241-248.
[18]BRENNAN T, FRENKEL C. Involvement of hydrogen peroxide in the regulation of senescence in pear[J]. Plant Physiology, 1977, 59(3): 411-416.
[19]王爱国,罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 1990(6): 55-57.
[20]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[21]赵世杰,史国安,董新春. 植物生理学实验指导[M].北京:中国农业科学技术出版社, 2002.
[22]李 军. 钼蓝比色法测定还原型维生素C[J]. 食品科学, 2000, 21(8): 42-45.
[23]LIAO H L, ALFEREZ F, BURNS J K. Assessment of blue light treatments on citrus postharvest diseases[J]. Postharvest Biology and Technology, 2013, 81: 81-88.
[24]PENNISI G, ORSINI F, CASTILLEJO N, et al. Spectral composition from led lighting during storage affects nutraceuticals and safety attributes of fresh-cut red chard (Beta vulgaris) and rocket (Diplotaxis tenuifolia) leaves[J]. Postharvest Biology and Technology, 2021, 175: 111500.
[25]KASIM M U, KASIM R. While continuous white LED lighting increases chlorophyll content (SPAD), green LED light reduces the infection rate of lettuce during storage and shelf-life conditions[J]. Journal of Food Processing and Preservation, 2017, 41(6): e13266.
[26]XIE C, TANG J, XIAO J, et al. Purple light-emitting diode (LED) lights controls chlorophyll degradation and enhances nutraceutical quality of postharvest broccoli florets[J]. Scientia Horticulturae, 2022, 294: 110768.
[27]JIANG A, ZUO J, ZHENG Q, et al. Red LED irradiation maintains the postharvest quality of broccoli by elevating antioxidant enzyme activity and reducing the expression of senescence-related genes[J]. Scientia Horticulturae, 2019, 251: 73-79.
[28]MA G, ZHANG L, SETIAWAN C K, et al. Effect of red and blue LED light irradiation on ascorbate content and expression of genes related to ascorbate metabolism in postharvest broccoli[J]. Postharvest Biology and Technology, 2014, 94: 97-103.
[29]JIN P, YAO D, XU F, et al. Effect of light on quality and bioactive compounds in postharvest broccoli florets[J]. Food Chemistry, 2015, 172: 705-709.
[30]YAMAGA I, TAKAHASHI T, ISHII K, et al. Suppression of blue mold symptom development in satsuma mandarin fruits treated by low-intensity blue LED irradiation[J]. Food Science and Technology Research, 2015, 21(3): 347-351.
[31]KANG C H, YOON E K, MUTHUSAMY M, et al. Blue LED light irradiation enhances L-ascorbic acid content while reducing reactive oxygen species accumulation in Chinese cabbage seedlings[J]. Scientia Horticulturae, 2020, 261: 108924.
[32]LIU Y, SCHOUTEN R E, TIKUNOVY, et al. Blue light increases anthocyanin content and delays fruit ripening in purple pepper fruit[J]. Postharvest Biology and Technology, 2022, 192: 112024.
(責任编辑:石春林)
