基于CRISPR/Cas9基因编辑的高油酸大豆品系创制
2023-06-08张威许文静许亚男张红梅刘晓庆崔晓艳陈新陈华涛
张威 许文静 许亚男 张红梅 刘晓庆 崔晓艳 陈新 陈华涛
摘要: 高油酸能够显著提升大豆食用油的稳定性和食用价值,是大豆品质改良的育种目标之一。为提高大豆籽粒油酸含量,本研究采用CRISPR/Cas9多基因编辑技术,同时敲除负调控大豆油酸含量的2个关键基因GmFAD2-1A和GmFAD2-1B。采用农杆菌介导的大豆子叶节转化方法获得20株T0代阳性苗,但发生基因编辑的株系只有11个,其中GmFAD2-1A发生突变的有7株,GmFAD2-1B发生突变的有10株,这2个基因同时发生突变的有6株。经过加代纯合后,检测转基因株系(T3代)大豆籽粒的脂肪酸组分,发现油酸含量显著提升,最高达81.38%,而亚油酸含量则显著降低,获得了高油酸新种质。本研究采取多基因敲除策略,成功突变大豆基因GmFAD2-1A和GmFAD2-1B,并获得高油酸大豆突变体株系,为高油酸大豆育种提供了新的种质资源。
关键词: CRISPR/Cas9基因编辑;大豆;油酸;GmFAD2-1A;GmFAD2-1B
中图分类号: S565.1 文献标识码: A 文章编号: 1000-4440(2023)02-0321-07
Creation of high oleic acid soybean lines by CRISPR/Cas9
ZHANG Wei1, XU Wen-jing1,2, XU Ya-nan1,3, ZHANG Hong-mei1, LIU Xiao-qing1, CUI Xiao-yan1,CHEN Xin1, CHEN Hua-tao1
(1.Institute of Industrial Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;2.College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China;3.College of Life Science, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: Improving the oleic acid is one of the important objectives for soybean breeding and improvement and will improve the stability and edible value of soybean oil. In the present study, we applied CRISPR/Cas9 gene editing to knock out GmFAD2-1A and GmFAD2-1B, which negatively regulate oleic acid content in soybean. By Agrobacterium-mediated transformation using mature cotyledonary node explants, twenty CRISPR/Cas9 T0transgenic lines were obtained after stable transformation. Among of them, 11 T0transgenic lines were detected mutations in the GmFAD2-1A or GmFAD2-1B, including seven GmFAD2-1A transgenic lines, 10 GmFAD2-1B transgenic lines, and six GmFAD2-1A/GmFAD2-1B transgenic lines. The fatty acid profile analysis of T3soybean seeds revealed that the oleic acid content improved obviously, and reached 81.38%, whereas linoleic acid decreased. In this study, the CRISPR/Cas9 gene editing can successfully edit GmFAD2-1A and GmFAD2-1B, and create high oleic acid soybean germplasm, which provides new germplasm resources for the breeding of high oleic acid.
Key words: CRISPR/Cas9 gene editing;soybean;oleic acid;GmFAD2-1A;GmFAD2-1B
大豆[Glycine max (L.) Merrill]源產地为中国,已有5 000多年的种植历史,是中国重要的经济作物和粮油作物。大豆油脂的主要成分为脂肪酸,而大豆脂肪酸包括5种主要组分,分别为油酸(Oleic acid, OA)、硬脂酸(Stearic acid, SA)、棕榈酸(Palmitic acid, PA)、亚麻酸(Linolenic acid, LA)和亚油酸(Linoleic acid, LOA),而大豆油的品质主要取决于脂肪酸组分及其配比[1]。油酸是单不饱和脂肪酸(只含有1个C=C结构),抗氧化作用强,性质稳定,增加大豆油酸含量对于提升大豆食用油的稳定性和食用价值具有重要作用。有研究结果表明,在动物的脂类代谢过程中,油酸能够保证有益胆固醇的稳定性从而降低有害胆固醇密度,在预防心血管疾病发生方面发挥重要作用[2-4],同时油酸可以促进高密度脂蛋白与低密度脂蛋白合理比例的形成,有利于人体健康[5-6]。在加工过程中,由于高油酸植物油脂中多不饱和脂肪酸含量已经处于较低水平,因此不需要再进行多不饱和脂肪酸去除工序,有利于人体健康[7]。因此,提高大豆油脂中油酸的比例对大豆品质改良具有重要意义。
油酸脱氢酶(FAD)在大豆中存在2个非等位基因,分别为 GmFAD2-1和GmFAD2-2。根据基因的稳定性及磷酸化作用不同,大豆GmFAD2-1基因又可以分为GmFAD2-1A 和GmFAD2-1B2个基因,分别位于10号染色体和20号染色体。一些研究结果表明,GmFAD2-1A和GmFAD2-1B共同调控大豆油酸与亚油酸的比例,调控大豆油脂中油酸和亚油酸的含量[8-12],Li 等[12]发现在酵母细胞中异源表达大豆GmFAD2-1B基因后,在酵母中能够检测到亚油酸,且含量显著提高,这意味着GmFAD2-1B可以调控亚油酸的合成。利用传统基因聚合育种技术,Pham等[8-9]聚合GmFAD2-1A和GmFAD2-1B的优异等位变异位点后,大豆油酸含量能够达到80%以上,同时发现单个基因突变,大豆的油酸含量也会显著提高。Haun等[10]利用转录激活因子效应物核酸酶技术(TALENs)靶向编辑大豆基因GmFAD2-1A和GmFAD2-1B,同样获得了大豆油酸含量高达80%以上的转基因株系后代。利用RNAi 技术干扰GmFAD2-1A和GmFAD2-1B的表达,发现不论是干扰单个基因还是干扰2个基因的表达,转基因后代中大豆油酸含量都会显著提升,可达到27.38%~81.90%[13-15]。近年来,Do 等[11]同时将GmFAD2-1A和GmFAD2-1B 2个基因同时敲除,在阳性大豆株系后代中检测到油酸含量超过80%的高油酸大豆株系,而侯智红等[16]发现,大豆脂肪酸组分中油酸含量随着大豆GmFAD2-1A基因被敲除而显著提升。总体而言,上述2个关键基因在大豆油酸代谢途径中发挥重要作用,是负调控大豆油酸含量的2个主要基因。
本研究拟针对上述2个负调控大豆油酸含量基因的DNA序列设计靶标RNA,并获得基因敲除重组载体。利用农杆菌介导法转化大豆品种Williams 82,对GmFAD2-1A和GmFAD2-1B进行编辑,创制油酸含量高的大豆新材料。
1 材料与方法
1.1 遗传受体材料及基因编辑相关载体
以大豆品种Williams 82为遗传转化的受体;pGmU3、pGmU6和CRISPR/Cas9質粒(pSCm)均由南京农业大学喻德跃教授馈赠。
1.2 靶标位点gRNA 的设计
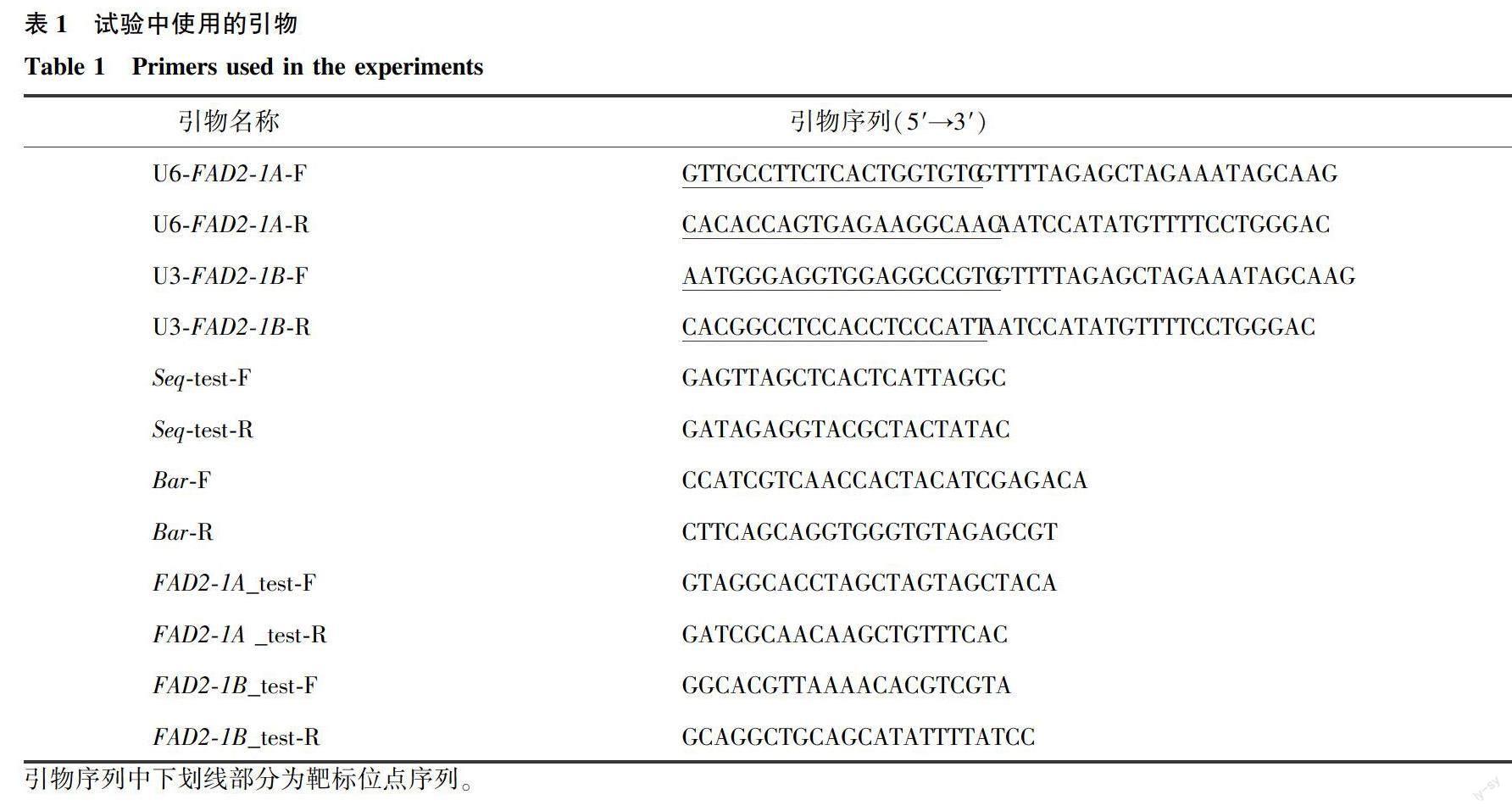
利用在线网站CRISPR-P (http://crispr.hzau.edu.cn/CRISPR2/)分别设计长度为20 bp 的靶标位点序列(guide RNA,gRNA),靶标的位置在GmFAD2-1A和GmFAD2-1B的外显子区域,其引物分别为U6-FAD2-1A-F/U6-FAD2-1A-R和U6-FAD2-1B-F/U6-FAD2-1B-R(表1),构建载体鉴定测序引物Seq-test-F/Seq-test-R和Bar基因筛选标记扩增引物Bar-F/Bar-R、FAD2-1A_test-F/FAD2-1A_test-R和FAD2-1B_test-F/FAD2-1B_test-R,用来检测转基因株系中GmFAD2-1A和GmFAD2-1B突变位点(表1)。
1.3 转基因阳性苗的获得及后代鉴定
遗传转化受体为容易获得阳性苗后代的大豆品种Williams 82;利用农杆菌(EHA105)介导的大豆子叶节遗传转化法进行大豆遗传转化[17]。
使用十六烷基三甲基溴化铵(CTAB)法提取阳性苗株系后代及野生型对照Williams 82的基因组DNA,为获得转基因植株,利用特异引物PCR扩增筛选标记基因Bar来确定阳性苗,检测引物为Bar-F/Bar-R。用FAD2-1A_test-F/FAD2-1A_test-R和FAD2-1B_test-F/FAD2-1B_test-R 2对引物分别PCR扩增转基因植株GmFAD2-1A和GmFAD2-1B的碱基序列,并对PCR产物进行测序。
1.4 大豆脂肪酸组分的提取和检测
用粉碎机粉碎大豆种子,过60目筛,混匀备用。大豆脂肪酸组分的提取和检测方法参考昝光敏等[18]的方法。将适量的大豆粉放入2 ml离心管中,加入1 ml甲醇钠,50 ℃水浴加热35 min。然后加入1 ml正己烷,2 000 r/min离心5 min,取上清液放置于色谱专用样品瓶中,进行气相色谱检测。试验设置3个生物学重复。
2 结果与分析
2.1 基因编辑载体pSCm-GmFAD2-1A/GmFAD2-1B的构建
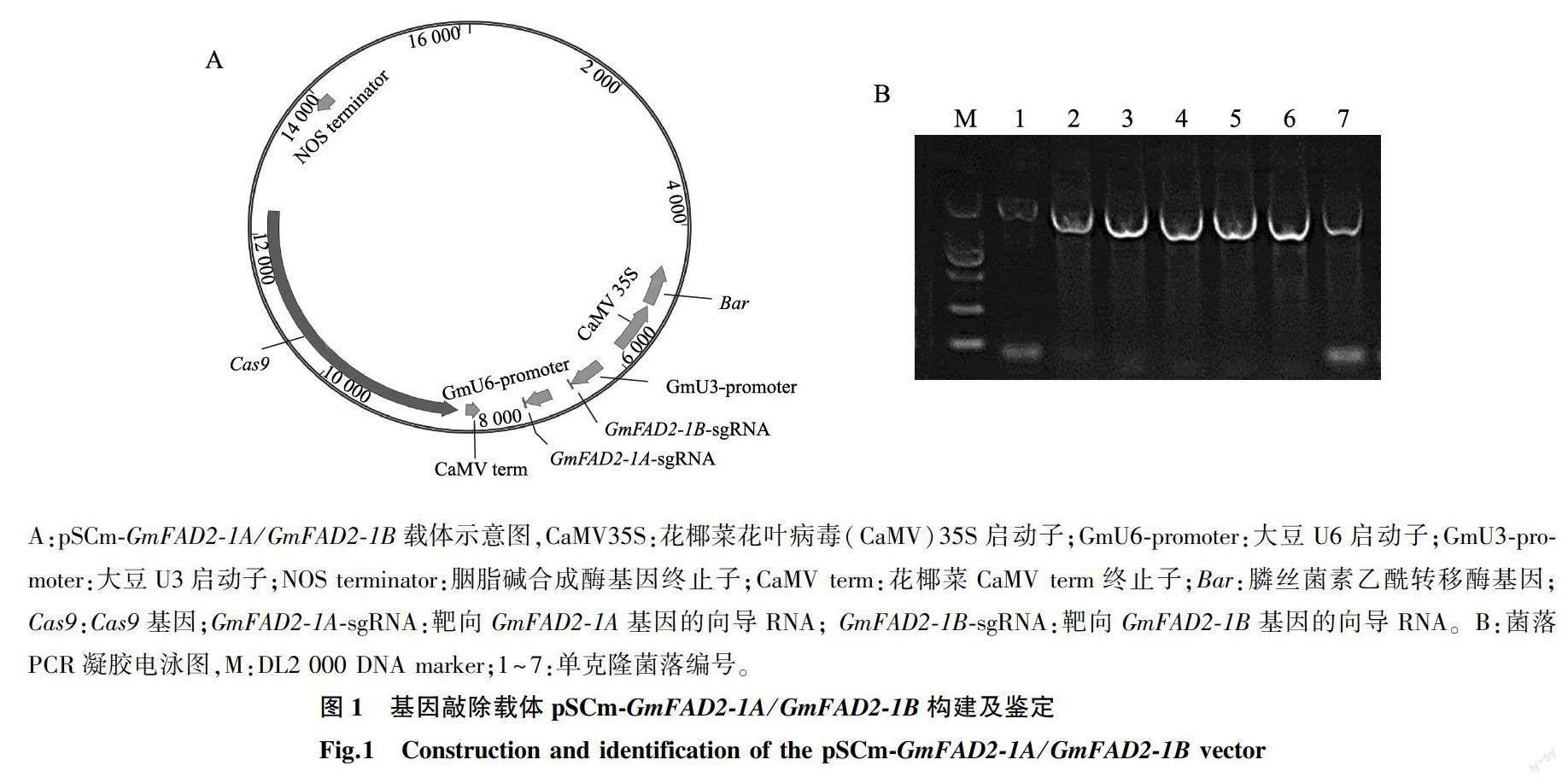
将GmFAD2-1A和GmFAD2-1B基因的靶标序列(sgRNA)同时重组到CRISPR/Cas9基因编辑载体,获得pSCm-GmFAD2-1A/GmFAD2-1B双敲除突变载体(图1A),并转化到大肠杆菌中,为确定载体构建的准确性,提取菌落 PCR鉴定后正确的阳性单克隆(图1B)的质粒并进行测序,测序所用的特异性引物为Seq-test-F和Seq-test-R(表1),利用冻融法将正确的基因编辑重组质粒转化到根癌农杆菌EHA105中,用于后续的大豆遗传转化。
2.2 转基因阳性苗后代鉴定
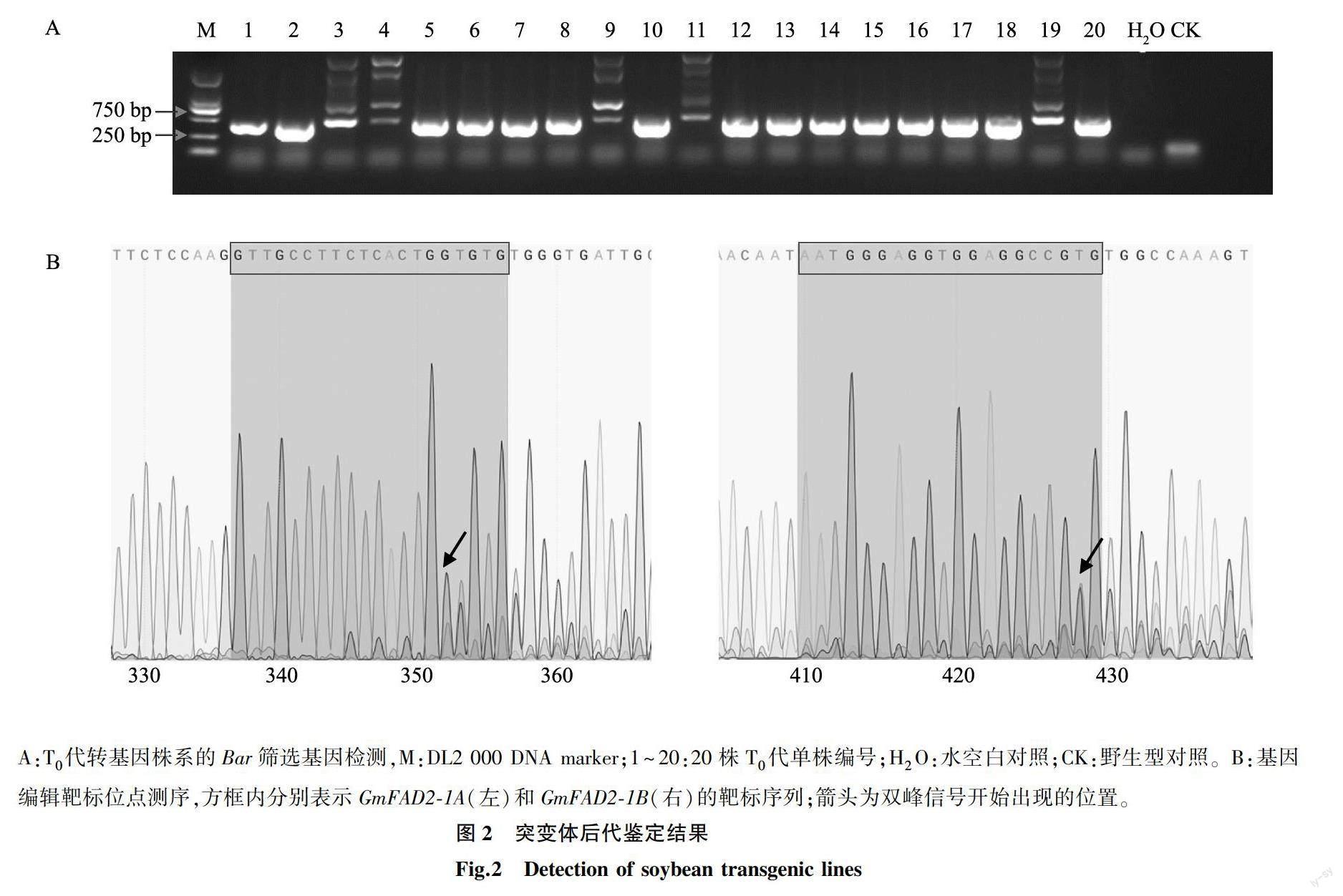
经过遗传转化后,我们一共获得以大豆品种Williams 82为受体的转化幼苗20株。以提取的幼苗叶片DNA为模板,利用特异性引物Bar-F/Bar-R(表1)对重组敲除质粒上的筛选标记Bar基因进行扩增,凝胶电泳结果(图2A)表明,这20株幼苗都可以检测到筛选标记Bar基因,即基因编辑重组载体成功插入到大豆基因组中。以20株幼苗叶片DNA为模板,利用FAD2-1A_test-F/FAD2-1A_test-R和FAD2-1B_test-F/FAD2-1B_test-FR 2对引物分别特异性扩增2个基因的靶标位点并进行测序。测序结果(图2B)表明,7株阳性苗在GmFAD2-1A-sgRNA位置出现双峰,占35%;10株阳性苗在GmFAD2-1B靶标位置发生突变,占50%;2个基因靶标位点附近同时发生突变的共有6株,占30%。
2.3 脂肪酸组分
我们在来自同一T0代单株且经过2次加代获得的T3代幼苗中檢测到3种不同类型的纯合突变家系,即只有GmFAD2-1A发生了突变且纯合的突变株系,只有GmFAD2-1B发生了突变且纯合的突变株系以及这2个基因都发生突变且完全纯合的突变株系,上述3个纯合株系都来自于同一个T0代单株幼苗。
GmFAD2-1A和GmFAD2-1B的基因编辑靶标位点都设计在基因外显子上(图3),PCR特异扩增上述3种突变体的2个基因并进行测序,结果表明,GmFAD2-1A突变纯合株系存在1个340 bp的缺失,该突变位于GmFAD2-1A基因的第二外显子区域;GmFAD2-1B突变纯合株系存在1个1 bp的缺失,该突变位于GmFAD2-1B基因的第二外显子区域,上述2种缺失突变都导致转录提前终止,氨基酸数目减少,蛋白质功能缺失。而在GmFAD2-1A和GmFAD2-1B 双突变纯合突变株系 中,在GmFAD2-1A和GmFAD2-1B靶标位点附近分别发生了340 bp和1 bp的碱基缺失(图3)。
利用气相色谱法检测种子脂肪酸组分发现上述3种突变体株系的油酸含量均极显著提高(P<0.01),亚油酸含量极显著下降(P<0.001),棕榈酸含量显著降低(P<0.05)(表2),3种突变体株系的油酸含量分别为58.56%、43.18%和81.38%,是野生型Williams 82(22.03%)的2.66倍、1.96倍和3.69倍;我们发现,与野生型Williams 82相比,3种突变体株系的亚油酸和棕榈酸含量都显著降低,其中亚油酸平均含量分别为23.46%、36.96%和3.63%,棕榈酸平均含量分别为7.83%、8.43%和6.09%;而硬脂酸和亚麻酸含量则没有显著变化。上述突变体株系油酸和亚油酸含量的显著变化,说明在大豆中,GmFAD2-1A和GmFAD2-1B基因是调控大豆油酸和亚油酸代谢途径的关键基因。
3 讨论
大豆油在中国饮食结构中发挥着重要作用,提高大豆油品质对于改善国人饮食结构具有重要意义。研究结果表明,高油酸植物油有益于身体健康,它在维持有益的高密度脂蛋白的同时降低对人体不利的低密度脂蛋白[19-20]。高油酸含量的橄榄油因其有益于人类健康,而受到国人的追捧。然而,由于气候及地理原因橄榄树无法在中国种植生产,因而绝大部分橄榄油只能从地中海国家进口,价格昂贵,普通人难以消费。因此,创制高油酸大豆新品系、品种,压榨出高油酸大豆油则为改善国人的饮食结构提供可能。
近年来,作为第三代基因编辑技术, CRISPR/Cas9 基因编辑技术得到了十分迅速的发展[21-29]。与第一代基因编辑技术(锌指核酸酶技术,ZFN)和第二代基因编辑技术(转录激活因子效应物核酸酶技术,TALEN)相比,该技术简单灵活,基因编辑效率和编辑精确度高,目前已得到大范围的应用[30]。由于CRISPR/Cas9基因编辑技术能够高效精准地编辑植物基因组,因而在作物分子育种方面具有巨大的应用前景。目前,CRISPR/Cas9基因编辑技术在大豆产量、开花期、大豆蛋白质含量、耐逆性等方面的改良上应用已有较多报道[31-34]。大豆 GmFAD2-1A 和 GmFAD2-1B是决定大豆籽粒油酸含量的主要基因[12,35],通过抑制这2个基因的表达,可以显著提高大豆籽粒中油酸和亚油酸比例。已有众多的研究者通过同时抑制GmFAD2-1A和GmFAD2-1B 基因表达,获得油酸含量显著提高到 80%的转基因大豆材料[10,13]。在这些研究中,油酸含量提高到 80%的转基因大豆均为 FAD2-1A 与 FAD2-1B 基因的双突变纯合体,而这些研究中获得的单基因突变体,油酸含量虽然也得到显著提高,但提高的程度比双突变体低的多,只能提高到27%~50%。这些研究结果都表明,只有当 GmFAD2-1A和GmFAD2-1B基因同时突变时,油酸含量才能提高到 80%,从而达到高油酸的标准。本研究运用多靶点基因敲除系统,构建了可以同时敲除GmFAD2-1A和GmFAD2-1B基因的基因编辑载体,单个基因发生基因编辑(突变)效率分别达到35%和50%,双基因同时发生基因编辑(突变)效率达到30%,在转基因后代中获得了多种不同类型的突变株系。纯合突变体株系油酸含量远远高于野生型,油酸含量最高时超过80%,与橄榄油的油酸含量不相上下。我们创制的能够稳定遗传的大豆突变体材料,为大豆品质改良育种提供了新的基因资源,另一方面,外源基因骨架和筛选标记在遗传转化的后代中经过几次自交后丢失,即最终产生Cas9-free的突变体植株,这也为高油酸大豆育种提供了新的种质资源。
参考文献:
[1] THELEN J J, OHLROGGE J B. Metabolic engineering of fatty acid biosynthesis in plants[J]. Metabolic Engineering, 2002, 4(1): 12-21.
[2] GOLDBOURT U, YAARI S. Cholesterol and coronary heart disease mortality. A 23-year follow-up study of 9902 men in Israel[J]. Arteriosclerosis: An Official Journal of the American Heart Association,1990, 10(4): 512-519.
[3] YANG Z H, PRYOR M, NOGUCHI A, et al. Dietary palmitoleic acid attenuates atherosclerosis progression and hyperlipidemia in low-density lipoprotein receptor-deficient mice[J]. Molecular Nutrition & Food Research, 2019, 63(12): 1900120.
[4] SMITH G D, SONG F, SHELDON T A. Cholesterol lowering and mortality: the importance of considering initial level of risk[J]. British Medical Journal, 1993, 306(6889): 1367.
[5] TOBOREK M, LEE Y W, GARRIDO R, et al. Unsaturated fatty acids selectively induce an inflammatory environment in human endothelial cells[J]. The American Journal of Clinical Nutrition, 2002, 75(1): 119-125.
[6] 劉 平. 棕榈油酸功能的研究进展[J]. 粮食与油脂, 2020, 33(3): 4-6.
[7] 严 靖,孙沁梅,冯 琴. 反式脂肪酸对血脂代谢异常相关疾病的危害及机制[J]. 医学综述, 2021, 27(11): 2119-2123.
[8] PHAM A, LEE J, SHANNON J G, et al. Mutant alleles of FAD2-1A and FAD2-1B combine to produce soybeans with the high oleic acid seed oil trait[J]. BMC Plant Biology, 2010, 10: 195.
[9] PHAM A, LEE J, SHANNON J G, et al. A novel FAD2-1A allele in a soybean plant introduction offers an alternate means to produce soybean seed oil with 85% oleic acid content[J]. Theoretical and Applied Genetics, 2011, 123(5): 793-802.
[10]HAUN W, COFFMAN A, CLASEN B M, et al. Improved soybean oil quality by targeted mutagenesis of the fatty acid desaturase 2 gene family[J]. Plant Biotechnology Journal,2014, 12(7): 934-940.
[11]DO P T, NGUYEN C X, BUI H T, et al. Demonstration of highly efficient dual gRNA CRISPR/Cas9 editing of the homeologous GmFAD2-1A and GmFAD2-1B genes to yield a high oleic, low linoleic and α-linolenic acid phenotype in soybean[J]. BMC Plant Biology, 2019, 19(1): 311.
[12]LI L Y, WANG X L, GAI J Y, et al. Isolation and characterization of a seed-specific isoform of microsomal omega-6 fatty acid desaturase gene (FAD2-1B) from soybean[J]. DNA Sequence, 2008, 19(1): 28-36.
[13]WANG G L, XU Y N. Hypocotyl-based agrobacterium-mediated transformation of soybean (Glycine max) and application for RNA interference[J]. Plant Cell Reports, 2008, 27(7): 1177-1184.
[14]ZHANG L, YANG X D, ZHANG Y Y, et al. Changes in oleic acid content of transgenic soybeans by antisense RNA mediated posttranscriptional gene silencing[J]. International Journal of Genomics, 2014, 2014: 921950.
[15]YANG J, XING G J, NIU L, et al. Improved oil quality in transgenic soybean seeds by RNAi-mediated knockdown of GmFAD2-1B[J]. Transgenic Research, 2018, 27(2): 155-166.
[16]侯智红,吴 艳,程 群,等. 利用CRISPR/Cas9技术创制大豆高油酸突变系[J]. 作物学报, 2019, 45(6): 839-847.
[17]OLHOFT P M, DONOVAN C M, SOMERS D A. Soybean (Glycine max) transformation using mature cotyledonary node explants[J]. Methods in Molecular Biology, 2006, 343: 385.
[18]昝光敏,张 玲,张延瑞,等. 大豆籽粒脂肪酸组分气相色谱检测方法的建立[J]. 中国农学通报, 2021, 37(9): 118-124.
[19]CHANG N W, HUANG P C. Effects of the ratio of polyunsaturated and monounsaturated fatty acid to saturated fatty acid on rat plasma and liver lipid concentrations[J]. Lipids, 1998, 33(5): 481-487.
[20]WILLIAMS M J A, SUTHERLAND W H F, MCCORMICK M P, et al. Impaired endothelial function following a meal rich in used cooking fat[J]. Journal of the American College of Cardiology, 1999, 33(4): 1050-1055.
[21]赵静娟,张晓静,李凌云,等. 全球作物基因组编辑技术研发态势及最新研究进展[J].江苏农业科学,2022,50(18):250-257.
[22]李 丹,周鸣鸣,何正义,等. 同源臂长度对CRISPR/Cas9介导hLF基因打靶山羊β-乳球蛋白位点效率的影响[J]. 南方农业学报,2022,53(1):182-190.
[23]夏雄飞,潘俊良,韩长志. CRISPR/Cas9基因编辑技术在植物病原真菌中的应用研究进展[J]. 江苏农业科学,2022,50(12):22-27.
[24]施季森. CRISPR:从“盲盒”基因编辑到“精准靶向”基因组编辑的未竟之旅[J]. 南京林业大学学报(自然科学版),2021,45(6):12-14.
[25]朱丽珍,王 芳,王娅丽,等. 基因编辑技术及CRISPR/Cas系统在草地植物开发中的应用[J]. 江苏农业科学,2021,49(20):22-30.
[26]孙佳彤,国艳娇,李 爽,等. 基于CRISPR/Cas9的毛果杨bHLH106转录因子的功能研究[J]. 南京林业大学学报(自然科学版),2021,45(6):15-23.
[27]侯 静,毛金燕,翟 惠,等. CRISPR/Cas技术在木本植物改良中的应用[J]. 南京林业大学学报(自然科学版),2021,45(6):24-30.
[28]王 倩,赵俊桃,陈 聪,等. CRISPR/Cas系统在生物核酸检测中的应用进展[J]. 生物加工过程,2022,20(6):597-607,636.
[29]黄秋艳,杨烨城,张昆丽,等. 基于CRISPR/Cas9技术构建STING基因敲除猪肺泡巨噬细胞系及其对Ⅰ型干扰素转录的影响[J]. 南方农业学报,2022,53(4):891-898.
[30]JINEK M, CHYLINSKI K, FONFARA I, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J]. Science, 2012, 337(6096):816-821.
[31]GOETTEL W, ZHANG H Y, LI Y, et al. POWR1 is a domestication gene pleiotropically regulating seed quality and yield in soybean[J]. Nature Communications, 2022, 13(1): 3051.
[32]CAI Z D, XIAN P Q, CHENG Y B, et al. CRISPR/Cas9-mediated gene editing of GmJAGGED1 increased yield in the low-latitude soybean variety Huachun 6[J]. Plant Biotechnology Journal, 2021, 19(10): 1898-1900.
[33]LU S J, DONG L D, FANG C, et al. Stepwise selection on homeologous PRR genes controlling flowering and maturity during soybean domestication[J]. Nature Genetics, 2020, 52(4): 428-436.
[34]YU T F, LIU Y, FU J D, et al. The NF-Y-PYR module integrates the abscisic acid signal pathway to regulate plant stress tolerance[J]. Plant Biotechnology Journal, 2021, 19(12): 2589-2605.
[35]HEPPARD E P, KINNEY A J, STECCA K L, et al. Developmental and growth temperature regulation of two different microsomal[omega]-6 desaturase genes in soybeans[J]. Plant Physiology, 1996, 110(1): 311-319.
(責任编辑:陈海霞)
