一株木糖氧化无色杆菌的分离鉴定及其对小麦赤霉病的防治效果
2023-06-08邓云苏妍姚锦爱田大刚阮宏椿肖翔刘友
邓云 苏妍 姚锦爱 田大刚 阮宏椿 肖翔 刘友

摘要: 為丰富小麦赤霉病病菌拮抗菌资源,寻找替代化学杀菌剂的生物防治方法,采用平板稀释涂布法从小麦赤霉病抗性鉴定圃土壤、小麦根部和周边植物根部分离拮抗细菌,明确其分类地位,并采用灌根和穗部喷施法测定其对小麦赤霉病防治效果。结果表明,本研究共分离获得18株拮抗细菌,筛选出杀菌谱广、对小麦赤霉病病菌抑菌效果较好的拮抗菌D09;其对小麦赤霉病禾谷镰刀菌抑制率达到67.92%。根据形态特征、生理生化特性和分子鉴定,初步鉴定拮抗菌D09为木糖氧化无色杆菌(Achromobacter xylosoxidans)。木糖氧化无色杆菌D09发酵液灌根处理对小麦赤霉病的田间防治效果达到50.93%,与常用杀菌剂氟硅唑穗部喷雾处理无显著性差异。D09发酵液灌根处理的小麦籽粒中脱氧雪腐镰刀菌烯醇(DON)毒素含量低于苯甲嘧菌酯穗部喷雾处理,与氟硅唑穗部喷雾处理无显著性差异,玉米赤霉烯酮(ZEN)、雪腐镰刀菌烯醇(NIV) 2种毒素含量与戊唑多菌灵、苯甲嘧菌酯、氟硅唑穗部喷雾处理无显著性差异。综上,木糖氧化无色杆菌D09对多种植物病原真菌具有广谱抗性,对小麦赤霉病有较好的防治效果,对DON、ZEN、 NIV 3种毒素具有抑制作用,作为小麦赤霉病的生防材料,具有良好的开发应用前景。
关键词: 无色杆菌;拮抗菌;小麦赤霉病
中图分类号: S476 文献标识码: A 文章编号: 1000-4440(2023)02-0328-08
Isolation and identification of an Achromobacter xylosoxidans strain and its control effect on Fusarium head blight
DENG Yun1, SU Yan1, YAO Jin-ai2, TIAN Da-gang3, RUAN Hong-chun2, XIAO Xiang1, LIU You1
(1.Nanping Institute of Agricultural Sciences, Nanping 354200, China;2.Institute of Plant Protection, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China;3.Institute of Biotechnology, Fujian Academy of Agricultural Sciences, Fuzhou 350001, China)
Abstract: In order to enrich the resources of antagonistic bacteria against Fusarium head blight and find a biological control method to replace chemical fungicides, antagonistic bacteria were isolated from the soil of wheat scab resistance identification nursery, wheat roots and the roots of the surrounding plants by plate dilution coating method, and their classification status was clarified. The control effect against Fusarium head blight was determined by root irrigation and ear spraying. The results showed a total of 18 strains of antagonistic bacteria were isolated in this study, and the antagonistic bacterium D09 with broad bactericidal spectrum and good antagonistic effect on wheat scab was screened out. Its inhibition rate against Fusarium graminearum reached 67.92%. According to the morphological characteristics, physiological and biochemical characteristics and molecular identification, the D09 was preliminarily identified as Achromobacter xylosoxidans. The control effect of Achromobacter xylosoxidans D09 fermentation broth on Fusarium head blight reached 50.93%, which was not significantly different from that of the commonly used fungicide flusilazole. The content of deoxynivalenol (DON) toxin in the diseased wheat grains treated with D09 fermentation broth was lower than that treated with difenoconazole·azoxystrobin, and there was no significant difference with flusilazole treatment. The contents of zearalenone (ZEN) and nivalenol (NIV) were not significantly different from those in the treatments of tebuconazole·carbendazim, difenoconazole·azoxystrobin, and flusilazole. In summary, Achromobacter xylosoxidans D09 has broad-spectrum resistance to various plant pathogenic fungi, has good control effect on Fusarium head blight, and has degradation effect on DON, ZEN and NIV toxins. As a biocontrol material for Fusarium head blight, D09 has good development and application prospects.
Key words: Achromobacter;antagonistic bacteria;Fusarium head blight
赤霉病(FHB)是世界性病害,主要是由禾谷镰刀菌引起的一种严重影响禾谷类作物产量和品质的毁灭性病害[1]。小麦赤霉病广泛分布于中国温暖潮湿或半潮湿地区,多发于长江中下游冬麦区、川滇冬麦区及华南冬麦区,对小麦生产的危害甚大[2]。1993-2001年,赤霉病给美国小麦和大麦生产造成的直接经济损失高达7.67×109美元[3]。赤霉病在带来产量损失的同时,引发小麦赤霉病的镰刀菌所产生的DON(脱氧雪腐镰刀菌烯醇)、NIV(雪腐镰刀菌烯醇)、ZEN(玉米赤霉烯酮)等真菌毒素在粮食中存在,会使得人类或动物食用后出现呕吐、怀孕母畜中毒后流产等症状[2]。DON、NIV等毒素能影响真核细胞中蛋白质、DNA、RNA的合成以及线粒体功能、细胞分裂、膜功能等,从而对人和动物的健康与免疫产生抑制作用[4]。1998年,国际癌症机构公布的评估报告中,DON被列为第3类致癌物,与人类食管癌、IgA肾病、胃癌和骨关节病有关[4]。小麦赤霉病的流行主要是由于稻桩或土壤中的腐殖质残留携带镰刀菌,在合适的气候环境下爆发引起的。土壤中如富含抑制禾谷镰刀菌的微生物,将有利于控制赤霉病的流行[5-9]。使用化学杀菌剂是目前麦类生产中控制赤霉病的主要方法[10],但是长期使用化学农药一方面容易导致禾谷鐮刀菌产生抗药性,另一方面还会带来农药残留、环境污染等问题。因此,筛选出具有抑制赤霉病病菌等多种病原真菌的广谱拮抗菌,研制微生物农药对促进和提升小麦生产具有现实意义。
微生物农药具有易降解、无污染、无残留的特点,符合国家绿色生产的需求,已经在绿色农产品和有机农产品生产中得到应用[11-13]。目前,微生物农药研究比较多的菌种为解淀粉芽孢杆菌、枯草芽孢杆菌、多黏类芽孢杆菌[14-17]等。近年来,无色杆菌引起了众多研究人员的重视。无色杆菌一方面可以产生广谱抗生素,对欧文氏菌、白色念球菌、肺炎克雷伯菌等具有较强的抑菌活性[18-19],另一方面也可以分泌杀虫蛋白,对害虫生物防治同样具有良好的应用价值[20]。此外,无色杆菌在环境保护中也有很好的应用价值,常用于土壤或废水中、农药残留、染料等有害物质的降解[21-22]。本研究从福建省南平市农业科学研究所小麦赤霉病自然抗性鉴定圃中土壤、小麦植株根部及鉴定圃周边植物的根系中分离出具有广谱抑制真菌活性的菌株,根据形态特征观察、生理生化反应和系统发育树分析,鉴定其种属及分类地位。进一步通过田间试验测定其对小麦赤霉病的防治效果和对DON、ZEN、NIV等毒素生成的抑制作用,为该菌株的开发应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 拮抗菌菌株和真菌菌株 拮抗菌菌株分离自福建省南平市农业科学研究所小麦赤霉病自然抗性鉴定圃表层下5~20 cm深度的土样、鉴定圃中供试小麦品种的根部及鉴定圃周围的植物根部。供试的12株病原真菌菌株编号和具体来源见表1。
1.1.2 供试的化学药剂 60.0%戊唑多菌灵水分散粒剂和32.5%苯甲嘧菌酯悬浮剂由河北冠龙农化有限公司生产,40.0%氟硅唑乳油由陕西标正作物科学有限公司生产。
1.1.3 供试小麦品种 高感赤霉病的冬小麦扬辐麦4号,由江苏里下河地区农业科学研究所提供。
1.1.4 培养基配制 NA(细菌)培养基:蛋白胨10 g、牛肉膏3 g、NaCl 5 g、琼脂15 g,定容至1 000 ml,pH 值7.3。NB(细菌)培养液:蛋白胨10 g、牛肉膏3 g、NaCl 5 g、定容至1 000 ml、pH 值7.3。PDA培养基(真菌或细菌):马铃薯250 g、葡萄糖20 g、琼脂20 g、定容至1 000 ml。红糖豆粉发酵液:红糖23.3 g、CaCO34.9 g、豆粉11.1 g、KNO38.0 g、KH2PO40.5 g、K2HPO41.2 g、MgSO4·7H2O 5.0 g、NaCl 3.0 g、定容至1 000 ml。
1.1.5 微生物菌液助剂配方 添加剂配方为湿润剂D425 (烷基磺酸缩聚物)4.8%,分散剂PVA(聚乙烯醇)7.2%,保护剂FWA(荧光增白剂)0.1%,稳定剂CMC-Na(羧甲基纤维素钠)2.0%[23]。
1.2 方法
1.2.1 拮抗菌菌株的分离和纯化 土壤样品中的菌株采用稀释涂布平板法分离[24],植物根部内生菌采用表面消毒法进行分离[25]。得到的拮抗菌菌株进行编号,2次单菌落划线纯化,纯化后的菌株采用甘油法保藏于-80 ℃冰箱。
1.2.2 拮抗菌菌株的筛选及拮抗谱的测定 分离的菌株采用划线平板对峙法进行拮抗菌菌株筛选。选择表1中的12个真菌作为靶标病原真菌。先挑取纯化后的细菌菌落在对应的PDA或NA培养基上活化,挑取靶标病原真菌新鲜菌块接种到PDA或NA培养基(直径6 cm培养皿)的中央,再以靶标病原真菌菌株的菌丝块为中心,对拮抗细菌菌落画边长为4 cm的正方形方框[26],以只接种靶标病原真菌作为对照;于28 ℃下培养5~7 d,观察生长情况,筛选出的拮抗效果好的菌株进行抑菌谱测定,测量抑菌带宽度和菌落直径,计算抑菌效果。
1.2.3 拮抗菌的鉴定 菌落形态特征观察:纯化后的菌株用NB培养液培养24 h,取100 μl菌液用无菌水稀释1 000倍,取100 μl均匀涂布于PDA平板上,28 ℃恒温培养48 h,观察单菌落的形态特征[27]。菌体形态采用革兰氏染色法染色后,在1 000倍显微镜下用带刻度尺的载玻片进行观察。
16S rDNA序列同源性鉴定:结合菌落特征和菌体形态对菌株进行初步分类,对菌株进行16S rDNA序列测定,DNA提取由生工生物工程(上海)股份有限公司完成。PCR所用的引物融合了Miseq测序平台的V3-V4通用引物805R(上游引物5′-GACTGGAGTTCCTTGGCACCCGAGAATTCCA-3′,下游引物5′-GACTACHVGGGTATCTAATCC-3′)和341F(上游引物5′-CCCTACACGACGCTCTTCCGATCTG-3′,下游引物5′-CCTACGGGNGGCWGCAG-3′)。PCR 反应体系:2×Taq master Mix 15 μl,Bar-PCR primer F(10 μmol/L) 1 μl,Primer R (10 μmol/L) 1 μl,Genomic DNA 20 ng,加H2O至 30 μl。PCR 扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火20 s,72 ℃延伸30 s,25次循环;最后72 ℃延伸5 min。DNA序列测定由生工生物工程(上海)股份有限公司完成。16S rDNA 序列在核糖体数据库(http://rdp.cme.msu.edu/index.jsp)中进行BLAST比对,利用MEGA 7软件构建系统发育进化树。
生理生化测试:对具有生防潜力的菌株进一步开展D-葡萄糖、D-木糖、乳糖、蔗糖、纤维素利用及耐盐性、水解淀粉、甲基红试验、V-P反应、H2S产生、纤维素利用、42 ℃生长、厌氧生长等生理生化指标测试。
1.2.4 拮抗菌对小麦赤霉病田间防效及小麦籽粒毒素测定 拮抗菌对小麦赤霉病田间防效试验于2020-2021年度在福建省南平市农业科学研究所试验基地进行。该基地有全国冬小麦国家区试赤霉病自然抗性鉴定圃,赤霉病常年自然发生,无需接种赤霉病菌。冬小麦品种扬辐麦4号于11月16日播种,次年2月11日始穗,2月14日始花。试验设拮抗菌发酵液(按微生物菌液助剂配方配置)灌根、拮抗菌发酵液穗部喷雾、60%戊唑多菌灵水分散粒剂穗部喷雾、32.5%苯甲嘧菌酯穗部喷雾、40%氟硅唑穗部噴雾5个处理及清水穗部喷雾对照。施药前用平板血球计数法检测菌液的有效菌含量,穗部喷施发酵液有效成分含量为1.5×1013CFU/hm2,土壤灌根浇施有效成分含量3.0×1013CFU/hm2。灌根处理在小麦始穗期灌根1次,喷雾处理分别在始穗期、始花期和盛花期各喷施1次,每个小区20 m2,3次重复。4月15日小麦成熟后调查赤霉病发病情况,各处理选取病麦粒1 kg,3次重复,委托中国农业科学院果树研究所对小麦籽粒的DON、ZEN、NIV毒素含量进行检测。各处理防效的计算按下式进行:
防效=(清水对照下的病小穗率-处理下病小穗率)/清水对照下的病小穗率×100%
1.2.5 数据处理和分析 采用IBM SPSS Statistics 19软件选择单因素方差分析、方差同质性检测和Waller-Duncan的选项进行数据处理分析。
2 结果与分析
2.1 拮抗细菌的筛选
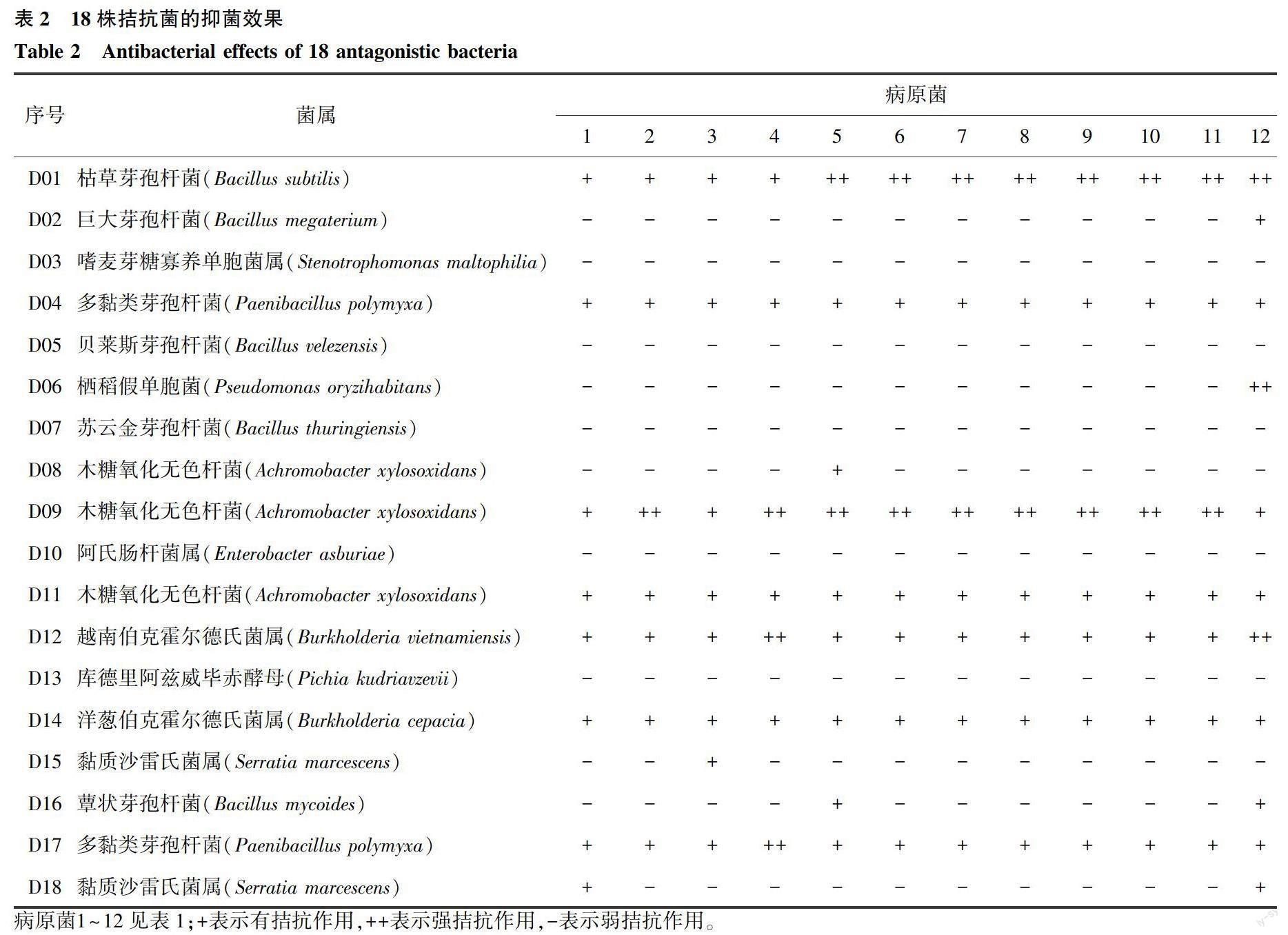
本试验共分离出18株拮抗菌菌株,16S rDNA序列测定均为细菌,18株拮抗菌菌株对12种病原真菌的抗菌谱结果见表2。其中,枯草芽孢杆菌(D01)、多黏类芽孢杆菌(D04、D17)、木糖氧化无色杆菌(D09、D11)、越南伯克霍尔德氏菌属(D12)、洋葱伯克霍尔德氏菌属(D14)等7株菌株对小麦赤霉病等病原真菌表现出广谱拮抗效果,而菌株D09木糖氧化无色杆菌的抑制作用明显高于其他6株菌菌株。此外,表2中有3株木糖氧化无色杆菌D08、D09和D11,但3者却表现出不同的抑菌效果。
2.2 拮抗菌D09的鉴定
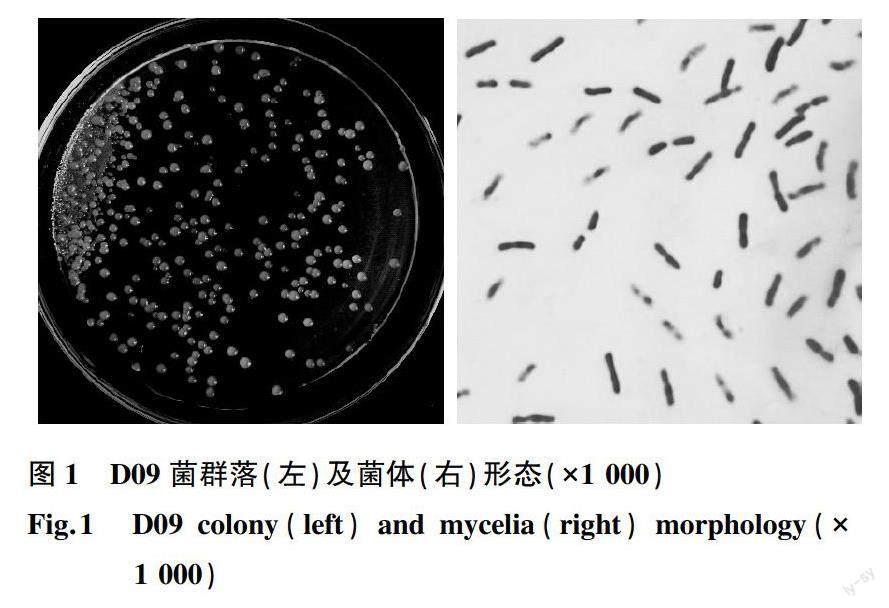
2.2.1 拮抗菌D09的形态学观察 筛选出的广谱抗病原真菌的木糖氧化无色杆菌(Achromobacter xylosoxidans)D09为赤霉病鉴定圃周边生长多年的吊兰根系中分离,中国典型培养物保藏中心保藏号为M20211002。菌株在PDA固体培养基上生长时,表面湿润、淡黄色、光滑、透明、微隆起、边缘较整齐、胶状、黏性强;革兰氏染色阴性,1 000倍显微镜下观察菌体短杆状(图1),长度为2.0~4.0 μm,宽度为0.5~0.9 μm。
2.2.2 拮抗菌D09的的生理生化特性 拮抗菌D09能利用D-葡萄糖、D-木糖、乳糖、蔗糖等多种碳源,产酸,能利用纤维素,明胶液化速度快,其他生理生化特征见表3。
2.2.3 拮抗菌D09的分子鉴定 拮抗菌D09的系统进化树见图2。16S rDNA的碱基序列长度为1 469 bp,在GenBank的登录号为CP012046.1。根据BLAST比对结果,并结合形态特征和生理生化特性,鉴定该菌株为木糖氧化无色杆菌(Achromobacter xylosoxidans)。
2.3 木糖氧化无色杆菌D09的抑菌谱
木糖氧化无色杆菌D09对12种病原真菌的抑菌效果如图3所示。D09菌株对所有测试的病原真菌均有不同程度的拮抗作用,表现出广谱抗病原真菌的特性。其中,对水稻纹枯病立枯丝核菌、芦笋颈枯病菌、香蕉褐缘灰斑病菌和大豆炭疽病菌的抑制率均达到70%以上(表4)。
2.4 木糖氧化无色杆菌D09对小麦赤霉病的田间防治效果
不同处理对小麦赤霉病的田间防治效果如表5。除戊唑多菌灵和苯甲嘧菌酯处理下的赤霉病病穗率比喷清水对照有显著降低,其他处理病穗率均在95.00%以上,与对照无显著差异。而各处理下病小穗率均显著低于喷清水对照;木糖氧化无色杆菌D09发酵液灌根处理和穗部喷雾处理后,病小穗率分别为14.42%和21.42%,比CK下降50.93%和27.12%;其中D09發酵液灌根处理病小穗率与苯甲嘧菌酯和氟硅唑穗部喷雾处理相当。化学药剂的防效大多在60%以上,而木糖氧化无色杆菌D09发酵液灌根处理和穗部喷雾处理的防效分别为50.93%和27.12%。
2.5 木糖氧化无色杆菌D09对小麦籽粒毒素含量的影响
不同处理下小麦籽粒DON、ZEN、NIV 3种毒素含量检测结果如表6所示。木糖氧化无色杆菌D09发酵液灌根处理小麦籽粒3种毒素的含量分别为0.628 mg/kg、0.016 mg/kg、1.308 mg/kg,穗部喷施D09发酵液处理小麦籽粒3种毒素的含量分别为0.836 mg/kg、0.080 mg/kg、2.688 mg/kg,均显著低于喷清水对照;D09发酵液灌根处理小麦籽粒3种毒素的含量均低于穗部喷施D09发酵液处理;D09发酵液灌根处理小麦籽粒DON毒素含量低于苯甲嘧菌酯穗部喷雾处理,与氟硅唑穗部喷雾处理相当;D09发酵液灌根处理小麦籽粒ZEN、NIV毒素含量与戊唑多菌灵穗部喷雾、苯甲嘧菌酯穗部喷雾、氟硅唑穗部喷雾处理相当。
3 讨论
3.1 无色杆菌属抑菌功能属性的发现
目前,国内外对无色杆菌研究主要在于其抑菌活性及降解农药残留、染料等功能方面[28-36],本研究在筛选鉴定木糖氧化无色杆菌菌株D09的基础上,进一步分析了菌株D09对小麦赤霉病的田间防治效果及小麦籽粒毒素含量的影响,为无色杆菌的农业应用进行了初步尝试。木糖氧化无色杆菌菌株D09已申请国家发明专利(申请号:2021110421242)。
3.2 微生物农药防治效果低于化学农药的探讨
本研究结果表明,木糖氧化无色杆菌D09发酵液灌根处理,虽然病穗率与清水对照差异不大,但病小穗率和防效与常用化学药剂苯甲嘧菌酯穗部喷雾、氟硅唑穗部喷雾等处理相当,而D09发酵液穗部喷雾处理虽然防治效果只有27.12%,但病小穗率亦显著低于清水对照,说明木糖氧化无色杆菌D09能有效抑制赤霉病病菌在穗部的扩散。总体来说,木糖氧化无色杆菌D09发酵液处理的防效不及化学杀菌剂,这与拮抗菌的作用机制及其对环境的敏感性有关。研究中D09灌根处理和穗部喷雾处理之间在病小穗率和防效上亦有一定差异,这说明不同施用方式对拮抗菌在田间的定殖有较大影响。木糖氧化无色杆菌D09在田间定殖情况及其与化学杀菌剂复配使用方法还需要进一步研究。
3.3 菌株D09对小麦籽粒毒素含量的探讨
本研究结果显示微生物农药或化学药剂对毒素的抑制效果和对赤霉病的防治效果不完全同步。如苯甲嘧菌酯穗部喷雾处理对赤霉病的控制效果高于D09发酵液灌根,防效达77.78%,但小麦籽粒3种毒素含量却高于D09发酵液灌根处理。Magan等研究结果表明,嘧菌酯降低了小麦赤霉病的发病率,但其处理过的小麦籽粒DON毒素含量较高,可能与嘧菌酯使用导致毒素累积有关[37];本研究中嘧菌酯处理后DON等毒素含量虽比对照有所减少,但和其他药剂相比,嘧菌酯对毒素的产生和累积的抑制效果较低。D09发酵液处理对小麦籽粒DON、ZEN、NIV 3种毒素含量的控制机理还需进一步研究。
致谢: 衷心感谢葛桂梅、黄继平、洪红升等同事对该试验给予的无私帮助!
参考文献:
[1] BAI G H. SHANER G. Management and resistance in wheat and barley to Fusarium head blight [J]. Annual Review of Phytopathology,2004,42(1):135-161.
[2] 邓 云.一株拮抗性多黏类芽孢杆菌的鉴定及其不同施用方法对小麦赤霉病的防效[J].福建农林大学学报(自然科学版),2022, 51(1):21-26.
[3] BAI G H, SU Z Q,CAI J. Wheat resistance to Fusarium head blight[J]. Canadian Journal of Plant Pathology,2018,40(3):336-346.
[4] ROCHA O, ANSARI K, DOOHANF M. Effects of trichothesene mycotoxins on eukaryotic cell: a review [J]. Food Addit Contam, 2005, 22: 369-378.
[5] ERIKSEN G S, ALEXANDER J. Fusarium toxins in cereals-a risk assessment [J]. Tema Nord, 1998, 502:7-44.
[6] 周雪婷. 粮食中DON的危害分析及快速测定方法研究进展[J].分析检测,2019,10(51): 169-172.
[7] RAMOS A, SANCHIS V, MAR?N S. The prehistory of mycotoxins: Related cases from ancient times to the discovery of aflatoxins. [J]. World Mycotoxin, 2011(4): 101-112.
[8] 李正辉,向晶晶,陈婧鸿,等.小麦赤霉病拮抗菌的分离与鉴定[J].麦类作物学报,2007,27(1): 149-152.
[9] 韩青梅,曹丽华.小麦赤霉病的生物防治研究进展[J].麦类作物学报,2003,23(3):128-131.
[10]成丽霞,彭 兵,李天金,等.一株具有广谱抗真菌活性细菌菌株的分离鉴定及拮抗物的理化特性[J].微生物学通报,2009,36(3):365-370.
[11]STURZ A V,CHRISTIE B R,NOWAK J.Baterial endophytes: Potential role in developing sustainable systems of crop production[J]. Critical Reviews in Plant Sciences,2000,19(1):1-30.
[12]金美芳,丁可武,林茂兹,等.多黏类芽孢杆菌S960抑制尖孢镰刀菌的活性物质分离纯化[J].安徽农业大学学报,2020,47(5):798-804.
[13]刘珂欣,辛寒晓,范学明,等.多黏类芽孢杆菌的固态发酵工艺及其对水稻恶苗病的防治作用[J].山东农业科学,2018,50(10):105-111.
[14]SALME T,NINA G,GERHART E H, et al.Paenibacillus polymyxa invades plant roots and forms biofilms [J]. Appl Environ Microbl,2005,71(11):7292-7300.
[15]田宇曦,闵 勇,杨自文,等.多黏类芽孢杆菌研究进展[J].湖北农业科学,2017,56(18):3401-3404,3409.
[16]李舒清.多黏类芽孢杆菌SQR-21中fus基因簇特征研究及基因组分析[D].南京:南京农业大学,2013.
[17]缪礼鸿,黄爱荣,周俊初.3株生防芽孢杆菌的筛选及对棉花枯萎病的防治研究[J].武汉工业学院学报,2008,27(1):1-4.
[18]郭 平. 抗肺炎克雷伯菌活性蜚蠊肠道无色杆菌次级代谢产物的初步研究[D].广州:广东药科大学,2021.
[19]王 兵. 无色杆菌产生的抗菌活性次生代谢产物的分离与鉴定[D].长沙:湖南师范大学,2018.
[20]田世尧,王晓容,潘建平,等.无色杆菌毒蛋白对菜粉蝶中肠的组织病理学影响[J].华南农业大学学报,2000(4):36-39.
[21]黄思琦. 二氯喹啉酸降解菌的筛选鉴定以及降解特性的研究[D].北京:中国农业科学院,2021.
[22]岳丽晓,李登云,张晶晶,等.一株敌草隆降解菌的分离及其应用潜能探索[J].生物技术通报,2020,36(6):110-119.
[23]王 剑,王 楠,高观朋,等.200亿芽孢/g枯草芽孢杆菌可湿性粉剂的研制[J].农药,2010,49(7):486-489.
[24]陈 雪,万 科,张传萍,等. 烟草赤星病拮抗细菌的筛选、鉴定及机制初步研究[J].生物学通报,2013,48(47):51-54,封3.
[25]朱 星,王若宇,汪 锐,等.萘降解菌的分离鉴定、生长特性和降解途径探究[J].环境污染与防治,2017,39(4):379-383.
[26]邓 云,苏 妍,刘 友,等.一种具有抗真菌活性的无色杆菌及其应用和保存:202111042124.2[P].2021-11-05.
[27]宫安东.镰刀菌和黄曲霉生防菌的分离及拮抗机理研究[D].武汉:华中农业大学,2015.
[28]沈敏雅,胡 江,蔡 舒,等.三乙胺降解菌SYA-1的分离、降解性能与动力学[J].环境工程学报,2014,8(3):1243-1249.
[29]羅金亮,周礼红,陈 平,等.一株类胡萝卜素高产菌的筛选与鉴定[J].湖北农业学报, 2013,52(10):2389-2392.
[30]荆新堂,李勤凡,张丽慧,等.呋喃丹降解菌CF-14的筛选及降解条件研究[J].华北农学报,2011,26(增刊):229-232.
[31]胡 甜,江林峰,陈青云,等.高效异养硝化细菌的分离筛选及多样性分析[J].湖北农业科学,2015,54(5):1181-1185.
[32]陈少华,罗建军,胡美英,等.一株拟除虫菊酯农药降解菌的分离鉴定及其降解特性与途径[J].环境科学学报,2011,31(8):1616-1626
[33]司美茹,苏 涛,杨 革,等.一株高效广谱染料降解细菌的分离鉴定及脱色特性研究[J].中国生物工程杂志,2010,30(6):70-76.
[34]李 妮,李明雄,雷 润,等.无色杆菌属孔雀绿脱色菌产脱色酶的条件研究[J].四川大学学报(自然科学版) ,2009,46(6):1882-1886.
[35]郑玉莲,许景钢,李淑芹,等. 普施特优势降解细菌的筛选与鉴定[J].东北农业大学学报,2009,40(6):40-44.
[36]张旭辉,孙 斌,魏志敏,等.2株耐镉微生物的筛选及对镉的吸附钝化差异机制[J].南京农业大学学报,2019,42(5):869-876.
(责任编辑:石春林)
