阿魏酸抑制p38 MAPK 信号传导对巨噬细胞M1 极化的作用
2023-06-07韦子强张雯雯郭嘉亮罗文汇郑兆广刘正谢倩曾煦欣
韦子强,张雯雯,郭嘉亮,3,罗文汇,郑兆广,3,刘正,3,谢倩,曾煦欣,3
(1.佛山科学技术学院,广东 佛山 528000;2.广东一方制药有限公司,广东 佛山 528000;3.佛山市药学会,广东 佛山 528000)
急性肝损伤(Acute liver injury,ALI)常伴有炎症反应的发生,过度且不可控的炎症反应会导致肝细胞的损伤和凋亡,进一步加重肝脏损伤[1]。巨噬细胞作为一类具有异质性、可塑性的免疫细胞,通过吞噬外来微生物并递呈抗原,分泌多种细胞因子参与炎症反应,在ALI 发病机制中起着重要作用[2]。同时研究也显示ALI 的加重与巨噬细胞极化为M1表型促进炎症反应相关[3],因此调控巨噬细胞极化抑制炎症反应可作为治疗ALI的重要切入点。阿魏酸(ferulic acid),化学名称为4-羟基-3-甲氧基肉桂酸,存在于当归、川芎等中药[4]。动物研究发现阿魏酸具有良好的抗炎功效,并可以改善ALI[5-6],但具体分子机制仍然缺乏相关研究。本文通过脂多糖(LPS)与干扰素-γ(IFN-γ)诱导巨噬细胞极化为M1表型,考察阿魏酸对其极化以及相关信号通路的影响,探讨阿魏酸抗炎作用的分子机制,为开发预防肝损伤药物提供实验依据。
1 材料与方法
1.1 主要材料
人单核细胞白血病THP-1 细胞株购自中国科学院上海细胞生物学研究所细胞中心;阿魏酸购自上海麦克林生化科技有限公司;RPMI1640 和胎牛血清(FBS)购自美国Gibco 公司;佛波酯(PMA)、脂多糖(LPS)均购自碧云天公司;干扰素-γ(IFN-γ)购自北京索莱宝科技有限公司;荧光标记抗体CD80+(human,APC)购自Abcam 公司;Cell Counting Kit-8、Human IL-1βELISA Kit、Human TNF-αELISA Kit购自广州真知生物科技有限公司;RNAprep pure培养细胞总RNA 提取试剂盒购自天根生化科技有限公司;SrimeScriptTMRT reagent Kit、TB Green®Premix Ex TaqTMII 均购自Takara 公司;兔抗人p-38 抗体、兔抗人磷酸化p38(p-p38)、兔抗人GAPDH 抗体均购自Abcam公司。
1.2 方法
1.2.1 THP-1 细胞培养和巨噬细胞诱导 将单核细胞株THP-1 细胞接种在含10%(φ)胎牛血清、1%双抗(青霉素及链霉素)的RPMI 1640 培养基中,37 ℃、5%(φ)CO2培养箱里培养。培养状态良好的3~5 代用于实验。THP-1 细胞用10 ng/mL PMA 经过24 h 诱导成M0 型巨噬细胞,更换新的培养基,加入10 ng/mL LPS 与20 ng/mL IFN-γ处理细胞48 h,使M0型向M1型巨噬细胞方向极化。
1.2.2 CCK-8测定细胞活性 在96孔板中每孔加入THP-1 细胞(1×104/mL)100 μL 的细胞悬液。对THP-1 细胞诱导成M0 型巨噬细胞后,再进行M1 型极化诱导48 h,同时每组加入阿魏酸20、40、60、80、100 μmol/L。按照CCK-8 试剂盒说明书进行检测,用酶标仪测定450 nm处吸光度值(A值)。根据结果计算各组的细胞活性,确定阿魏酸对M1型巨噬细胞的安全浓度范围。细胞活性(viability)=加药培养组(A值)/空白对照组(A值)×100%,实验独立重复3次。
1.2.3 流式细胞分析仪检测M1 型巨噬细胞标志物 经过CCK-8 法测定阿魏酸对M1 型巨噬细胞的安全浓度范围后,在6 孔板中每孔加入THP-1细胞(2×106/mL)1 mL 的细胞悬液,诱导成M0 型巨噬细胞后,再进行M1 型极化诱导48 h,同时每组加入阿魏酸20、40、60、80 μmol/L。通过胰酶消化后,1 000 r/min 离心5 min 收集细胞,PBS 清洗3 次,用1%BSA进行封闭1 h去除非特异性结合,在M1型巨噬细胞加入CD80+荧光抗体进行4 ℃孵育30 min,结束后PBS洗涤3次,加入PBS重悬,使用流式细胞分析仪对M1型巨噬细胞标志物进行检测,实验独立重复3次。
1.2.4 酶联免疫吸附实验(ELISA)检测TNF-α、IL-1β蛋白含量 收集上述各组M1 型巨噬细胞的上清液,检测M1型巨噬细胞分泌蛋白TNF-α、IL-1β的表达。其具体步骤按ELISA 试剂盒说明书进行操作,450 nm 下测定各组A 值,计算相关蛋白表达量,实验独立重复3次。
1.2.5 实时荧光定量PCR 法检测mRNA 的表达水平 在6 孔板中每孔加入THP-1 细胞(1×107/mL)1 mL 的细胞悬液,诱导成M0 型巨噬细胞,再进行M1 型极化诱导48 h,同时每组加入阿魏酸20、40、60、80 μmol/L。通过胰酶消化后,1 000 r/min 离心5 min 收集细胞,冰冷PBS 洗涤。具体步骤按总RNA 提取试剂盒、反转录试剂盒和Real Time PCR试剂盒说明书进行操作,RT 条件:37 ℃,15 min;85 ℃,5 s;PCR 反应条件:预变性:95℃,30 s;PCR反应:40个循环,95℃,5 s,60 ℃,30 s。引物见表1。以GAPDH 内参基因校正,对特异性扩增目标基因进行相对定量,采用2-ΔΔCt法[7]计算各组细胞的TNFα、IL-1βmRNA表达水平,实验独立重复3次。

表1 Real Time PCR引物序列Table 1 Real time PCR primer sequences
1.2.6 Western blot 法检测p-38和p-p38的表达
实验分组及处理同“1.2.5”项下操作,从各细胞组中提取细胞浆蛋白,通过BCA法测蛋白浓度。各取5 μg蛋白上样进行SDS-聚丙烯酰胺凝胶电泳,通过转膜将蛋白转移到PVDF 膜上,封闭2 h,分别加入适宜浓度的p38 MAPK、p-p38 MAPK 和GAPDH抗体,4 ℃摇床孵育过夜。使用TBST 洗膜后,用二抗进行孵育,再次洗膜后加入ECL 化学发光试剂在Odyssey FC 仪器上进行检测显色条带,以GAPDH为内参。结果应用Image one软件进行总灰度分析,计算p38 MAPK、p-p38 MAPK 的相对表达量,实验独立重复3次。
1.2.7 统计学处理
采用SPSS20.0 统计软件进行数据处理和分析,实验数据以x±s表示,两组间差异比较采用t检验;多组数据比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 阿魏酸对M1型巨噬细胞活性的影响
结果如图1 所示,与对照组相比,M1 型巨噬细胞在阿魏酸浓度20 ~80 μmol/L 的细胞活性均无显著性差异(P>0.05),当阿魏酸浓度为100 μmol/L时,细胞活性明显下降(P<0.05)。因此选择阿魏酸浓度为20~80 μmol/L进行后续实验。
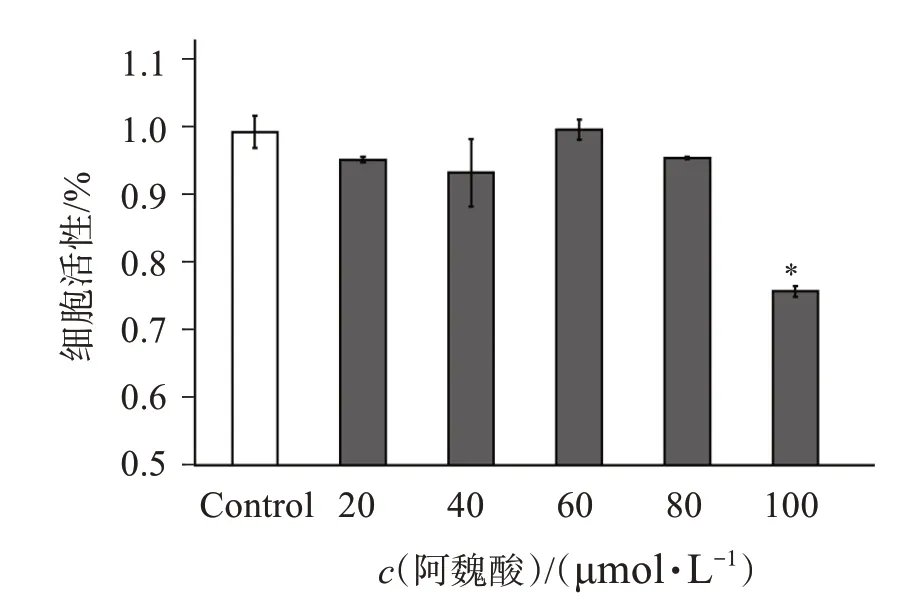
图1 不同浓度阿魏酸对M1型巨噬细胞活性影响Figure 1 Effect of different concentrations of ferulic acid on the activity of M1 type macrophages
2.2 阿魏酸对M1型巨噬细胞表面标志物的影响
流式细胞仪检测结果如图2所示。随着阿魏酸浓度的增加,M1型巨噬细胞标志物CD80+的表达显著降低(P<0.05),说明阿魏酸抑制M0 型巨噬细胞向M1型极化。

图2 阿魏酸对M1型巨噬细胞标志物CD80+表达的影响Figure 2 Effect of ferulic acid on the expression of M1 type macrophages marker CD80+
2.3 阿魏酸对M1型巨噬细胞分泌蛋白的影响
ELISA 和Real-time PCR 实验结果如图3 所示,与对照组相比,20~80 μmol/L 的阿魏酸能抑制M1型巨噬细胞TNF-α、IL-1β蛋白和mRNA 的表达(P<0.05),上述作用呈剂量依赖性。说明阿魏酸抑制M0 型巨噬细胞向M1 型极化,进而减少M1 型巨噬细胞分泌产物。

图3 阿魏酸对M1型巨噬细胞TNF-α、IL-1β蛋白和mRNA表达的影响Figure 3 Effect of ferulic acid on the expression of TNF-α,IL-1β protein and mRNA in M1 type macrophages
2.4 阿魏酸对M1 型巨噬细胞p38 MAPK 信号通路的影响
Western blot 实验结果如图4 所示,与对照组相比,p-p38/p38 MAPK蛋白表达比例随着阿魏酸浓度升高而降低(P<0.05)。说明阿魏酸能够显著抑制p38 MAPK信号通路活化。
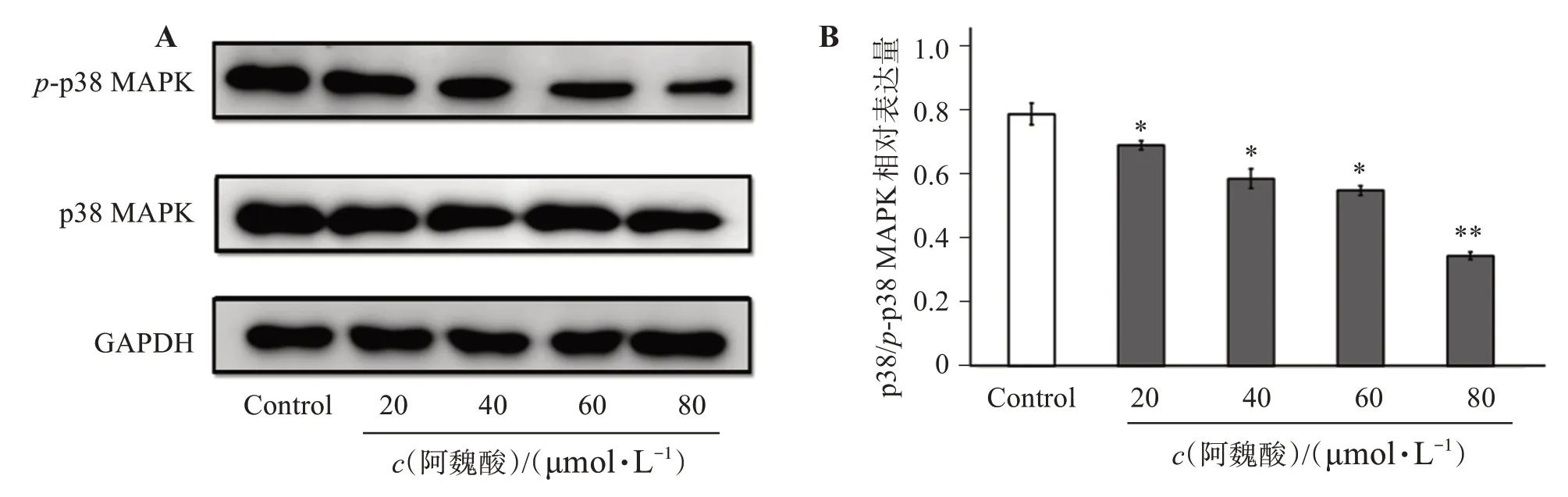
图4 阿魏酸对M1型巨噬细胞p38 MAPK信号通路蛋白表达的影响Figure 4 Effect of ferulic acid on the protein expression of p38 MAPK signaling pathway in M1 type macrophages
3 讨论
ALI 可由不同诱因造成的肝脏急性炎症性疾病[8]。炎症反应在ALI 治疗进展中有着重要作用,因此调控炎症反应治疗ALI 成为研究热点[9]。巨噬细胞作为一类具有异质性、可塑性的免疫细胞,可分为2 个极化表型:促炎的M1 型和抗炎的M2型[10-11]。研究发现,在ALI 大鼠模型中M1 型和M2型巨噬细胞共同参与了肝损伤进程,并在病变进展过程中相互转化[12],M1 型巨噬细胞促进炎症反应,使ALI加重[3]。表明巨噬细胞极化与ALI密切相关。
近年研究发现阿魏酸可以显著降低LPS诱导巨噬细胞分泌产物[13-14]。本研究结果表明,阿魏酸通过减少M1型巨噬细胞标志物CD80+的表达,抑制了M0型巨噬细胞向M1型极化,同时降低M1型巨噬细胞TNF-α和IL-1β分泌产物的蛋白和mRNA 表达水平。由此说明阿魏酸通过抑制巨噬细胞向M1 型极化,减少TNF-α等炎症因子的释放,最终产生抗炎作用。
为了深入研究阿魏酸抑制M1 型巨噬细胞极化的具体分子机制,本研究进一步考察阿魏酸p38 MAPK 信号通路对M1 型极化的影响。p38 MAPK信号通路广泛参与巨噬细胞活动,包括增殖、分化和免疫反应[15],同时是调控巨噬细胞极化的主要通路。谢娟等[16]研究发现PICK1 可以促进p38 MAPK信号通路,使巨噬细胞向M2 型极化,增加Arg-1 和IL-10 等抗炎因子的释放,进而改善急性肝损伤疾病。肖芳等[17]表示纤维介素蛋白2(FGL2)可以抑制p38 MAPK蛋白磷酸化水平,促进M1型巨噬细胞极化,增加IL-6、TNF、IL-1β等炎症因子表达,从而减轻肝脏损伤。本研究发现阿魏酸可下调M1 型巨噬细胞的p-p38/p38 MAPK 蛋白表达比例,表明阿魏酸影响巨噬细胞M1 极化的机制是抑制p38 MAPK信号通路活化。文献显示核转录因子(Nrf2)参与调节p38 MAPK 信号通路[18],二烯丙基二硫和雷公藤酚都可以通过激活Nrf2 抑制p38 MAPK 信号通路,进而抑制M1 型巨噬细胞极化,减少炎症因子的分泌[19-20]。由此提示在后续研究中可通过考察阿魏酸对巨噬细胞极化过程中Nrf2 核转录因子的作用,进一步挖掘深化其抗炎分子机制。
综上所述,本研究提示阿魏酸可能通过抑制p38 MAPK 信号通路实现对巨噬细胞极化的调控,发挥抗炎作用,进而改善ALI。此外,M2 型巨噬细胞可分泌抗炎因子进行组织修复,理论上有助于减轻ALI[3]。因此,本研究后续除继续深入探讨阿魏酸调控M1 型巨噬细胞极化的分子机制外,还将考察阿魏酸对M2 型巨噬细胞极化的作用机制,为ALI的药物研发提供更多参考依据。
