系统性炎症反应指数与卒中后抑郁的关系:基于倾向评分匹配及逆概率处理加权法
2023-06-07黄小妹胡填叶玉焊徐吟文古剑雄
黄小妹,胡填,叶玉焊,徐吟文,古剑雄
卒中后抑郁(post-stroke depression,PSD)是常见的脑卒中后神经精神并发症,综合发病率为31%,临床症状表现为持续2周以上出现的心境低落、快感缺乏、精力减退与懒言少语等情绪障碍[1-3]。抑郁症状的出现降低了脑卒中患者康复治疗效果和生活质量,增加了不良事件和死亡的风险,因此,指南和专家共识强调了早期识别和防治PSD的必要性[4-5]。研究证实,炎症因子可作为PSD的预测、诊断标志物,如白介素、肿瘤坏死因子α和γ干扰素等[6]。中性粒细胞、淋巴细胞和血小板等作为外周炎症标志物,被报道能敏感地反映机体炎症状态[7]。系统性炎症反应指数(system inflammation response index,SIRI)是一种基于中性粒细胞、单核细胞和淋巴细胞的综合新型炎症标志物,最早由QI等[8]定义,用于预测胰腺癌患者化疗后的生存率。研究证实,SIRI升高增加了精神分裂症和双相情感障碍等精神疾病的发生风险[9],然而,目前尚不清楚SIRI是否与PSD的发生发展具有相关性。本研究基于美国国家健康和营养检查调查(National Health and Nutrition Examination Survey,NHANES)数据库,采用倾向评分匹配(propensity score matching,PSM)和逆概率处理加权法(inverse probability of treatment weighting,IPTW)处理患者基线不均衡情况,进而探讨SIRI与PSD的关系,现报道如下。
1 对象与方法
1.1 研究对象 选取2007—2018年NHANES数据库中自我报告的年龄>20岁的脑卒中患者1 398例。按照以下排除标准进行筛选:(1)抑郁症的诊断信息缺失(n=270);(2)缺少血液样本(n=53);(3)人口学特征资料不完整(n=59)。最终纳入1 016例脑卒中患者作为研究对象。NHANES数据库是美国一个开放获取的数据库,其研究程序已获得美国国家卫生统计中心机构审查委员会批准,并获得了所有参与者书面知情同意,更多的伦理信息详见http://www.cdc.gov/nchs/nhanes/irba98.htm。
1.2 资料收集 收集脑卒中患者的临床资料,包括性别、年龄、BMI、受教育程度、婚姻状况、吸烟史、饮酒史、高血压史、糖尿病史、心血管疾病史(包括充血性心力衰竭、冠心病、心绞痛及心脏病史)、中性粒细胞计数、单核细胞计数、淋巴细胞计数,计算SIRI,SIRI=中性粒细胞计数×单核细胞计数/淋巴细胞计数[8]。
1.3 PSD诊断标准 采用患者健康问卷(Patient Health Questionnaire-9,PHQ-9)对脑卒中患者抑郁症情况进行评估,PHQ-9评分≥10分定义为抑郁症[10]。
1.4 统计学方法 采用R 4.1.3统计学软件进行数据处理。计数资料以相对数表示,组间比较采用χ2检验;SIRI以〔M(P25,P75)〕表示,采用ROC曲线分析SIRI诊断PSD的最佳截断值;采用PSM(1∶1邻近配对法)和IPTW校准混杂因素;采用标准化均数差(standardized mean differences,SMD)评估低SIRI组与高SIRI组各协变量的均衡性,以SMD<0.1为组间均衡性较好,认为组间差异较小[11];采用多因素Logistic回归分析探讨SIRI对PSD的影响,根据性别、年龄、BMI、高血压史、糖尿病史、心血管疾病史进行亚组分析,交互作用检验用于评估亚组之间关联的异质性。以P<0.05为差异有统计学意义。
2 结果
2.1 PSD组与非PSD组临床资料比较 1 016例脑卒中患者中,合并抑郁症189例(18.60%),归为PSD组,其余827例(81.40%)患者未合并抑郁症,归为非PSD组。PSD组与非PSD组受教育程度、饮酒史、高血压史、糖尿病史比较,差异无统计学意义(P>0.05);PSD组与非PSD组性别、年龄、BMI、婚姻状况、吸烟史、心血管疾病史比较,差异有统计学意义(P<0.05),见表1。

表1 PSD组与非PSD组临床资料比较〔n(%)〕Table 1 Comparison of clinical data between the PSD group and the non-PSD group
2.2 低SIRI组与高SIRI组临床资料比较 1 016例脑卒中患者的SIRI为1.2×109(0.8×109,1.9×109)。ROC曲线分析结果显示,SIRI诊断PSD的最佳截断值为1.5×109。根据SIRI诊断PSD的最佳截断值将患者分为低SIRI组(SIRI<1.5×109,n=627)和高SIRI组(SIRI≥1.5×109,n=389),采用PSM处理后低SIRI组和高SIRI组各389例,采用IPTW处理后低SIRI组和高SIRI组各1 015例。匹配前低SIRI组与高SIRI组BMI、婚姻状况、饮酒史比较,差异无统计学意义(P>0.05);匹配前低SIRI组与高SIRI组性别、年龄、受教育程度、吸烟史、高血压史、糖尿病史、心血管疾病史比较,差异有统计学意义(P<0.05)。PSM、IPTW处理后低SIRI组与高SIRI组性别、年龄、BMI、受教育程度、婚姻状况、吸烟史、饮酒史、高血压史、糖尿病史、心血管疾病史比较,差异无统计学意义(P>0.05),见表2。匹配前低SIRI组和高SIRI组性别、年龄、BMI、受教育程度、婚姻状况、吸烟史、饮酒史、高血压史、糖尿病史、心血管疾病史SMD>0.1;PSM处理后低SIRI组和高SIRI组受教育程度、心血管疾病史SMD=0.1,性别、年龄、BMI、婚姻状况、吸烟史、饮酒史、高血压史、糖尿病史SMD<0.1;IPTW处理后低SIRI组和高SIRI组性别、年龄、BMI、受教育程度、婚姻状况、吸烟史、饮酒史、高血压史、糖尿病史、心血管疾病史SMD<0.1,见图1。

图1 匹配前、PSM处理后及IPTW处理后低SIRI组和高SIRI组各协变量的SMDFigure 1 Standardized mean differences of covariates adjusted for PSM and IPTW between low SIRI group and high SIRI group
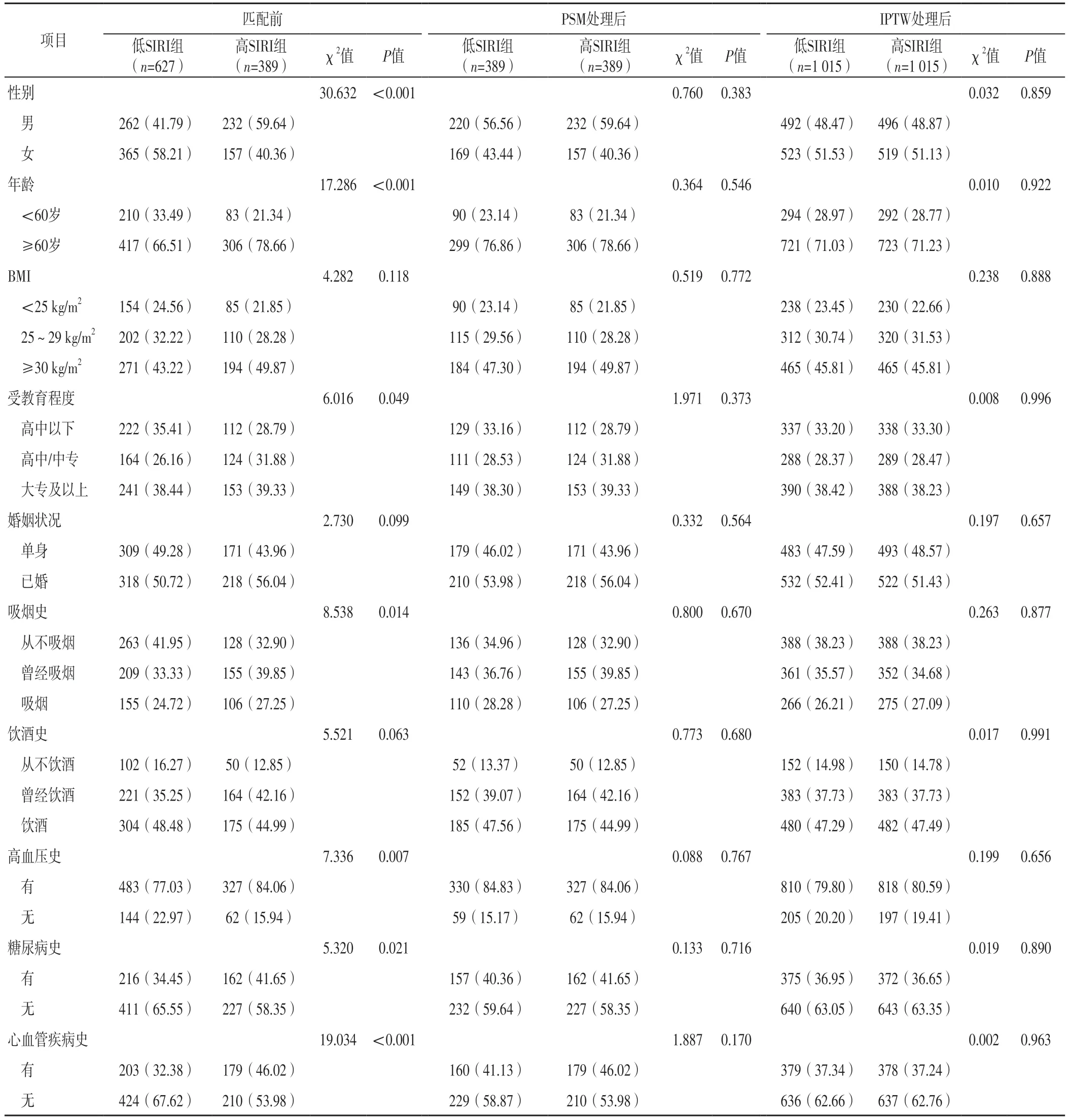
表2 匹配前、PSM处理后及IPTW处理后低SIRI组与高SIRI组临床资料比较〔n(%)〕Table 2 Comparison of covariate equilibrium of study participants after adjustment for PSM and IPTW
2.3 SIRI对PSD的影响 以脑卒中患者是否发生PSD为因变量(赋值:否=0,是=1),以SIRI为自变量(赋值:<1.5×109=0,≥1.5×109=1),以性别、年龄、BMI、受教育程度、婚姻状况、吸烟史、饮酒史、高血压史、糖尿病史、心血管疾病史为协变量,进行多因素Logistic回归分析,结果显示,匹配前SIRI与PSD不相关〔β=0.26,SE=0.16,Waldχ2=2.641,OR=1.298,95%CI(0.941,1.787),P=0.111〕;PSM处理后,SIRI≥1.5×109是PSD的独立危险因素〔β=0.44,SE=0.19,Waldχ2=5.363,OR=1.556,95%CI(1.075,2.265),P=0.020〕;IPTW处理后,SIRI≥1.5×109是PSD的独立危险因素〔β=0.37,SE=0.11,Waldχ2=11.314,OR=1.444,95%CI(1.158,1.805),P<0.001〕。
2.4 亚组分析 亚组分析结果显示,在男性、年龄<60岁、BMI≥30 kg/m2、有高血压史、有心血管疾病史患者中,SIRI≥1.5×109是PSD的独立危险因素(P<0.05)。交互作用检验结果显示,年龄可能是影响SIRI与PSD关系的因素(P<0.05),见图2。
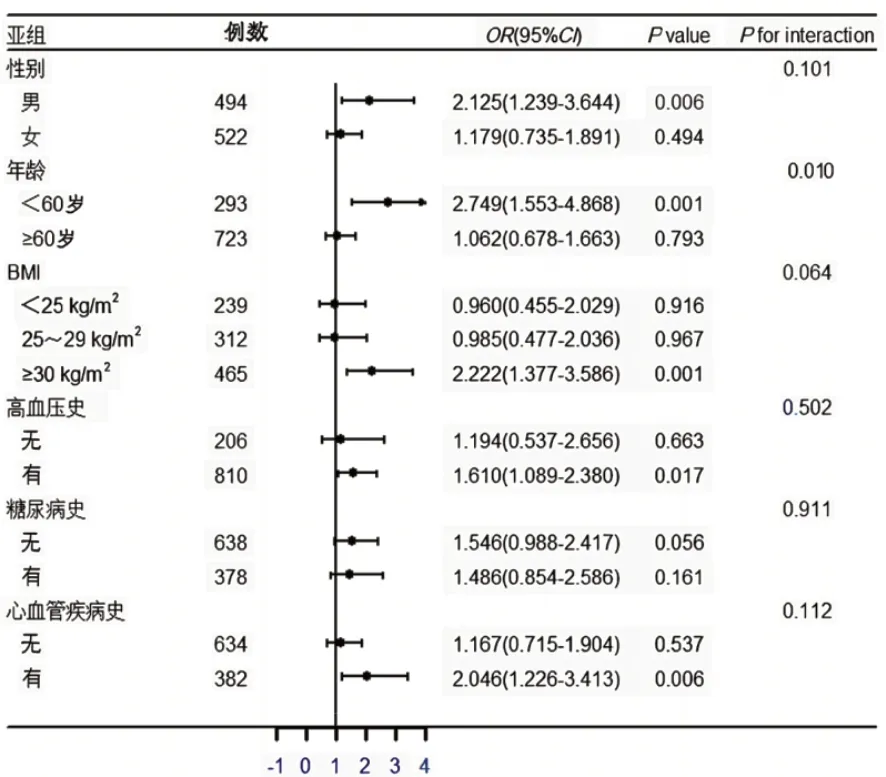
图2 SIRI与PSD关系的亚组分析Figure 2 Subgroup analysis of the associations between SIRI and PSD
3 讨论
目前,临床一线工作者对于PSD的识别和诊断普遍使用抑郁症筛查量表,如汉密尔顿抑郁量表、医院焦虑抑郁量表和Zung抑郁自评量表等[12-13]。上述量表多以结构化访谈或自评形式进行,虽便于在临床上应用,但多数量表依赖于患者的独立选择,侧重于患者的主观心理方面,对合并失语症或述情障碍的脑卒中患者并不适用[14],同时,部分筛查工具存在信度和效度较低的问题[15]。因此,探寻生物学标志物预测和辅助诊断PSD是当下研究的热点。
本研究结果显示,PSD发生率为18.60%,与既往研究结果[16]基本一致。PSD的病理生理学机制尚不明确,存在诸多假说,有学者认为,PSD的发生与机体炎症反应有关,包括先天免疫系统和获得性免疫系统的失调[17]。本研究结果显示,经PSM及IPTW调整性别、年龄、BMI、受教育程度、婚姻状况、吸烟史、饮酒史、高血压史、糖尿病史、心血管疾病史等变量后,SIRI≥1.5×109是PSD的独立危险因素。SIRI由中性粒细胞计数、单核细胞计数和淋巴细胞计数计算所得,研究显示,SIRI作为一种廉价且易检测的生物标志物,能精准反映机体的炎症状态,具有在临床上广泛应用的前景[8]。SIRI升高提示患者机体中性粒细胞增多、单核细胞增多或淋巴细胞减少。
既往研究证实,脑卒中后患者体内炎症反应被激活,中性粒细胞于短时间内从外周血管向脑损伤区域迁移,同时,中性粒细胞释放多种炎症递质和促炎因子,如基质金属蛋白酶9、白介素1β和趋化因子等[18-19]。炎症递质会诱导一系列炎症反应,同时激活血小板,而活化的血小板可改变血管内皮细胞的特性,促使单核细胞和中性粒细胞进一步迁移至脑水肿区,导致炎症级联反应,从而增加血脑屏障的通透性,进一步加重脑损伤区域的炎症反应[20-21]。SIRI可作为PSD的辅助诊断标志物,一方面,患者机体炎症反应使神经内分泌功能发生改变,同时减少了单胺类神经递质的合成和分泌,而以5-羟色胺为主的单胺类神经递质异常改变已被证实与抑郁症的发生有关[22];另一方面,抑郁症发展的基础是小胶质细胞的活化和单核细胞迁移至脑内[23],且单核细胞释放的肿瘤坏死因子α和白介素6被发现在抑郁症患者机体中明显升高[24]。研究显示,淋巴细胞在脑损伤区域的继发性损伤和外周免疫抑制中具有重要作用,其中CD4+T淋巴细胞、CD8+T淋巴细胞及双阴性T淋巴细胞可分泌多种细胞毒性物质和炎症细胞因子,从而加剧炎症反应,而辅助性T细胞2及调节性T细胞则可抑制脑卒中后的神经炎症反应[25]。
本研究亚组分析结果显示,在男性、年龄<60岁、BMI≥30 kg/m2、有高血压史、有心血管疾病史患者中,SIRI≥1.5×109是PSD的独立危险因素。现阶段,性别是否影响外周炎症标志物与抑郁症关系的研究较少且存在争议,VOGELZANGS等[26]研究发现,男性抑郁症患者C反应蛋白和白介素6等炎症标志物水平较健康者明显升高,而在女性抑郁症患者中未发现此结果;RAMSEY等[27]得出了相同的结论;而在另一项研究中,仅女性抑郁症患者C反应蛋白水平升高[28],上述研究表明性别可能影响外周炎症标志物与抑郁症的关系,但仍需大量研究明确其相关性。WANG等[29]研究发现,中性粒细胞/淋巴细胞比值与糖尿病患者发生抑郁症存在年龄差异,<65岁糖尿病患者中性粒细胞/淋巴细胞比值升高与发生抑郁症独立相关,而在≥65岁人群中未发现此关联。年龄影响外周炎症标志物与抑郁症关系的机制尚不明确,仍需大量研究进行探讨。此外,有证据显示,肥胖、有高血压史和有心血管疾病史人群体内炎症反应活跃,这可能导致SIRI升高,从而诱导抑郁症的发生[30-32]。
综上所述,SIRI≥1.5×109是PSD的独立危险因素,尤其在男性、年龄<60岁、BMI≥30 kg/m2、有高血压史、有心血管疾病史的脑卒中患者中。SIRI可作为PSD的辅助诊断标志物,以帮助临床医生早期对PSD做出诊断。本研究存在一定的局限性:(1)本研究为横断面研究,尚不能明确SIRI与PSD的因果关系;(2)由于NHANES数据库缺乏相关变量,如脑卒中病变位置、神经功能受损程度等,不排除上述变量对结果的影响。后续有必要进行前瞻性队列研究以进一步明确SIRI与PSD的因果关系。
作者贡献:胡填进行文章的构思与设计,统计学处理;黄小妹进行研究的实施与可行性分析,论文的修订;叶玉焊、徐吟文进行资料收集、整理;黄小妹、胡填负责论文撰写;胡填、古剑雄负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
