多模态融合技术三维重建岩上静脉
2023-06-07吴世源何浩强陈正和牟永告李严兵黄文华钟世镇
吴世源,何浩强,陈正和,牟永告,李严兵,黄文华,4,钟世镇
1.南方医科大学基础医学院人体解剖学国家重点学科,广东省数字医学与生物力学重点实验室,广东省医学3D 打印应用转化工程技术研究中心,广州 510515;2.中山大学肿瘤防治中心影像科,广州 510000;3.中山大学肿瘤防治中心神经外科/神经肿瘤科,华南肿瘤学国家重点实验室,癌症医学协同创新中心,广州 510000;4.南方医科大学第三附属医院,广东省医学3D打印应用转化创新平台,广州 510000
岩上静脉(Superior petrosal vein,SPV)是在桥小脑角的手术中经常遇到的路障静脉[1]。岩上静脉复合体(Superior petrosal vein complex,SPVC)是颅后窝最恒定,最大的引流系统之一[2]。损伤SPVC 可能会导致严重并发症,固其解剖变异在颅底手术的策略制定中是必然需要考虑的[3]。由于SPVC 的变异较多,所以对于SPV 的保护是神经外科的难题[4]。
目前SPV 大部分局限于大体解剖研究[5,6]。例数的限制加上静脉的变异,以此得到的解剖分型不具有客观性。也有部分学者利用影像学的方法来对SPV进行研究[4,7]。其中有利用数字减影血管造影术(DSA)进行的研究,但因为是有创操作,且不能大面积推广而具有一定局限性。只用磁共振血管成像技术(MRA)也有缺乏毗邻的参照物做对比研究的缺点。
对于SPV 的位置判断和分型判断需要借助固定的骨性标志。根据不同影像学手段对不同类型组织成像显影和精度的差异,实现多模态影像融合,有利于准确地反映颅骨、颅内血管等组织的解剖学关系[8],为临床提供相应个性化参考。
磁共振对于SPV 及SPV 属支构成的SPVC 的成像参数目前没有明确标准,影像检测时重建精度不高易导致SPVC 结构丢失。基于CE-MRA 和CT 等多模态影像融合的手段对SPVC 解剖形态学的前瞻性研究可能会更加准确地体现SPV 的变化。
1 材料与方法
1.1 研究对象和仪器
采集2020 年06 月至2020 年12 月在中山大学肿瘤防治中心脑部疾病需行CE-MRA 扫描检查的34 例患者作为研究对象,其中有17 例同时行CT 扫描检查。20 例为男性,14 例为女性,平均年龄55 岁。排除标准:颅后窝存在肿瘤和二次手术病人。所有对象均无CE-MRA 检查和CT 检查禁忌症,并被告知实验介绍并签署相关知情同意书。
纳入资料设备为中山大学肿瘤防治中心的核磁共振成像扫描仪(联影uMR790 3T),电子计算机断层扫描仪(SIRMENS SOMATOM Force),图像处理工作站MIP 后处理软件(联影uMR79),3Dslicer。
1.2 研究方法
1.2.1 扫描参数及造影剂应用 磁共振:(1)扫描序列包括CEMRA 及常规颅脑平扫+增强序列:AxT2WI、AxT1 FLAIR、AxDWI、AxT2 FLAIR FS、Sag Bravo 3D+C(薄层各向同性)。CEMRA 相关参数:FOV 240 mm×210 mm;矩阵576×504;层数178;层厚0.46 mm;TR/TE 8.54/3.16 ms;翻转角30°;带宽130 Hz/像素,采用椭圆形中心k 空间填充,不对称k 空间采样(部分傅里叶6/8),在所有3 个平面中均进行零插值。扫描后经图像处理工作站MIP 后处理软件(联影)辅助判断显影效果。(2)造影剂用量在符合用药规定前提下按0.2 ml/kg、0.3 ml/kg 给药,造影剂推注速度在1.5、2.0、2.5、3.0 ml/s 之间调整,开始扫描时间在20、30、40 s 之间调整。
电子计算机断层扫描仪:192 排双源螺旋CT 扫描仪,自适应kV、mAs(参考值100 kV,660 mAs),患者取仰卧位,从颅顶往下扫包全枕骨大孔,螺旋容积扫描,重建1 mm 层厚图像。
1.2.2 数据导入 将头部CEMRA 和CT 的原始数据(DICOM)同时导入3Dslicer。
1.2.3 配准 选择General Registration 模块,其中Fixed volume 设置为CEMRA,Moving volume 设置为CT,点击Apply 后自动出现配准好的二维图像。把配准好的二维图像打包保存为包1。
1.2.4 阈值分割(颅骨部分)重新打开3Dslicer,把包1 导入3Dslicer,在二维视图窗的底选CE-MRA,进行阈值分割后建立三维模型,打包保存为包1a。
1.2.5 阈值分割(血管部分)重新打开3Dslicer,把包1 导入3Dslicer,在二维视图窗的底选volume,阈值分割后建立三维模型,打包保存为包1b。
1.2.6 多模态融合 包1、包1a、包1b 一起导入3Dslicer 可得到颅骨和血管三维融合图。
1.2.7 测量模块测量 血管测量:运用3Dslicer 软件中的Vascular modeling toolkit 模块中的Extract Centerline进行中心线的提取,用Markups 模块对岩上静脉段的中心线进行测量。
血管与骨性标志的距离测量:用3Dslicer 软件的Markups 模块对多模态融合的血管和骨性标志进行测量。
2 结果
2.1 造影效果调试(图1、图2)

图1 不同造影精度的三维显影效果A,B,C,D 图均为图像处理工作站MIP 后处理软件上的三维影像截图。A 为造影精度为乙状窦等大静脉时的三维影像截图;B 为造影精度为SPS 时的三维影像截图;C 为造影精度为SPV 时的三维影像截图;D 为造影精度为SPV 属支时的三维影像截图Fig.1 Three-dimensional development effect with different contrast accuracyA,B,C,D were 3D image screenshots on MIP post-processing software of image processing workstation. A: 3D image screenshot when the contrast accuracy was the sigmoid sinus and other large veins; B: the 3D image screenshot when the contrast accuracy was SPS; C: the 3D image screenshot when the contrast accuracy was SPV; D: the 3D image screenshot when the contrast accuracy was SPV tributary
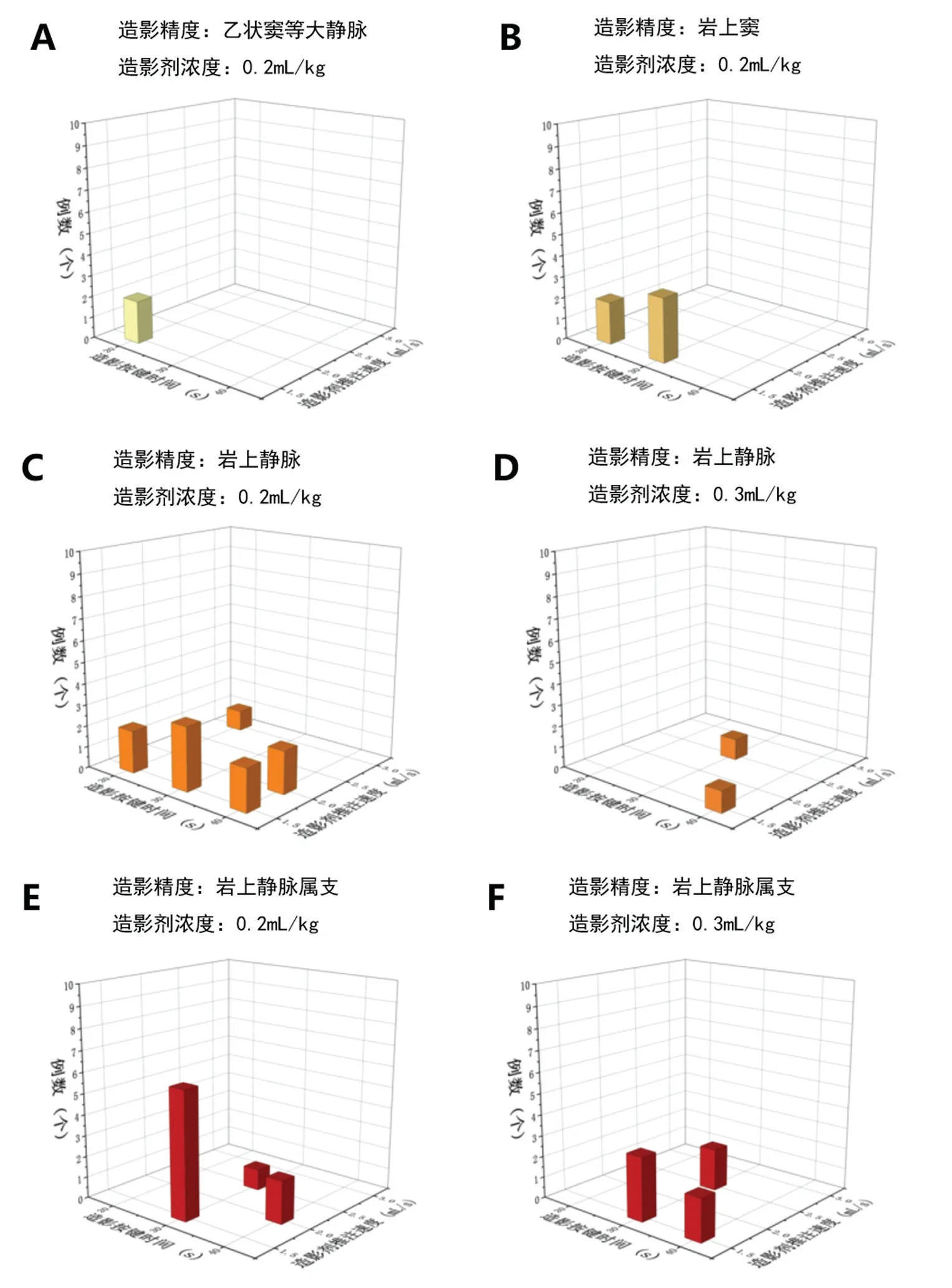
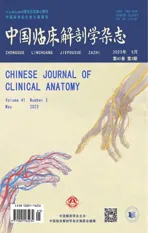
图2 不同浓度造影剂、不同扫描按键时间、不同造影剂推注速度下得到的四种造影精度例数共完成34 例造影。造影剂的浓度为0.2 ml/kg,造影精度为乙状窦等大静脉的有2 例(A);造影剂的浓度为0.2 ml/kg,造影精度为SPS 的有5 例(B);造影剂的浓度为0.2 ml/kg,造影精度为SPV 的有10 例(C);造影剂浓度为0.3 ml/kg,造影精度为SPV 的有2 例(D);造影剂的浓度为0.2 ml/kg,造影精度为SPV 属支的有8 例(E);造影剂浓度为0.3ml/kg,造影精度为SPV 属支的有7 例(F)Fig.2 Four kinds of contrast accuracy obtained under different concentrations of contrast agent,different scanning key time and different contrast agent injection speedA total of 34 patients underwent angiography.The concentration of contrast agent was 0.2 ml/kg and the accuracy of contrast was as high as the sigmoid sinus veins in 2 cases (A).The concentration of contrast agent was 0.2 ml/kg,and the accuracy of contrast was SPS in 5 cases (B).The concentration of contrast agent was 0.2 ml/kg,and the accuracy of contrast was SPV in 10 cases (C).The concentration of contrast agent was 0.3 ml/kg and the accuracy of contrast was SPV in 2 cases (D).The concentration of contrast agent was 0.2 mL/kg,and the accuracy of contrast was SPV branch in 8 cases (E).The concentration of contrast agent was 0.3 ml/kg,and the accuracy of contrast was SPV branch in 7 cases (F)
磁共振扫描仪对乙状窦等大静脉的显影较为容易(图1A)。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后20 s,造影剂推注速度为1.5 ml/s,此条件下仅显示乙状窦等大静脉的例数为2 例(图2A)。
调节参数后显影相对较容易的为岩上窦(Superior petrosal sinus,SPS)(图1B)。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后20 s,造影剂推注速度为1.5 ml/s 的条件下仅显示到SPS 的例数为2 例(图2B)。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后30 s,造影剂推注速度为1.5 ml/s 的条件下仅显示到SPS 的例数为3 例(图2B)。
SPV(图1C)的显影参数调节较难。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后20 s,造影剂推注速度为1.5 ml/s 的条件下仅显示到SPV 的例数为2 例(图2C)。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后30 s,造影剂推注速度为1.5 ml/s 的条件下仅显示到SPV 的例数为3 例(图2C)。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后40 s,造影剂推注速度为1.5 ml/s 的条件下仅显示到SPV 的例数为2 例(图2C)。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后20 s,造影剂推注速度为3 ml/s 的条件下仅显示到SPV 的例数为1 例(图2C)。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后40 s,造影剂推注速度为3 ml/s 的条件下仅显示到SPV 的例数为2 例(图2C)。在造影剂的浓度为0.3ml/kg,造影按键时间为推注造影剂后40 s,造影剂推注速度为1.5 ml/s 的条件下仅显示到SPV 的例数为1例(图2D)。在造影剂的浓度为0.3 ml/kg,造影按键时间为推注造影剂后30 s,造影剂推注速度为2.5 ml/s 的条件下仅显示到SPV 的例数为1 例(图2D)。
对SPS、SPV、SPV 属支的全部显影(图1D)难度最大。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后30 s,造影剂推注速度为1.5 ml/s 的条件下显示到SPV 属支的例数为5 例(图2E)。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后40 s,造影剂推注速度为2.0 ml/s 的条件下显示到SPV 属支的例数为2 例(图2E)。在造影剂的浓度为0.2 ml/kg,造影按键时间为推注造影剂后30 s,造影剂推注速度为2.5 ml/s 的条件下显示到SPV 属支的例数为1 例(图2E)。在造影剂的浓度为0.3 ml/kg,造影按键时间为推注造影剂后30 s,造影剂推注速度为1.5 ml/s的条件下显示到SPV 属支的例数为3 例(图2F)。在造影剂的浓度为0.3 ml/kg,造影按键时间为推注造影剂后40 s,造影剂推注速度为1.5 ml/s 的条件下显示到SPV 属支的例数为2 例(图2F)。在造影剂的浓度为0.3 ml/kg,造影按键时间为推注造影剂后30 s,造影剂推注速度为2.5 ml/s 的条件下显示到SPV 属支的例数为2 例(图2F)。
3.2 单模态重建及多模态融合
把同一病例的头颅CT 和头部CE-MRA 的DICOM 数据同时导入3D slicer 软件。对头颅CT 新的volume 进行阈值分割,并且进行3D show。可见头颅CT 的二维视图(图3A)和骨性结构的三维视图(图3B),明显可见乙状窦沟、岩上窦沟、横窦沟、内耳道、枕骨大孔等骨性解剖结构。

图3 头部影像多模态融合过程中的二维影像视图与三维重建图像配准后的头颅CT、CE-MRA 分别经过阈值分割后的二维影像轴位图(A、C);经过结构修剪、多模态融合处理后的二维影像轴位图(F);3D 显示颅底(B);3D 显示左侧SPS、SPV 和SPV 属支以及毗邻血管的外面观、内面观(D、E);颅底和SPVC 的3D 融合图(G、H)Fig.3 Two-dimensional image view and three-dimensional reconstructed image in the process of multimodal fusion of head imagesAxial bitmap of head CT and CE-MRA after respectively registration and threshold segmentation (A and C);After multi-mode fusion and processing of two -dimensional image axis bitmap (F);The skull base was shown in 3D (B);The external view and internal view of SPS,SPV,SPV branch and adjacent blood vessels were shown in 3D (D,E);3D fusion image of skull base and SPVC (G,H)
把同一个人的头部CT 和CE-MRA 的DICOM 数据同时导入3D slicer 软件并进行刚性配准。头颅CT生成新的volume,与头部CE-MRA 的二维图像完全重合在一起,对头部MRA 进行阈值分割后进行3D show。可得到头部MRA 的二维视图(图3C)和血管结构的三维视图(图3D、3E)。
把第一步的颅骨和第二步的头部血管三维数据同时导入3D slicer 软件,可以得到头颅CT 和头部CEMRA 同时存在的多模态融合数据。在二维视窗(图3F)中,矢状位、冠状位、轴位三个方位面上颅骨和血管的阈值分割图融合在一起后得到轴位图,在三维视窗(图3G、图3H)中,得到颅底和目标血管融合在一起的结果。
3.3 SPV 形态学的部分相关解剖学测量展示
运行3Dslicer 软件进行中心线的提取,用Markups 模块将单模态和多模态重建得到的脑部血管结构、颅底和脑部血管融合结构进行测量(图4)。
图4 SPV 的相关解剖学参数的测量A: SPV 的测量图示B: SPV 汇入SPS 的位置测量图示C: SPV 汇入SPS 的位置与内耳道的距离测量图示Fig.4 Measurement of related anatomical parameters of SPVA:the measurement diagram of the SPV; B:the position measurement diagram of SPV imported into SPS; C:The measurement of distance between the location of SPV into SPS and internal auditory meatus
3 讨论
SPV 可以引流脑干的前、外侧表面,岩面,小脑幕侧面的一部分以及枕下表面[9]。SPV 通常由1-3 条桥接静脉组成,这些静脉汇入SPS。每条SPV 通常是由桥小脑角(CPA)上部的多条属支汇合而成。它们最常见的属支是脑桥三叉静脉和桥脑横静脉,以及桥脑小脑裂静脉和小脑中静脉[2]。SPS 是小脑幕附着在岩骨嵴形成的静脉窦,一般其内侧连接海绵窦的后部,外侧连接横窦和乙状窦结合处[10]。SPV 是桥小脑角手术中最常遇到的路障静脉[1]。在神经外科的手术入路和手术过程中,由于分离SPV、牵拉脑实质和扩大手术操作空间等而电凝、结扎或切除SPV,使SPV出现不同程度的损伤,引起术中出血、脑水肿和静脉回流受阻等不同程度的手术后并发症。关于术中闭塞SPV 后出现并发症的病例报道并不少见[11,12,13,14]。随着桥小脑角区手术的普遍开展,需认识到在该区域进行手术时保护SPV 的重要性[15]。由于SPVC 在个体之间有较大的差异性[5],手术中处理这些静脉的策略可能会影响手术效果[19]。
现已有多种方式用于脑血管的解剖研究,包括传统的基于标本的大体解剖研究与血管铸型技术及在体研究如术中观察、及基于医学影像技术的DSA,计算机断层扫描血管成像技术(computed tomography angiography,CTA),MRA,磁敏感加权成 像(susceptibility weighted imaging,SWI)与数字化三维重建技术。国内外文献报道,很多研究学者利用大体标本对SPV 进行解剖学的研究[1,5,16]。但是因为SPV 的变异很多[5],大体标本的数量有限,代表性欠佳。Matsushima 等[9]利用Advantage Workstation Volume Share 进行SPA 的研究,相对于3Dslicer 来说,不够简便,也不能大范围地开展。Rhoton A 等[2]利用了DSA结合大体解剖进行SPA 的研究,虽然DSA 对较小的血管分支结构显影良好,但是影像模态单一且是有创操作,同时费用昂贵,不易大样本采集对比分析。Xiong 等[17]利用Mimics 软件对MRI 图像进行三叉神经、SPV、侵犯血管和脑干进行分割,各组织结构的区分显影不明显,精细度欠佳。
多模态影像融合技术将同一研究对象的不同影像信息经过空间配准和叠加后合成一幅图像,克服了单一影像模式的局限性,可获得更为准确、全面的细节描述,达到综合利用、优势互补的目的[18]。目前已有较多文献报道将CT、MRI 图像融合应用于垂体肿瘤及颅底肿瘤等手术中[19,20,21]。对于影像手段的选择,也影响着显影的效果。比如平扫CT 可以对颅骨进行清晰显影,MR 的T1WI 可以对颅脑解剖结构清晰显影,CTA、MRA、CEMRA、增强MRI、SWI 等可以对脑血管显影。CTA 看颅底血管会出现一定程度的伪影,影响血管的观察,且CT 对软组织分辨率较差,而且CTA 对于造影剂的浓度要求较高,一般为1.0~2.0 ml/kg,而CEMRA 使用造影剂的浓度一般为0.1~0.3 ml/kg,加上CT 较MR 的辐射大得多,相对来说CEMRA 对人体的副作用小得多。CTA、MRA 和增强MRI 均对大脑管径较大的静脉主干显示良好,无法客观显示管径较小的静脉。有研究指出[22],SWI 对深髓静脉清晰显影,其直径较为统一,范围在0.2~0.3 mm。SPV 最大的支流是小脑桥脑裂静脉,平均直径为2.1 mm[23],进而SPV 的属支半径会更小。理论上SWI 可以对SPVC 完全清晰显影,研究中也曾利用头部SWI通过三维重建,但并不能成功清晰地重建头部的血管模型。MRA、SWI 都是在平扫扫描,MRA 主要应用血流速率进行成像,SWI 主要应用磁敏感技术成像,两者有时不能很好客观显示颅脑血管。而CEMRA 是使用造影剂缩短T1 的原理,对颅脑血管显示更客观、清晰。
有研究[7]通过调节核磁共振机的参数,进行SPVC 的显影,根据文献中的参数,重点对造影剂浓度、造影剂推注速度、开始扫描时间这三个参数进行调试,根据图像处理工作站MIP 后处理软件的辅助判断后,得到的结果可以看出,目标结构的显影对开始扫描时间相对较敏感,造影剂浓度、造影剂推注速度也都对显影效果有一定影响,本实验中在开始扫描时间为30 s 时对SPV 属支的成功显影例数最多,造影剂推注速率为1.5 ml/s 得到的SPV 属支也较多,理论上来说,造影剂浓度越大显影效果越好,但实验例数相对有限,实验结果没有很好体现出这种现象。本实验注重的是客观性,所以只有图像处理工作站MIP 后处理软件重建出的三维影像可以很好观察到SPV 属支的样本才被选取进行后续处理。实验中选取了成像效果相对较稳定的一组参数,把基于头部CEMRA 和CT 的DICOM 数据导入3Dslicer 多模态融合制作出SPS 和SPV 及其部分属支与头颅骨骼的融合模型。然后用3Dslicer 软件Vascular modeling toolkit 模块中的Extract Centerline 和Markups 模块对SPV 的长度和SPV 在SPS 上的汇入点的测量,并用Markups 模块对SPV 在SPS 上的汇入点与内耳道的距离进行测量,结果明显易见且更为精确,为SPV 的解剖形态学研究和临床解剖研究提供了新的思路和方法。
本研究旨在为SPV 的解剖学研究提出一种新的技术和理念,结果中可以看到清晰的SPS 和SPV,SPV 的属支已可以部分显影,通过参数的继续调整将来会继续提高SPVC 的显影精度和显影稳定性。继而依据解剖学数据来得到更加科学的分类、分型,临床上可以根据多模态融合得到的模型个体化定制患者的手术方案。在今后的研究中会用类似的方法继续加入其它组织比如脑组织、神经纤维进行融合形态学分析。但这种三维建模的融合模型测量得到的数据与大体标本以及手术中遇到的实际情况有多大误差,也是本研究需要斟酌的地方,后续的研究中会加大数据量,通过具体数据的测量加以统计对比,论证本方法的实用性和误差率。