基于FAERS数据库的甲磺酸达拉非尼联合曲美替尼致药品不良事件信号挖掘Δ
2023-06-06石亚飞李艳慧薄明明张铭予孙伟銮李国辉戴媛媛
石亚飞,李艳慧,陈 伟,薄明明,张铭予,孙伟銮,衡 愉,李国辉#,戴媛媛,#
(1.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院药剂科,北京 100021;2.国家癌症中心/国家肿瘤临床医学研究中心/河北中国医学科学院肿瘤医院药剂科,河北 廊坊 065001;3.国家癌症中心/国家肿瘤临床医学研究中心/河北中国医学科学院肿瘤医院护理部,河北 廊坊 065001)
随着分子生物学研究的不断发展,人们对肿瘤发生的分子机制和生物学特性的了解进一步深入。研究结果显示,丝裂原活化蛋白激酶(MAPK)信号通路与肿瘤发生密切相关[1]。其中鼠类肉瘤滤过性毒菌致癌同源体B1(BRAF)基因突变是引起MAPK信号通路系列活化导致肿瘤发生的重要突变类型,BRAF基因突变常见于黑色素瘤、甲状腺癌和结直肠癌等,其中黑色素瘤患者发生比例最高[2]。BRAF基因突变通常对BRAF抑制剂和丝裂原活化的细胞外信号调节激酶(MEK)抑制剂敏感,目前临床对该类型突变的靶向治疗药物以BRAF抑制剂和MEK抑制剂组合为主,目前该组合治疗在我国获批上市的为甲磺酸达拉非尼联合曲美替尼,其批准适应证为BRAF V600突变阳性不可切除或转移性黑色素瘤和BRAF V600突变阳性转移性非小细胞肺癌,其中甲磺酸达拉非尼是一种强效和选择性BRAF激酶活性抑制剂,曲美替尼是一种可逆的、高选择性MEK1和MEK2激酶活性的变构抑制剂[3-4]。目前,甲磺酸达拉非尼与曲美替尼联合用于其他肿瘤的研究日渐增多,其临床应用亦随之增多,但由于上市时间较短,目前该联合用药方案的安全性研究报告较少。因此,有必要密切关注其有关的药品不良事件。目前,药品说明书中列举的上述2药联合应用的不良事件仅为临床研究中报告的不良事件,其在真实世界中的不良事件发生情况仍需进一步研究。不良事件报告系统是药品不良事件真实世界研究的重要数据来源之一[5]。其中美国食品药品监督管理局不良事件报告系统(FDA adverse event reporting system,FAERS)由于数据量大、更新速度快等优点而备受关注[6]。本研究旨在通过挖掘FAERS数据库中的不良事件信息,分析甲磺酸达拉非尼与曲美替尼联合应用的不良事件信号,对其真实世界应用的安全性进行评价,以期为临床安全使用该联合用药方案提供参考。
1 资料与方法
1.1 数据来源
本研究数据来自FAERS数据库。FAERS数据库收集了来自美国和其他国家报告的怀疑药品的不良事件数据,该数据包含该不良事件发生涉及的药品使用适应证、患者基本信息、不良事件、不良事件发生时间、持续时间及转归等信息,该数据库每季度更新1次[6]。本研究选取数据截至2022年第2季度。
1.2 数据提取
本研究利用OpenVigil2.1-MedDRA平台收集数据。OpenVigil2.1-MedDRA是一个整合了MedDRA术语集(MedDRA-24.0),同时可开放获取经数据清洗后FAERS数据的一种数据挖掘平台。本研究利用该平台检索自美国食品药品监督管理局上市后甲磺酸达拉非尼与曲美替尼联合应用数据,收集联合用药的不良事件数据,内容包括不良事件名称、患者基本信息、上报国家和日期等信息。根据《国际医学用语词典》(MedDRA-24.0)中的首选术语进行编码,以系统器官分类(SOC)对不良事件进行分类、描述[7]。
1.3 信号挖掘与分析
本研究综合采用比例失衡分析法中的频数法和贝叶斯法进行信号挖掘,频数法主要包括比例报告比值法(PRR)和报告比值法(ROR),贝叶斯法主要包括贝叶斯置信度递进神经网络法(BCPNN)和多项经验贝叶斯伽马泊松分布缩减法(MGPS),上述2类方法的计算都可基于四格表数据,见表1。上述2类方法判断阳性信号阈值见表2[8-9]。为减少假阳性信号产生,本研究以同时满足上述标准,且不良事件发生频数≥3例,即判定不良事件与药物有统计学关联。

表1 不良事件信号挖掘四格表数据Tab 1 Fourfold table for adverse event signals mining

表2 不良事件阳性信号阈值Tab 2 Positive signal threshold for adverse events
1.4 统计学方法
计数资料采用病例数和构成比描述。采用Excel软件和R语言对获取数据进行描述性分析和关联性分析。其中,比例失衡算法主要通过OpenVigil2.1-MedDRA平台导出的频数统计数据结合R语言“PhVid”软件包完成[10]。
2 结果
2.1 不良事件报告基本情况
共检索到甲磺酸达拉非尼联合曲美替尼的不良事件报告9 712份,涉及男性患者4 555例(占46.90%),女性患者3 921例(占40.37%);18~<65岁患者(占25.77%)居多;上报数据主要源于美国(占44.14%);严重不良事件主要包括死亡(占21.62%)和导致住院和住院时间延长(占19.45%),见表3。

表3 甲磺酸达拉非尼联合曲美替尼的不良事件报告基本情况Tab 3 Basic information for adverse event reports of dabrafenib mesylate combined with trametinib
2.2 信号识别
PRR法识别信号618个,ROR法识别信号1 086个,BCPNN法识别信号391个,MGPS法识别信号384个,二次筛选后得到重叠信号309个,见图1。
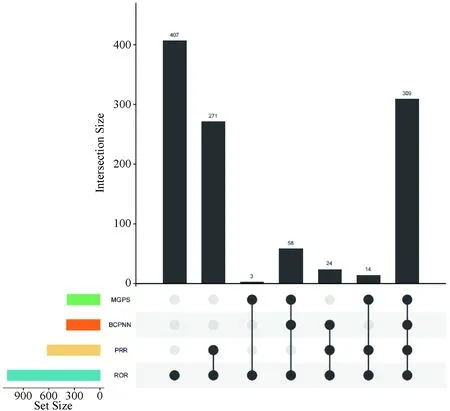
图1 甲磺酸达拉非尼联合曲美替尼的不良事件信号检测Upset图Fig 1 Upset diagram of adverse events signal detection of dabrafenib mesylate combined with trametinib
2.3 发生频数排序居前50位的不良事件
报告发生频次较多的不良事件主要为发热、死亡、恶性肿瘤进展、寒颤、疲劳、皮疹、呕吐、虚弱、食欲减退、转移至中枢神经系统、视力损伤、脱水、视力模糊、血肌酸磷酸激酶升高和吞咽困难等,见表4。

表4 发生频数排序居前50位的不良事件Tab 4 Top 50 frequency of adverse events
2.4 新发不良事件
发现药品说明书中未记载的不良事件20个,其中发生频数较高的有吞咽困难和惊厥,信号强度较高的有脂膜炎、小叶性脂膜炎和降钙素原升高,见表5。

表5 新的不良事件信号Tab 5 New adverse events signal
3 讨论
3.1 本研究主要发现
本研究获得的甲磺酸达拉非尼联合曲美替尼的不良事件信号基本涵盖药品说明书中不良事件内容,进一步说明本研究具有一定的可靠性,其中发热、死亡等不良事件报告频次和信号强度较高,提示临床应引起重视。药品说明书中的药品不良事件主要基于临床究结果,由于其纳入患者种类和数量限制,一些迟发或罕见的不良事件可能无法及时发现,上市后基于自发报告的数据监测研究可为药品安全性研究提供更多信息[11]。
3.2 重要不良事件提示
本研究中,报告较多的甲磺酸达拉非尼联合曲美替尼的不良事件为恶性肿瘤进展,可能与甲磺酸达拉非尼通过突变或其他机制激活大鼠肉瘤病毒癌基因同源物(RAS)有关,随机对照试验研究结果显示,上述2药联合应用可通过MEK抑制剂抑制RAS通路激活,从而延缓疾病进展[12-13]。另一方面,考虑恶性肿瘤发生与发展特性,尽管该类不良事件发生频数和信号强度均较高,但可能并非药物治疗引起的。
发热类不良事件也是报告数和信号强度均较高的不良事件,本次挖掘发现报告的发热类不良事件主要包括发热、体温升高等,严重者甚至可能发生严重的发热反应和任何严重程度的发热,并伴有低血压、发冷或寒颤、脱水或肾衰竭。随机对照试验研究结果显示,发热类不良事件与羟基达拉非尼暴露相关,甲磺酸达拉非尼联合曲美替尼可降低发热类不良事件发生率,其相关机制和危险因素尚未明确[14-15]。有研究结果显示,在治疗的第1周,与没有发热的患者相比,发热患者的血浆中白细胞介素6和白细胞介素1β浓度更高[16]。Schaefer等[17]的研究结果显示,甲磺酸达拉非尼联合曲美替尼导致发热与患者血液C反应蛋白、乳酸脱氢酶、白细胞计数和血小板计数等指标水平显著相关,并由此开发了发热评分算法,用于预判联合应用甲磺酸达拉非尼与曲美替尼的患者发热的发生风险。需要指出的是,一旦发生发热,应及时干预,以免引起脱水、低血压等一系列其他症状,从而影响治疗的依从性,加剧病情恶化趋势[18]。目前已有学者制定了甲磺酸达拉非尼与曲美替尼联合应用导致发热的处理流程,临床可根据患者状态采取中断治疗,减少药物剂量,预防给予退热药、给予皮质醇类药物和永久停药等干预措施[19]。
本研究获取报告数量较多的皮肤不良事件主要为皮疹和皮肤干燥。Torres-Navarro等[20]对BRAF/MEK抑制剂诱导严重皮肤不良反应的系统评价结果显示,该类药物的严重皮肤反应如史-约综合征、中毒性表皮坏死松解症、药疹伴嗜酸性粒细胞增多及系统症状、急性泛发性发疹性脓疱病等多见于维莫非尼,甲磺酸达拉非尼与曲美替尼联合应用方案未发现严重皮肤不良事件。提示甲磺酸达拉非尼与曲美替尼联合应用,在提高治疗效果的同时,可减少皮肤不良事件发生。皮肤不良事件一般可采取在发生部位使用保湿剂、糖皮质激素类软膏等措施予以处理。
眼部毒性也是甲磺酸达拉非尼与曲美替尼联合应用较为常见的不良事件类型,本次数据挖掘发现眼部毒性主要有视物模糊、光视症、色觉异常、葡萄膜炎和视网膜脱离等症状。研究结果显示,眼部毒性多数由曲美替尼导致,眼部毒性一般发生于用药后数小时至数周[21]。由于部分眼部毒性症状不明显,需要通过眼科检查发现,因此,应告知患者适时进行眼科检查,以免延误干预时机。
研究结果显示,甲磺酸达拉非尼联合曲美替尼使用时,其心血管不良事件发生情况可能增加[22]。甲磺酸达拉非尼与曲美替尼联合应用的主要心血管不良事件包括高血压、左心室收缩功能不全、心力衰竭、静脉血栓栓塞、心房颤动和心电图QT间期延长等,本研究收集的心血管毒性信号主要有心室功能障碍、心电图QT间期延长和射血分数降低。导致心血管毒性的机制可能与药物靶向通路与正常心脏和血管生理所需的稳态通路重叠相关[23-24]。因此,建议采用甲磺酸达拉非尼联合曲美替尼治疗患者时,在治疗起始、治疗阶段及随访阶段充分评估患者的心血管状况,从而有效减少心血管事件发生,优化治疗效果。
3.3 新发不良事件提示
本研究发现甲磺酸达拉非尼联合曲美替尼所致新的不良事件信号主要有吞咽困难、惊厥和脂膜炎等,不良事件涉及系统和器官分类与药品说明书中的报道一致,其严重程度与类型略有不同,如惊厥可能与严重发热反应相关。另外,还有弥散性血管内凝血、气管食管瘘等严重药品不良事件。提醒临床应引起足够重视,密切关注治疗情况。
3.4 本研究的局限性
本研究的主要局限性:(1)FAERS数据库为自发呈报系统,存在低报、漏报等现象,且数据库未记载药物使用人群总数,所得数据仅能计算药物与不良事件的关联情况,无法计算药品不良事件发生率数据。(2)FAERS数据库主要报告对象为欧美人群,且应用该2种药物治疗的恶性肿瘤类型不仅限于黑色素瘤和非小细胞肺癌,挖掘所得数据结论可能不适用于我国患者,研究结论尚需更多我国患者参与的相关临床研究证实。(3)比例失衡算法仅能反映药物与不良事件之间的关联强度,其确切因果关系尚需进一步临床研究证实。
综上所述,本研究通过OpenVigil2.1-MedDRA平台,对FAERS数据库中上报的甲磺酸达拉非尼联合曲美替尼的不良事件报告数据进行挖掘分析,结果提示,临床应对甲磺酸达拉非尼联合曲美替尼引起的发热、皮肤毒性、眼部毒性和心血管毒性等发生频数和信号强度高的不良事件予以重点关注。在应用甲磺酸达拉非尼联合曲美替尼治疗前、治疗中及随访阶段均应做好相关监测工作,如发现不良事件发生,应及时干预,保障患者用药安全。
