早发型与晚发型新生儿败血症的临床特征分析*
2023-06-06姚沈佳张晓群李海英仲秀丽周妮娜陈帅伶侍咪咪
姚沈佳,张晓群,李海英,仲秀丽,周妮娜,陈帅伶,侍咪咪
(南通大学附属医院儿科,江苏 226001)
新生儿败血症(neonatal sepsis,NS)是指病原体在新生儿的血液中生长、繁殖并且释放毒素导致血流动力学改变和其他全身症状的临床综合征,发病率4.5‰~9.7‰,病死率11%~19%[1]。按照发病时间可分为早发型败血症(early-onset sepsis,EOS)(发病时间≤3 日龄)和晚发型败血症(late-onset sepsis,LOS)(发病时间>3 日龄)[2]。由于新生儿败血症缺乏特异性临床表现,辅助检查的敏感度、特异度有限,以及不同地区病原菌种类存在差异,给诊治带来很多困难。本文回顾性分析我院新生儿病房2018 年1月—2021 年12 月收治的NS 患儿140 例临床资料,对其临床特征进行分析,为早期识别和治疗NS 提供依据。
1 资料与方法
1.1 一般资料 新生儿败血症患儿140 例,按照发病时间分为EOS 组60 例和LOS 组80 例。纳入标准:(1)符合NS 诊断标准[3];(2)临床资料完整。排除标准:(1)单份血培养阳性,但无败血症临床表现,多次实验室非特异性检查均为阴性,考虑为污染病例;(2)合并先天性畸形、自身免疫系统疾病。
1.2 研究方法 从医院系统收集新生儿信息,包括:(1)新生儿一般资料:性别、发病日龄、出生胎龄、出生体质量、分娩方式等;(2)围产期及住院诊疗情况:有无胎膜早破≥18 h、有无羊水污染、有无妊娠期糖尿病、有无妊娠期高血压、发病前静脉营养、发病前机械通气、发病前中心静脉置管;(3)临床表现:发热、体温不升及体温低、惊厥、反应差、黄疸、腹胀呕吐、呼吸困难、皮肤发花等;(4)实验室检验:血常规、炎性指标(CRP、PCT)、血糖、血液培养;(5)合并症:细菌性脑膜炎、感染性肺炎、新生儿坏死性小肠结肠炎;(6)转归及住院天数:治愈、好转、死亡、住院天数。
1.3 统计学处理 应用SPSS 24.0 统计学软件进行数据分析。计数资料以频数或率表示,组间差异性比较采用χ2检验或Fisher 确切概率法。偏态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 EOS 组出生体质量<1 500 g占比15.0%,低于LOS 组的28.8%,差异有统计学意义(P<0.05)。两组性别、剖宫产、出生胎龄、多胎情况比较,差异均无统计学意义(P>0.05)。见表1。
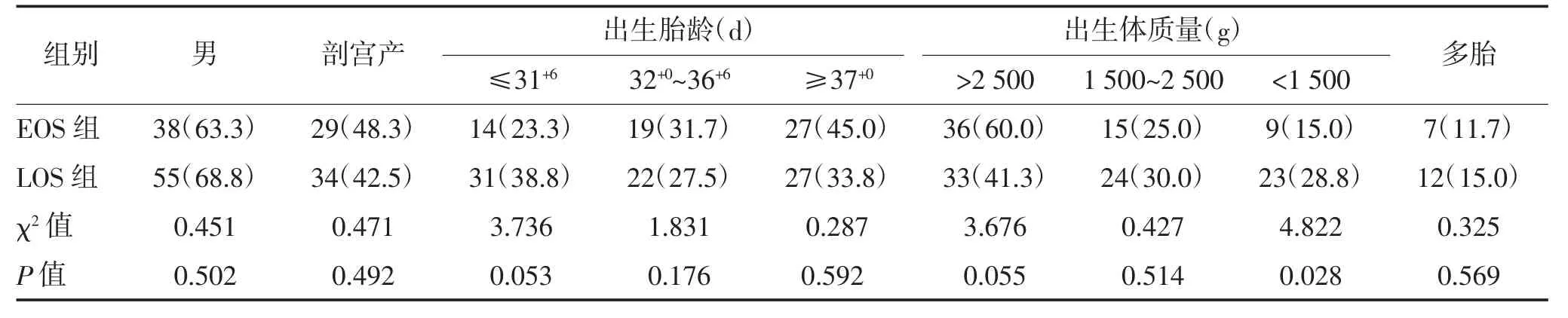
表1 两组一般资料比较 n(%)
2.2 两组围产期及诊疗情况比较 EOS 组羊水污染占比28.3%,高于LOS 组的7.5%,LOS 组发病前静脉营养占比31.3%,高于EOS 组的16.7%,差异均有统计学意义(P<0.05)。两组胎膜早破≥18 h、妊娠期糖尿病、妊娠期高血压、发病前机械通气、发病前中心静脉置管比较,差异均无统计学意义(P>0.05)。见表2。
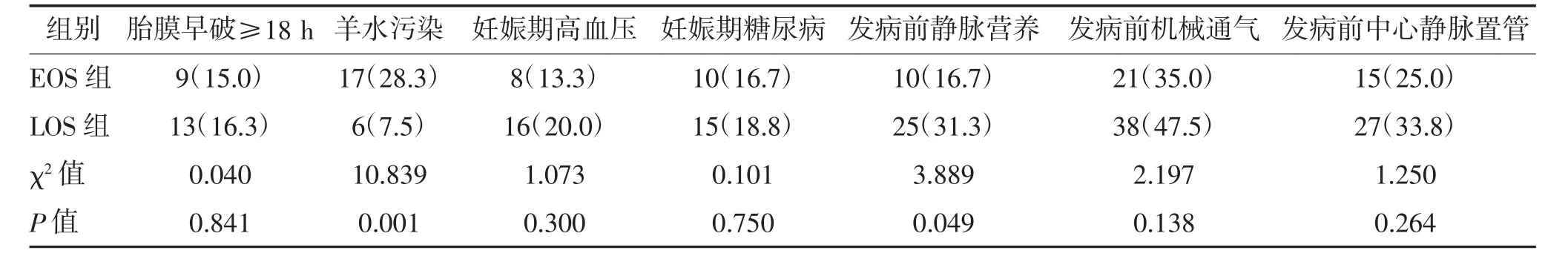
表2 两组围产期及诊疗情况比较 n(%)
2.3 两组临床症状比较 新生儿败血症患儿140例中呼吸困难54 例(38.6%)、体温不升或低体温49例(35.0%)、黄疸45 例(32.1%),是NS 常见临床表现。LOS 组发热占比22.5%高于EOS 组的5.0%,差异有统计学意义(P<0.05)。见表3。
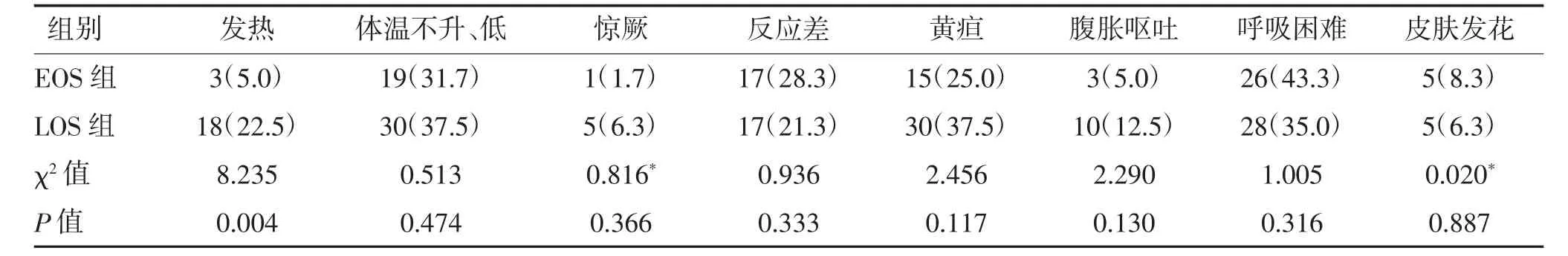
表3 两组临床症状比较 n(%)
2.4 两组实验室指标比较 EOS 组CRP 升高占比76.7%,高于LOS 组的55.0%,差异有统计学意义(P<0.05)。见表4。
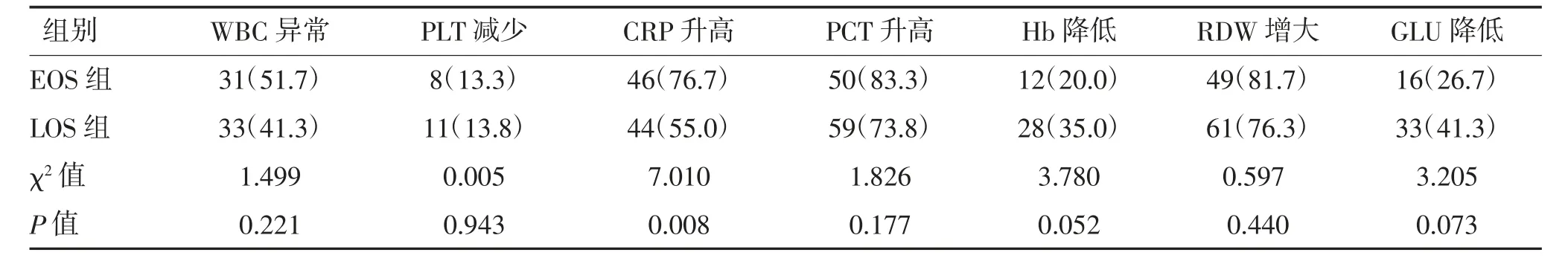
表4 两组实验室指标比较 n(%)
2.5 两组病原菌分布比较 新生儿败血症患儿140例血培养共分离出19 株病原菌,主要病原菌为革兰阳性菌17 例(89.5%),其中凝血酶阴性葡萄球菌8例(47.1%)。两组病原菌比较,差异均无统计学意义(P>0.05)。见表5。
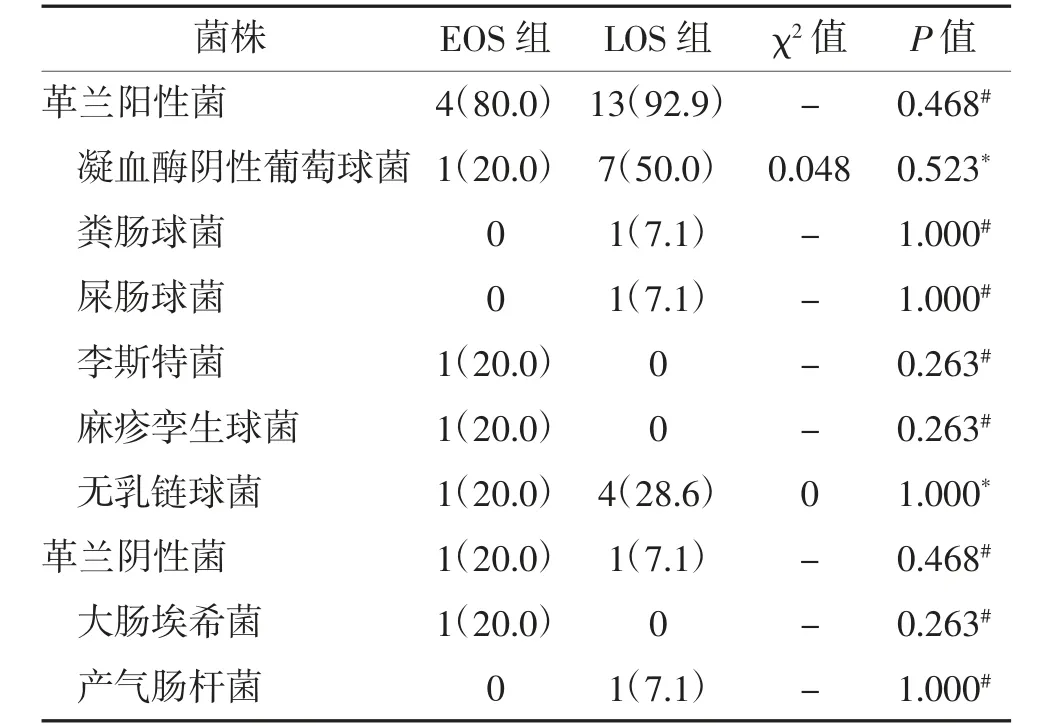
表5 两组病原菌分布比较 n(%)
2.6 两组合并症、治疗及转归比较 EOS 组合并肺炎38 例(63.3%),细菌性脑膜炎5 例(8.3%),坏死性小肠结肠炎1 例(1.7%);LOS 组合并肺炎48 例(60.0%),细菌性脑膜炎3 例(3.4%),坏死性小肠结肠炎5 例(6.3%)。两组合并症比较差异均无统计学意义(P>0.05)。140 例NS 患儿死亡10 例(7.1%),其中EOS 组死亡6 例(10.0%),LOS 组死亡4 例(5.0%),两组病死率差异无统计学意义(P>0.05)。EOS 组住院天数11(6,22.75)天,LOS 组为21(11,44)天,LOS 组住院天数更长,差异有统计学意义(P<0.05)。
3 讨论
NS 发病率及死亡率较高。全球约2%活产婴儿在出生后28 天内发生败血症,可归因于败血症死亡率为11%~19%[1]。NS 与婴幼儿神经发育结局相关,SAVIOLI 等[4]随访发现,在神经发育迟缓的不同亚型中,普遍发育障碍(PDD)、学习迟缓和发育迟缓(NOS)与脓毒症和疑似脓毒症相关性最强。ALSHAIKH 等[5]荟萃分析发现,极低出生体重婴儿脓毒症与更差的神经发育结局有关,包括脑瘫的发病率较高。而CAI 等[6]荟萃分析表明,与没有败血症的婴儿相比,患有NS 的极早产儿有更高的神经损伤风险,如脑瘫和神经感觉缺陷。
有研究报告EOS 组早产儿、低出生体重儿发生率低于LOS 组[7]。本研究中EOS 组出生体质量<1 500 g占比15.0%,低于LOS 组的28.8%,差异有统计学意义(P<0.05);EOS 组早产儿占比低于LOS 组,但差异无统计学意义(P>0.05)。近年来我国围产保健及新生儿救治水平不断提高,早产儿、低出生体重儿及极低出生体重儿的存活率明显上升,这些患儿住院时间较长,住院期间进行静脉营养等各种侵入性操作较多,加之本身免疫力差,较足月儿更易感染。本研究中EOS 组发病前静脉营养占比16.7%,低于LOS组的31.3%,差异有统计学意义(P<0.05),可能与LOS 组低出生体重儿的比例更高有关。本研究中EOS 组羊水污染的占比28.3%,高于LOS 组的7.5%,差异有统计学意义(P<0.05),与朱晶文等[8]研究基本符合。EOS 多为宫内或分娩时感染,患儿易吸入或吞入污染的羊水,导致败血症的发生。
国外有研究提示LOS 组CRP 升高较EOS 组更常见[9]。本研究中EOS 组CRP 升高占比76.7%,高于LOS 组的55.0%,差异有统计学意义(P<0.05)。CRP易受胎膜早破、母亲发热、胎儿窘迫、难产和围产期窒息等因素影响而升高[10]。LOS 组CRP 升高比例较低可能与采血时间以及个体差异如免疫系统功能低下导致免疫应答延迟、肝功能不成熟有关[11]。有研究显示,EOS 组更容易出现血小板计数下降[12],而本研究两组血小板计数下降患者比例比较,差异无统计学意义(P>0.05),可能与样本量较少有关。
NS 诊断金标准为无菌腔液或血培养检出病原菌,临床上细菌培养至少需要3 天时间,且容易出现假阳性或假阴性。本研究血培养阳性率低,检出病原菌以革兰阳性菌为主,其中凝血酶阴性葡萄球菌最多,由于分离出的菌株少,两组病原菌差异均无统计学意义(P>0.05)。有报道显示在新生儿重症监护室凝血酶阴性葡萄球菌是LOS 中最常见的病原体[13],这可能与患儿自身免疫系统不成熟及侵入性操作有关,因此需注意减少侵入性操作的次数及时间。
一项亚洲新生儿感染研究显示,NS 总病死率14.5%,EOS 病死率7.0%,LOS 病死率16.0%[14]。本文140 例患儿总病死率7.1%,EOS 病死率10.0%,LOS病死率5.0%。总病死率低于上述研究,可能与我院NS 多为临床诊断及早期应用抗生素相关。EOS 病死率10.0%,高于上述报道,死亡的6 例均为早产儿,其中5 例胎龄≤32 周,且体质量<1 500 g,因为患儿胎龄小、出生体质量较低,早期症状隐匿不易识别,病情进展迅速而易发生死亡。有研究提示胎龄、发病时体质量、凝血功能、感染性休克、多脏器损害及外周血白细胞计数与NS 死亡显著相关[15]。临床上应不断提高早期识别新生儿危重症的能力,尤其是早产儿及低体质量儿,尽早处理各种危重状态,避免不良结局。
综上所述,EOS 与LOS 患儿各有不同高危因素,临床诊疗中需认真关注母亲围产期高危因素,对羊水污染的新生儿需警惕EOS 的发生,对出生体质量<1 500g、使用静脉营养的新生儿应尽量减少侵入性操作,警惕LOS 的发生。
