LUCAT1 在胃癌组织中的表达及对胃癌细胞增殖侵袭的影响*
2023-06-06孙永新
孙永新,韦 笑,曹 维
(南通大学附属医院消化内科,江苏 226001)
胃癌是全球最常见的恶性肿瘤之一,在癌症相关死亡中位居第四[1]。2016 年我国新诊断癌症4 064 000例,其中胃癌396 500 例,占9.8%,位居第三[2]。由于胃癌早期缺乏典型临床表现,多数患者确诊时已是晚期,预后较差。因此,发现有效的生物学标记对胃癌的早期诊断和治疗具有重要意义。
长链非编码RNA(long non-coding RNA,lncRNA)是指长度超过200 个碱基对而无蛋白编码功能的RNA,在人类细胞中广泛表达,在多种生理病理过程中发挥重要作用。肺癌相关转录本1(LUCAT1)作为一种LncRNA,在多种肿瘤组织中异常表达,且与肿瘤细胞的增殖和侵袭关系密切。本研究选取我院2015—2020 年手术切除的胃癌组织及配对癌旁正常组织18 例以及人胃癌细胞株,检测LUCAT1 的表达,探讨LUCAT1 对胃癌细胞增殖和侵袭的影响,旨在进一步揭示胃癌发生发展的分子机制,为寻找胃癌治疗靶点提供线索。
1 资料与方法
1.1 一般资料 术后经病理证实的胃癌患者18例,其中男性10 例,女性8 例,年龄38~85 岁,平均56±5 岁。手术切取的胃癌组织及其配对癌旁正常组织标本置于液氮中保存待检。所有患者术前均未接受放疗、化疗及肿瘤辅助治疗。本研究经医院伦理委员会批准,所有患者签署知情同意书。
1.2 方法
1.2.1 RT-qPCR 检测胃癌及癌旁组织中LUCAT1表达:TRIzol 法提取组织样本总RNA,采用Thermo Fisher 公司SuperScriptTMIV First-Strand Synthesis System 合成cDNA 第一链。使用Primer 5.0 软件设计PCR 引物,由上海Invitrogen 公司合成。引物序列:LUCAT1 F:5’-GTGTCAAGCTCGGATTGCCT-3’,R:5’-GAGCCCACACACTCAGGTTC-3’;GAPDH F:5’-AATGGGCAGCCGTTAGGAAA-3’;R:5’-AATGGGCAGCCGTTAGGAAA-3’。以GAPDH 为内参,采用2-ΔΔCt计算LUCAT1 相对表达水平。采用Power SYBRTMGreen PCR Master Mix 试剂盒,Light Cycler 96 PCR 仪检测LUCAT1 表达。PCR 扩增体系:SYBR Premix12.5 μL,Prime F 和R(10 μmol/L)各1 μL,cDNA 2 份,每份2 μL,ddH2O 8.5 μL。反应条件:预变性95 ℃30 s,PCR 反应95 ℃5 s,60 ℃30 s,共40 个循环。
1.2.2 细胞培养:将4 种人胃癌细胞株(BGC-823,AGS,SGC7901,MKN45)培养于含10%FBS 的RPMI-1640 培养液中,置于5%CO2、37 ℃培养箱培养,当细胞融合度达到70%~80%时进行传代。采用TRIzol 法提取细胞总RNA,参照1.2.1 中RT-qPCR实验步骤检测不同胃癌细胞株中LUCAT1 的表达,选择LUCAT1 高表达的SGC7901 细胞株进行后续实验。
1.2.3 RT-qPCR 法检测各组SGC7901 细胞LUCAT1表达:将SGC7901 细胞分为si-NC 组、si-LUCAT1组、pLV-NC 和pLV-LUCAT1 组,根据LipofectamineTM3000 转染试剂说明书,分别转染阴性对照siRNA、LUCAT1、siRNA 空载体质粒及过表达质粒pLV-LUCAT1,转染后在37 ℃、5%CO2培养箱中继续培养48 h。利用RT-qPCR 检测各组细胞LUCAT1的表达水平以验证转染效果。LUCAT1 引物序列:上游:5’-CUCAGUGUCACACAUUUCATT-3’,下游:5’-UGAAAUGUGUGACACUGAGTT-3’。
1.2.4 MTT 法检测细胞增殖:吸取各组SGC7901 细胞悬液100 μL(含2 000 个细胞),置于96 孔板中培养72 h,每孔加入100 μL MTT 溶液(5 mg/mL),在细胞培养箱内继续孵育4 h。每孔加入100 μL Formanzan 溶解液,继续孵育直至显微镜观察发现Formazan 全部溶解。使用酶联免疫检测仪,选择570 nm波长测定吸光度,绘制细胞活性曲线,实验设3复孔。
1.2.5 Transwell 细胞迁移实验:采用无血清RPMI-1640 培养基按1:8 比例稀释基质胶,包被在Transwell 小室底部膜的上室面,37 ℃放置2 h 使基质胶充分包被。取各组SGC7901 细胞悬液撤血清饥饿12~24 h,以进一步去除血清影响。消化后用无血清培养基重悬细胞,调整细胞浓度为1×106/mL。用温暖的无血清培养基轻洗形成胶状的基质胶,取100 μL细胞悬液加入上室,600 μL 含20%FBS 培养基加入下室,置于37 ℃、5%CO2培养箱中继续培养24 h。取出Transwell 小室,弃去孔中培养液,用无钙PBS洗2 遍,甲醇固定30 min,将小室适当风干。室温下Gimusa 染色20 min,用棉签轻轻擦掉上层未侵袭细胞,用PBS 洗3 遍。200 倍显微镜下随机选取5 个视野观察细胞,记数并进行统计。
1.3 统计学处理 应用SPSS 25.0 统计学软件进行数据分析处理,GraphPad 8.0 软件绘图。符合正态分布的计量资料以±s 表示,两组间比较采用t 检验,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 胃癌组织中LUCAT1 表达 RT-qPCR 检测结果显示,胃癌组织中LUCAT1 表达水平显著高于癌旁正常组织,差异有统计学意义(P<0.05)。见图1。
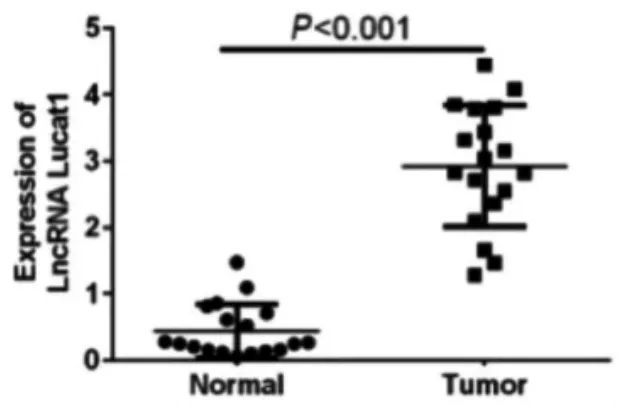
图1 胃癌组织和癌旁正常组织中LUCAT1 表达
2.2 胃癌细胞中LUCAT1 表达 LUCAT1 在BGC-823、AGS、SGC7901 及MKN45 胃癌细胞株中均有表达,SGC7901 细胞LUCAT1 表达量显著高于其他细胞株,差异有统计学意义(P<0.05),选择SGC7901 细胞进行后续实验。见图2。
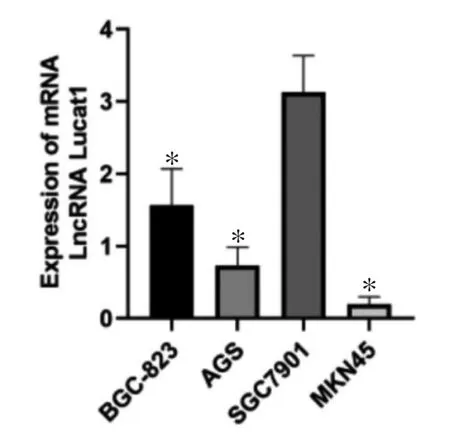
图2 胃癌细胞中LUCAT1 表达
2.3 各组SGC7901 细胞LUCAT1 表达比较 RTqPCR 结果显示,si-LUCAT1 组中LUCAT1 表达较si-NC 组降低,而pLV-LUCAT1 组中LUCAT1 表达较pLV-NC 组增加,差异均有统计学意义(P<0.01),提示质粒转染成功。见图3。
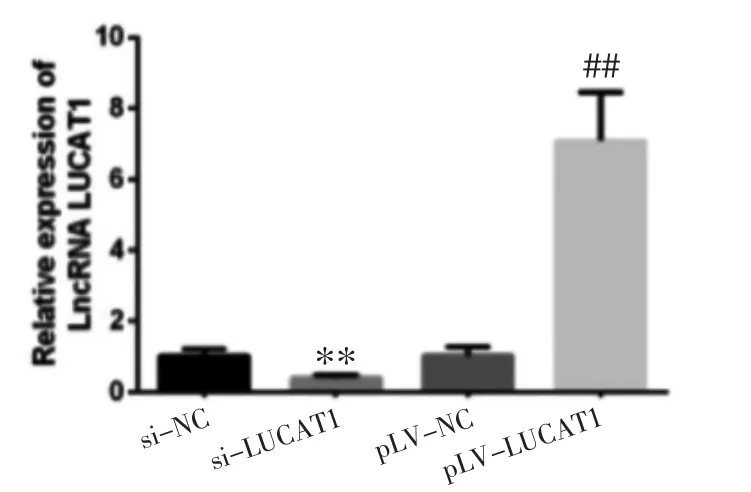
图3 各组SGC7901 细胞中LUCAT1 表达
2.4 各组SGC7901 细胞增殖水平比较 MTT 检测结果显示,si-LUCAT1 组细胞增殖水平显著低于si-NC 组,pLV-LUCAT1 组细胞增殖水平显著高于pLV-NC 组,差异有统计学意义(P<0.01)。见图4。
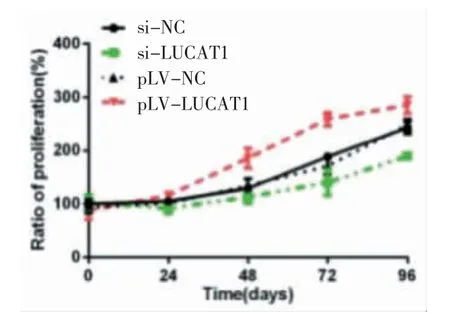
图4 各组SGC7901 细胞增殖曲线
2.5 各组SGC7901 细胞侵袭能力比较 Transwell实验显示,si-LUCAT1 组细胞的侵袭能力显著低于si-NC 组(P<0.05),pLV-LUCAT1 组细胞的侵袭能力显著高于pLV-NC 组差异均有统计学意义(P<0.01)。见图5。
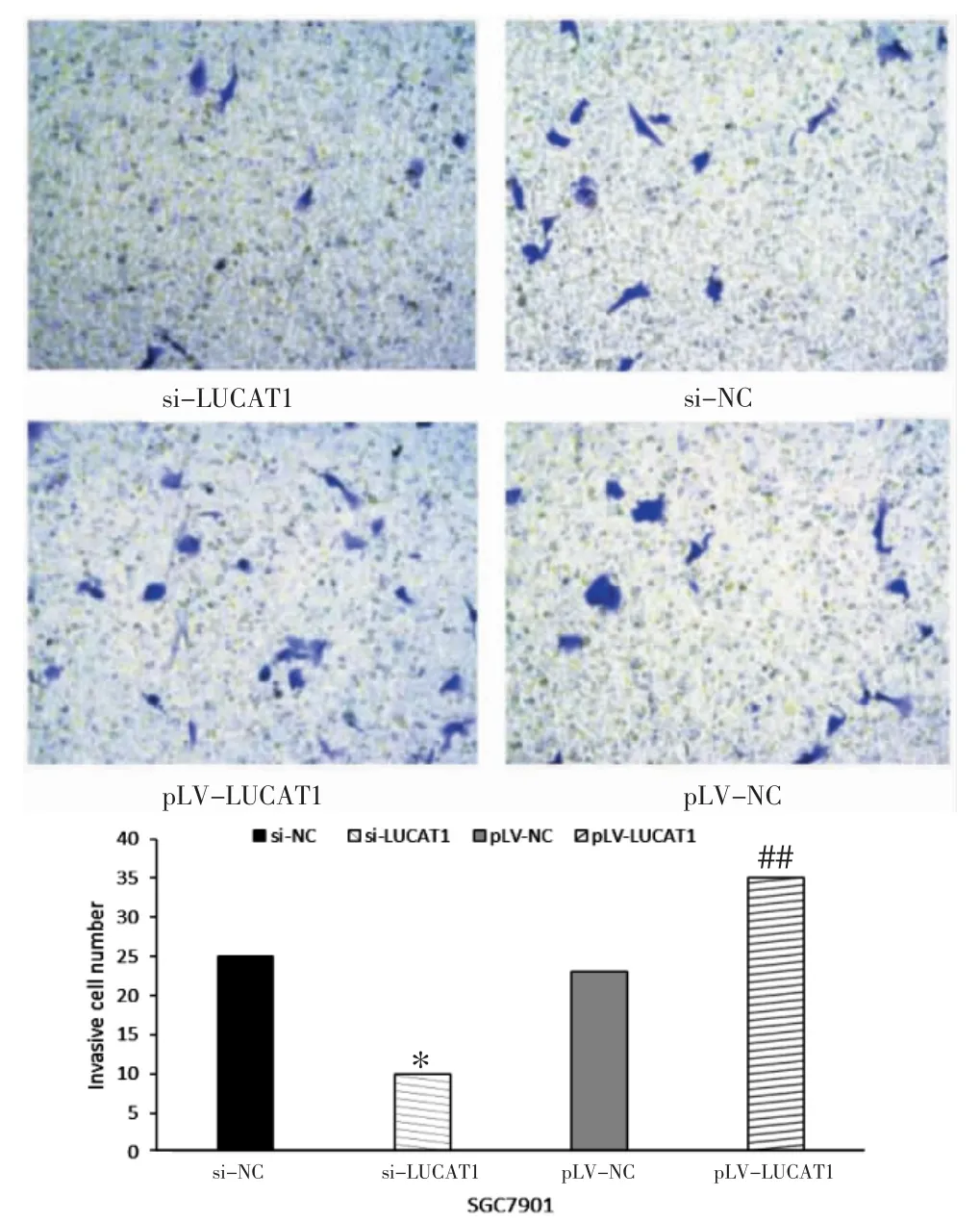
图5 Transwell 实验检测细胞侵袭
3 讨论
LncRNA 与DNA、RNA 和转录因子相互作用调控DNA 甲基化、组蛋白修饰及染色质重塑等多种生物学过程,在表观遗传、细胞周期和细胞分化调控等生理过程中发挥重要作用。目前在多种人类肿瘤中发现lncRNA 表达量的改变,如在肾癌细胞中lncRNA HOTAIR 主要通过影响特定基因位点H3K27 甲基化而调控基因表达,最终促进肿瘤细胞增殖,抑制细胞凋亡[3];在非小细胞肺癌中lncRNA LUCAT1 通过海绵化miR-493-5p 来调节RAC1 的表达,从而影响非小细胞肺癌的生长、迁移、侵袭和预后[4]。有研究证实,LncRNA AK023391 可通过激活PI3K/Akt信号通路促进胃癌的发生和侵袭[5]。
肺癌相关转录本LUCAT1 位于5 号染色体14.3区,因其通过表观遗传抑制P21 和P57 表达促进非小细胞肺癌细胞增殖而得名[6]。据报道,LUCAT1 通过调节miR-199a-5p 表达促进卵巢癌细胞增殖[7]。近年来,有文献表明LUCAT1 在胃癌中表现恶性生物学行为,LUCAT1 表达水平与胃癌患者的分期和预后相关[8]。本研究结果显示,胃癌组织中LUCAT1表达显著高于癌旁正常组织,差异有统计学意义(P<0.05);LUCAT1 过表达胃癌细胞增殖和侵袭能力增强,抑制LUCAT1 表达后胃癌细胞增殖和侵袭能力下降,提示LUCAT1 促进胃癌细胞的增殖和侵袭能力,在胃癌发生发展中起着重要作用,有望成为胃癌诊断和治疗的生物学指标。
