缺血性脑卒中患者白细胞线粒体膜电位和线粒体呼吸链复合体活性变化及其与卒中后抑郁的关系
2023-06-06任长安戚游汪文娟
任长安 戚游 汪文娟
缺血性卒中(ischemic stroke,IS)是脑卒中的主要类型,常见于50岁以上中老年人群,具有高发病率、高致残率和高致死率的特点[1]。既往研究表明IS患者治疗后常遗留不同程度神经根功能损害,不仅可导致日常生活自理能力下降,还可引起患者情感障碍,其中以卒中后抑郁(post-stroke depression,PSD)最为常见[2-4]。目前关于PSD详细的发病机制尚未完全明确,王东等[5]研究表明IS患者PSD患病率高达36.4%,糖尿病、多发病灶以及神经功能缺损均为PSD的主要危险因素。近年来研究表明线粒体膜电位和呼吸链复合体活性与脑细胞缺血性损伤存在密切联系,其机制可能与活性氧自由基(reactive oxygen species,ROS)介导的氧化损伤有关[6-7];王倩等[8]研究结果显示右美托咪定可通过降低线粒体膜电位和减少线粒体呼吸链复合体活性损伤减轻老年患者全身麻醉手术后的认知功能损害。由此推测线粒体损伤可能在脑细胞缺血损伤和PSD发病中发挥重要作用。本研究对IS患者白细胞线粒体膜电位、线粒体呼吸链复合体活性变化及其与PSD的关系进行分析,以明确PSD发病机制并为临床治疗提供思路。
1 对象和方法
1.1 对象前瞻性收集2018年11月至2020年7月作者医院收治的IS患者189例,其中男112例,女77例,年龄37~84岁,平均(57.4±11.3)岁。纳入标准:(1)符合中华医学会神经病学分会脑血管病学组《中国急性缺血性脑卒中诊治指南2018》IS诊断标准[9];(2)年龄≥18岁;(3)发病至入院时间<24 h;(4)患者意识清醒并且可配合完成相关检查;(5)入院前未接受抗凝、溶栓或神经营养等治疗。排除标准:(1)合并恶性肿瘤、严重感染或冠心病等其他严重基础疾病;(2)合并脑卒中、外伤或手术病史;(3)合并精神障碍、痴呆或神经系统病变;(4)合并失语或听力障碍等因素所致交流沟通困难;(5)既往有酗酒或药物滥用等病史者。脱落标准:(1)随访期间失访或主动要求退出研究者;(2)发生突发意外事件无法继续完成研究者;(3)患者因死亡或昏迷等原因导致临床资料不完整者。本研究已通过作者单位医学伦理委员会审批通过(WXFS-201811-006),且患者和家属均签署知情同意书。
1.2 方法
1.2.1白细胞线粒体膜电位测量:采集患者入院第1天和随访结束时空腹外周静脉血3 mL,置于EDTA-K2抗凝管,4℃以600g离心10 min后去除上清液,采用Coulter Epics XL型流式细胞仪(美国Beckman公司)分离白细胞,采用PBS溶液冲洗5 min×3次。向白细胞中加入Trizol试剂(美国Invitrogen公司),使白细胞水平为1×106~1×107/500 μL,并反复抽吸至产生大量泡沫,室温环境孵育5 min。然后加入三氯甲烷(与Trizol溶液体积比为1∶5),剧烈震荡15 min后静置10 min,4℃以11000g离心3 min,将上清液转移至EP管并加入异丙醇(与Trizol溶液体积比1∶2),摇匀后室温条件孵育10 min,再于4℃环境下以11000g离心3 min,去除上清液并向底层沉淀物中加入75%(体积分数)乙醇(与Trizol试剂体积等同),混匀后在4℃环境以9000g离心5 min,去除上清液并将沉淀物置于滤纸片上进行自然干燥,5 min后加入60 μL焦碳酸二乙酯(diethylpyrocarbonate,DEPC)水溶液,溶解后加入JC-1染色液并37℃恒温水浴30 min,采用流式细胞仪检测荧光强度并分析线粒体膜电位,其中JC-1单体为绿色荧光,JC-1在线粒体内形成的聚合物呈红色荧光,以红/绿荧光强度比值表示膜电位大小。
1.2.2白细胞线粒体呼吸链复合体活性测量:取患者入院第1天和随访结束时空腹外周静脉血3 mL,采用“1.2.1”方法分离并提纯白细胞,然后采用ELISA法(试剂盒购自Beyotime公司)检测白细胞线粒体呼吸链复合体I、Ⅱ、Ⅲ和Ⅳ吸光度,检测波长分别为340 nm、600 nm、550 nm和550 nm。通过标准曲线计算各复合体浓度。所用仪器为美国Agilent公司8453紫外-可见分光光度计。
1.2.3PSD随访和分组:均随访1年。随访结束时采用汉密尔顿抑郁量表(Hamiliton depression scale,HAMD)评估患者有无PSD及严重程度,内容包括抑郁情绪、负罪感及自卑感等共24项,总分<8分为无抑郁,≥8~<17分为轻度抑郁,≥17~<24分为中度抑郁,≥24分为重度抑郁,根据HAMD评分将患者分为PSD(≥8分)和非PSD(<8分)两组,比较两组性别、年龄和体质量指数(body mass index,BMI)等临床资料和白细胞线粒体膜电位及白细胞线粒体呼吸链复合体活性的差异。
1.3 统计学处理采用SPSS25.0软件进行统计学分析,计数资料采用χ2检验;满足正态分布的计量资料采用均数±标准差表示,两均数比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;采用Pearson积差系数分析IS患者白细胞线粒体膜电位、线粒体呼吸链复合体活性与HAMD评分的相关性;采用受试者工作特征(ROC)曲线分析IS患者白细胞线粒体膜电位、线粒体呼吸链复合体活性变化对PSD的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料比较189例患者失访4例,死亡2例,自行退出研究1例,共脱落7例(3.70%),共182例患者进入分析。发生PSD共73例(40.11%),其中轻度29例(39.73%)、中度26例(35.62%),重度18例(24.66%)。PSD组和非PSD组性别构成、年龄以及BMI等临床基本资料比较差异均无统计学意义(均P>0.05)。结果见表1。

表1 PSD组和非PSD组临床资料比较
2.2 两组患者白细胞线粒体膜电位比较PSD组入院第1天白细胞线粒体膜电位低于非PSD组(P<0.05),随访1年时两组白细胞线粒体膜电位均明显升高(P<0.05),且两组间比较差异无统计学意义(P>0.05)。结果见表2。
表2 两组白细胞线粒体膜电位比较
2.3 两组白细胞线粒体呼吸链复合体活性比较PSD组入院第1天白细胞线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性低于非PSD组(P<0.05),随访1年时两组白细胞线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性均明显升高(P<0.05),且两组间比较差异无统计学意义(P>0.05)。结果见表3。

表3 两组患者白细胞线粒体呼吸链复合体活性比较
2.4 不同严重程度PSD患者白细胞线粒体膜电位及呼吸链复合体活性比较随着PSD严重程度增加,入院第1天时患者白细胞线粒体膜电位及呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性均明显降低(P<0.05)。结果见表4。

表4 不同严重程度PSD患者入院第1天时白细胞线粒体功能比较
2.5 相关性分析PSD患者HAMD评分与入院第1天白细胞线粒体膜电位及呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性均明显呈负相关(P<0.05)。结果见表5。

表5 PSD患者HAMD评分与入院第1天白细胞线粒体功能相关性分析
2.6 ROC曲线分析IS患者入院第1天白细胞线粒体膜电位及呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性预测PSD的AUC分别为0.606、0.734、0.816、0.747和0.690(均P<0.05),具有一定诊断价值,其中线粒体膜电位和呼吸链复合体Ⅳ活性特异度较高,呼吸链复合体Ⅰ~Ⅲ活性敏感度较高。结果见表6和图1。

表6 白细胞线粒体功能对PSD的预测价值分析
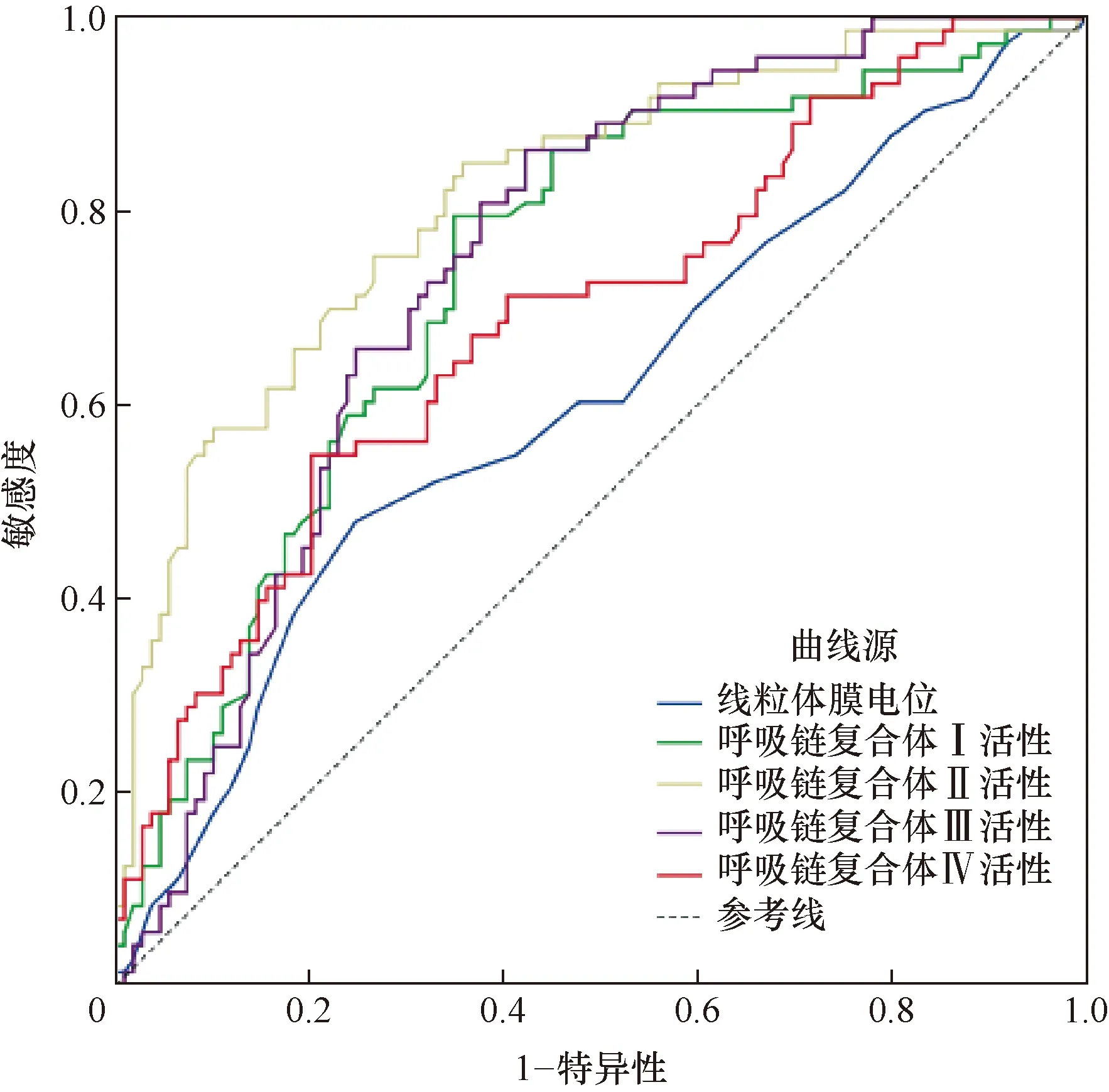
注:PSD:卒中后抑郁;ROC:受试者工作特征
3 讨论
PSD常见于脑卒中后2年内,且高发期为脑卒中后3个月至1年,国外追踪调查研究结果显示脑卒中后1、3、12和24个月时PSD发生率分别为25%、31%、16%和29%[10-11]。本研究对182例IS患者治疗后随访1年,结果显示PSD发生率为40.11%。这与王东等[5]报道的36.4%相近。既往研究认为PSD由多种因素综合作用所致,其发病风险与IS患者基础健康、脑卒中病灶位置和神经功能缺损严重程度等密切相关,同时还受家庭和社会环境影响[12]。而本研究结果并未发现PSD患者与非PSD组患者间性别构成、年龄以及BMI等临床指标具有统计学差异,提示PSD影响因素较为复杂,且不同地区报道可能存在差异。其原因可能与样本选取有关,如既往研究表明随着年龄增长,PSD发病风险明显升高,史莉瑾等[13]以平均年龄(63.1±7.1)岁的患者为样本进行研究显示年龄≥70岁为PSD独立危险因素,而本研究患者平均年龄相对较小,70岁以上患者占比较低,故而对PSD的发生未显示出统计学影响。因此,有关PSD发生的确切影响因素尚需进一步开展多因素分析研究证实。
PSD主要病理生理机制为脑组织缺血损伤导致神经递质通路破坏,因此不仅可造成病灶部位神经功能缺损,还可通过去甲肾上腺素(NE)和5-羟色胺(5-HT)等神经递质分泌异常引起控制情感的脑组织损伤[14]。线粒体功能异常与IS患者脑组织损伤存在密切联系。Andrabi等[15]研究结果显示线粒体功能损伤可影响活性氧生成和电子传递链功能,从而在细胞凋亡中发挥重要作用。岳萌等[16]通过建立小鼠高血糖脑缺血再灌注模型进行分析显示活性氧可能通过影响线粒体膜电位而加重脑缺血性损伤。有研究结果显示,氧化应激是造成线粒体膜电位异常的关键环节,脑卒中后产生的大量氧自由基可造成膜电位降低,线粒体膜通透性增加和细胞色素C大量释放[17]。线粒体膜电位降低可导致能量代谢障碍和氧化应激异常,甚至诱导线粒体和白细胞凋亡,加重神经功能缺损,导致PSD发生风险程度增加。本研究结果显示,PSD组入院第1天时白细胞线粒体膜电位和呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性低于非PSD组,提示IS患者线粒体膜电位降低且呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性减退导致了线粒体能量代谢障碍和脑组织损伤,当累及额叶或海马等部位时可造成神经元活动抑制进而发生抑郁症。
呼吸链复合体Ⅰ~Ⅳ为电子和氢传递载体,其活性下降直接造成线粒体能量代谢障碍和ATP合成减少。既往研究结果显示抑郁症模型大鼠和临床患者脑细胞线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性均存在不同程度抑制,且以复合体Ⅰ最为显著[18]。本研究根据HAMD量表评估PSD严重程度,结果显示其中轻度29例(39.73%)、中度26例(35.62%),重度18例(24.66%),表明中、重度PSD患者占比较高;同时本研究结果显示随着PSD严重程度不断加重,入院第1天患者白细胞线粒体膜电位以及呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性均呈明显降低,且PSD患者HAMD评分与入院第1天白细胞线粒体膜电位及呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性均呈明显负相关性,提示IS患者线粒体功能损害与PSD发生存在密切联系。既往研究表明线粒体在氧化应激等因素作用下导致膜电位降低,线粒体膜通透性随之增加,线粒体内细胞色素C(CytC)大量释放至包浆内,启动Caspase级联反应,从而诱导细胞凋亡[19]。有研究认为β淀粉样蛋白(Aβ)生成和代谢障碍导致Aβ在脑内沉积,形成Aβ斑块并诱导神经元凋亡,该病理过程又可促进Aβ沉积,从而形成级联放大效应,导致患者认知功能逐渐下降[20]。线粒体功能障碍可导致Aβ生成和累积增多,Aβ又可消耗血红素基团并抑制复合物Ⅳ合成,同时神经纤维缠结等病理结构中高度磷酸化的微管相关蛋白Tau也可损害复合物Ⅰ活性,可见呼吸链复合体活性与认知功能损害存在相互影响的关系[21-23]。此外文献报道显示辅酶Q10活性下降[24]、线粒体DNA缺陷[25]以及蛋白质组结构异常[26]等也在抑郁症发病机制中占有重要地位,但这些机制与脑卒中的关系还有待进一步研究。总之线粒体结构和功能异常是PSD发生的重要机制,且涉及线粒体结构、分子和复合体等多个环节,为完全明确线粒体与PSD关系的具体细节,后续还需要不断研究和探讨。
目前对PSD还缺少有效预测方法。慕丽等[27]报道显示入院时红细胞分布宽度对PSD具有一定预测价值,但敏感度和特异度均存在不足。本研究采用IS患者入院第1 天白细胞线粒体膜电位及呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅳ活性进行ROC分析,结果显示其AUC分别为0.606、0.734、0.816、0.747和0.690,其中以呼吸链复合体Ⅱ临床价值最高,其敏感度和特异度分别为84.93%和64.22%,可为PSD早期预测和干预提供参考信息,但单独应用仍然存在不足,因此后续还需要开展研究探讨其他与PSD存在密切关系的实验室指标进行联合预测。此外,本研究显示线粒体膜电位的预测价值较低,其原因可能与膜电位稳定性较差,导致测量结果容易发生偏倚有关。
综上所述,PSD患者入院第1 天白细胞线粒体膜电位及呼吸链复合体Ⅰ~Ⅳ活性均明显降低,且与抑郁严重程度存在明显负相关,可能在PSD发病和进展过程中发挥重要作用,对PSD的发生具有一定预测价值。
