铁掺杂碳点pH荧光探针的构建及分析应用
2023-06-05路雯婧郭艳娇双少敏董川
路雯婧,郭艳娇,双少敏,董川
(山西大学 化学化工学院,山西 太原 030006)
0 引言
细胞内pH 水平对于维持细胞的正常运行以及生理系统的稳定性具有重要作用[1]。细胞内酶的活性,信号的传导,离子的转运和调节,细胞的生长和凋亡以及系统的稳态平衡等都与pH 紧密相关[2-3]。pH 的微小变化可能会导致细胞器功能出现障碍,例如溶酶体的pH 值一般维持在4.5~6.5 的酸性环境中[4-6],pH 异常会影响大分子的代谢和细胞正常活动,进而影响细胞的正常凋亡,甚至会导致痛风、阿尔兹海默症、癌症等多种疾病[7-10]。由于pH 对所有生命体而言都至关重要,因此精确监测pH 的变化至关重要。目前,已开发出多种技术手段用于测定pH 值,例如微电极、核磁共振、吸收光谱等方法[11-12]。其中,荧光光谱法由于灵敏度高、信噪比高、响应速度快、成本低、操作简单和实时监测等优点被广泛应用于化学生物传感领域[13]。然而,大多数pH 荧光探针都是基于有机小分子荧光团设计合成的,存在光稳定性差、生物相容性差、毒性高、制备过程复杂等缺点,限制了其在生物体系中的广泛应用。因此,开发用于监测生理环境中pH 变化的新型荧光探针对于研究受pH 影响的相关的疾病具有重要意义。
碳基纳米材料由于具有良好的化学稳定性、生物相容性和低毒性等突出的优点,受到越来越多的关注并被广泛应用于各个领域[14-15]。碳点(CDs)作为一种新兴的具有荧光特性的碳基纳米材料,在2004 年被Walter A.Scrivens 等[16]在碳纳米管电泳实验中偶然发现。2006 年Sun Ya-Ping 课题组[17]将其定义为“碳点”并建议钝化表面以优化其性能。由于CDs 优良的荧光特性、易于功能化、制备原料来源广泛、制备方法多样等诸多优点,已经在生物、化学、材料等领域得到广泛的应用[18-23]。同时,CDs 通常具有较低的细胞毒性和良好的生物相容性,作为荧光探针在检测生理环境中的小分子应用中具有良好的发展潜力。其中,最为突出的是用于pH 荧光探针。通过pH 变化导致碳点表面结构或电子分布的改变,从而引起荧光信号改变的机理,可以设计用于监测细胞环境不同区域的pH 变化过程。然而,若未经修饰或钝化等步骤的CDs 仍然存在量子产率较低、表面功能基团较少等问题,从而限制其在pH 传感领域的应用。为了拓宽其应用范围,研究发现对CDs 表面进行功能化修饰和化学掺杂是改善其缺点的两个非常有效的途径[24-26]。功能化修饰一般要经过复杂的合成和纯化步骤,所得的产率较低并会影响CDs 的固有性质,这大大限制了其在分析传感中的应用[27-28]。化学掺杂(金属元素掺杂和非金属元素掺杂)则由于制备过程简便和高效的优点而被广泛应用,其中掺杂金属元素可以有效地改善CDs 的内部结构或电子分布,从而影响其物理或化学性质[29]。不同金属离子的掺杂会对CDs 的荧光量子产率(QYs)造成不同程度的影响,这可能源于掺杂的金属离子改变了CDs 的几何结构或电子结构[30-31]。因此,制备新型金属掺杂碳点,探索其作为荧光探针在不同pH 范围内的响应情况,对监测细胞内不同区域pH 的动态变化及其对相关疾病的影响非常重要。
本文以邻苯二胺和血红素为前驱体通过一步水热法制备了表面多种官能团的铁掺杂黄色荧光碳点(Fe-CDs),通过多种分析表征证明Fe-CDs 具有良好的水溶性和稳定的光学性能。由于其表面丰富的氨基、羧基等官能团及铁元素的掺杂,Fe-CDs 可以作为荧光探针用于酸性环境下的pH 检测。同时Fe-CDs 具有较低的细胞毒性,易于被细胞摄取,可通过荧光成像手段监测细胞内pH 的水平变化,并且在研究因pH 波动而影响的生理变化中表现出良好的应用潜力。
1 实验部分
1.1 试剂和仪器
主要试剂:邻苯二胺,血红素购自美国Sigma-Aldrich 试剂有限公司。所有实验用药品均为分析纯,且使用时未经附加处理。实验用水为由美国Milli-Q 超纯水仪制得的超纯水。
主要仪器:JEM-2100 型透射电子显微镜(日本电子株式会社JEOL);Cary670 型傅里叶变换红外光谱仪(美国安捷伦科技公司);U-2910 型紫外可见吸收光谱仪(HITACHI LTD);F-4500 型荧光/磷光分光光度计(HITACHI LTD);Zetasizer Nano ZS90 型粒度电位仪(Malven);AXIS ULTRA DLD 型 X-射线光电子能谱仪(日本Kratos 公司);FV1000 型激光共聚焦显微镜(日本Olympus 公司)。
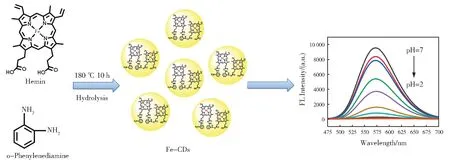
图1 Fe-CDs的合成路径及应用示意图Fig.1 The synthetic procedure and application schematic diagram of the Fe-CDs
1.2 Fe-CDs的制备方法
分别称取0.01 g 血红素和0.1 g 邻苯二胺,置于含20 mL 无水乙醇的锥形瓶中,搅拌后超声15 min 使其充分溶解,将溶液转移至水热反应釜后置于烘箱内,180 ℃反应10 h,待水热反应釜完全冷却至室温。随后将反应产物过滤后旋蒸除去乙醇溶剂,并重新分散在超纯水中,超声使其完全溶解,再用0.22 μm 滤膜过滤后得到黄褐色碳点溶液。将上述黄褐色碳点水溶液冷冻干燥48 h,即得到Fe-CDs 固体状粉末。
1.3 荧光量子产率的测定
Fe-CDs 的荧光量子产率(QY)根据文献[32]中方法测定,以溶解于乙醇中的罗丹明6G(QY=95%)为参比溶液。Fe-CDs 的QY 由以下等式计算:
ΦS和ΦR分别代表Fe-CDs 和参比溶液罗丹明6G 的QY;n表示荧光发射峰的积分面积;A表示吸光度;η表示溶剂的折射率(水为1.33,乙醇为1.36)。为减小自吸收效应,限定激发波长下的吸光度A<0.05(λex=488 nm,荧光发射范围λem为500 nm~650 nm)。
1.4 Fe-CDs荧光稳定性的测定
配置一系列浓度为0.1 mg/mL,pH=7 的Fe-CDs 溶液,分别加入10 μL,0.1 mol/L 的15种金属离子及17 种氨基酸,测量并记录Fe-CDs 的荧光强度变化,研究在生物体中共存物对Fe-CDs 荧光的影响。
1.5 Fe-CDs检测pH的方法
配置浓度为0.1 mg/mL 的Fe-CDs 储备液及不同pH 值(2~12)的BR 缓冲溶液,将150 μL Fe-CDs 储备液分别分散到含2.0 mL 不同pH 值的BR 缓冲液的比色皿中混合均匀。通过荧光分光光度计,扫描其发射光谱(λex=449 nm,λem=571 nm),测量并记录不同pH 值的Fe-CDs 的荧光强度。根据pH 和Fe-CDs 荧光强度值,通过玻尔兹曼函数拟合曲线,计算pKa 值和检测pH 的标准曲线[33]。所有测量均重复3 次。
1.6 细胞毒性测试
通过MTT 方法评估制备的Fe-CDs 对人宫颈癌HeLa 细胞的细胞毒性。首先将含细胞的96 孔细胞培养板放在37 ℃,体积分数为5.0%CO2培养箱内孵育3 h。用200 μL 含有不同浓度的Fe-CDs 和含有10%胎牛血清(FBS)的新鲜DMEM 培养基再进行孵育24 h,记为实验组,每组至少含有6 个平行样本。将未加入Fe-CDs 处理过细胞记为空白组,随后在每个孔内加入20 μL,5.0 mg/mL MTT 试剂,进一步孵化5 h。移除培养基,加入150 μL DMSO 溶液,将混合物在室温下震荡10 min 后用酶标仪测定在490 nm 处混合物的光密度(OD)。细胞存活能力通过以下等式计算:
细胞存活率(%)=(OD 实验组/OD 对照组)×100%
OD 实验组为加入Fe-CDs 的细胞光密度,OD 对照组为未加入Fe-CDs 的细胞光密度。
1.7 细胞成像实验
选用人宫颈癌HeLa 细胞为模型,将浓度为0.1 mg/mL 的不同pH 值(pH=2,5,7)的Fe-CDs 与HeLa 细胞共孵育半小时,随后通过激光共聚焦显微镜对HeLa 细胞进行细胞成像实验,观察在不同pH 值下Fe-CDs 对细胞形态及细胞内的荧光强度的影响。
2 结果与讨论
2.1 Fe-CDs的形貌结构表征
本文以含有微量铁元素的生物分子血红素和邻苯二胺为前驱体,通过一步水热法制备了黄色荧光Fe-CDs,并通过多种分析手段表征了其粒径及结构。透射电子显微镜(TEM)图显示合成的Fe-CDs 呈均匀的球形分散(图2a),平均粒径约为2.92 nm(图2b)通过高分辨率TEM 图像(2a 插图)可以看出Fe-CDs 的晶格间距约为0.14 nm。通过电感耦合等离子体发射光谱(ICP-OES)验证铁元素的掺杂量,结果表明Fe-CDs 中掺杂的Fe 元素的含量约为1.08%。由傅里叶变换红外光谱图(FT-IR,图2c)表征Fe-CDs 的表面官能团结构,3384 cm-1附近明显的吸收峰对应O-H/N-H 的伸缩振动[34];1713 cm-1、1499 cm-1、1273 cm-1和1154 cm-1的特征峰分别对应于羧基或酰胺基团的C=O、C=C[35]、C-N[36]及Fe-N[37]的伸缩振动。Fe-CDs 的多种吸收峰表明其表面含有氨基、羧基等多种亲水性能团,并且Fe-N 的吸收峰再次证明铁元素的成功掺杂。
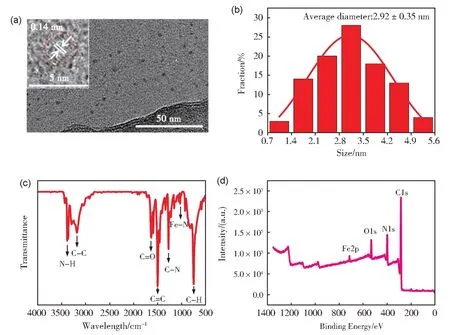
图2 (a)Fe-CDs的TEM图;(b)Fe-CDs的粒径分布图;(c)Fe-CDs的红外光谱图;(d)Fe-CDs的X射线光电子能谱Fig.2 (a) TEM image of the Fe-CDs; (b) Diameter distribution image of the Fe-CDs; (c) FT-IR spectra of the Fe-CDs;(d) XPS spectrum of the Fe-CDs
通过X 射线光电子能谱(XPS)验证Fe-CDs 中元素组成,如图2(d)中出现四个特征结合能峰,分别位于285.6 eV、399.1 eV、532.0 eV 和715.1 eV,表明Fe-CDs 除H 元素外还有C、N、O、Fe 四种元素。高分辨率XPS 谱显示,C 1s 是由284.4 eV(C-C/C=C),285.6 eV(C-N),286.7 eV(C-O)和287.6 eV(C=O)四个特征峰构成的[38](图3a)。N 1s 谱中显示了398.2 eV(N-Fe),399.5 eV(吡咯N)和401.2 eV(N-H)三个特征峰[39](图3b)。由图3C 可以看出,O 1s 谱是由531.3 eV(C-OH)和532.4 eV(C=O)两个特征峰构成的[40]。Fe 2p谱中显示了碳点中Fe 的710.1 eV(Fe 2p1/2)和726.1 eV(Fe 2p3/2)两个特征峰(图3d)[41]。XPS 光谱结果与红外光谱具有良好的一致性,进一步证明了铁元素的成功掺杂。

图3 Fe-CDs的高分辨X射线光电子能谱(a) C 1s;(b) N 1s;(c) O 1s; (d) Fe 2pFig.3 The high-resolution XPS spectra of Fe-CDs(a) C 1s; (b) N 1s; (c) O 1s and (d) Fe 2p
2.2 Fe-CDs的光谱性质
通过紫外可见吸收光谱仪和荧光光谱仪表征Fe-CDs 的光谱性能。如图4(a)所示,在紫外可见吸收光谱中Fe-CDs 在300 nm 和425 nm 附近表现出明显的宽吸收峰,分别归因于Fe-CDs内核共轭体系的π→π*跃迁,及表面多种官能团的n→π*跃迁。从荧光光谱可以看出Fe-CDs 的最佳激发和发射波长分别为449 nm 和571 nm。Fe-CDs 在紫外灯照射下可以看到明亮的黄色荧光。从不同激发波长下Fe-CDs 的发射光谱数据(图4b)可以看到,当激发波长由390 nm 增加到550 nm 时,Fe-CDs 的荧光发射波长几乎没有明显的变化,荧光强度先增加后下降,表明Fe-CDs 的发光性质是激发波长独立性的,这可能是由于Fe-CDs 的粒径及发射中心相对均匀的原因。另外,相较于其他金属掺杂碳点[42-47],Fe-CDs 表现出高的荧光量子产率,以罗丹明6G(乙醇中QY=95%)为参照,其量子产率可达26.80%(表1)。
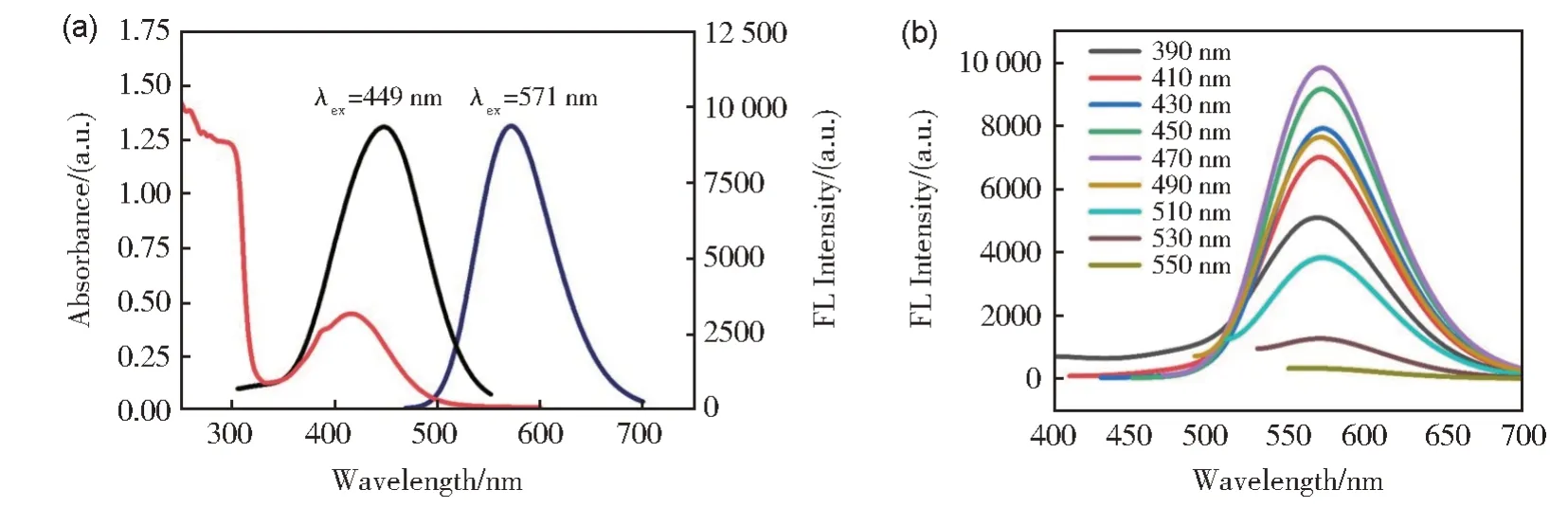
图 4 (a)Fe-CDs的紫外-可见吸收光谱和荧光激发光谱、发射光谱;(b)在不同激发波长激发下Fe-CDs的荧光发射光谱Fig.4 (a) UV-vis absorption and Fluorescence excitation, emission spectra of Fe-CDs in aqueous solution;(b) Fluorescence emission spectrum of the Fe-CDs at various excitation wavelengths

表1 不同金属掺杂碳点的荧光量子产率对比Table 1 Comparison of fluorescence quantum yield among the M-CDs
为了研究Fe-CDs 的荧光稳定性,考察了不同离子强度、金属离子及氨基酸对Fe-CDs 荧光强度的影响。如图5(a),以不同浓度NaCl 溶液模拟不同离子强度环境,当NaCl 溶液浓度高达到2.0 mol/L 时,荧光强度依然可维持原始荧光强度的90%以上,表明Fe-CDs 具有良好的离子稳定性和抗盐能力。如图5(b)和5(c)所示,当Fe-CDs 分别与15 种不同的金属离子及17 种不同的氨基酸共存时,Fe-CDs 荧光强度几乎不受各种共存物质的影响,表明Fe-CDs 有比较强的光稳定性。
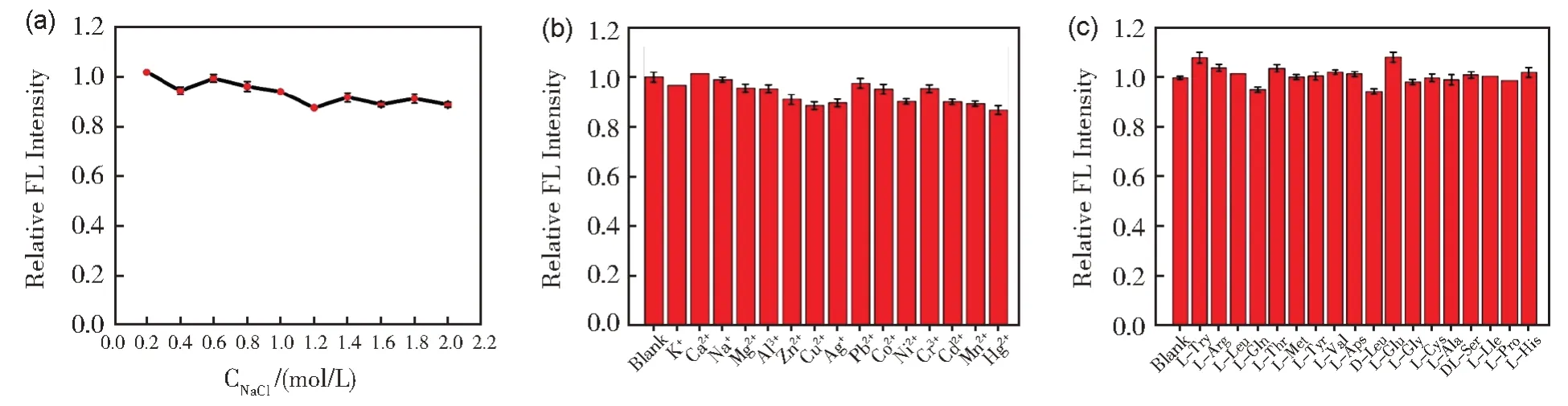
图5 (a)不同浓度的盐溶液对Fe-CDs荧光强度的影响;(b)不同金属离子对Fe-CDs荧光强度的影响;(c)不同氨基酸对Fe-CDs荧光强度的影响Fig.5 (a) Effects of different concentration of NaCl; (b) Effects of different metal ions;(c) Effects of different amino acids
2.3 Fe-CDs荧光探针检测pH
pH 在很大程度上影响着机体的正常功能,开发用于监测细胞内pH 变化的新型荧光探针对于研究pH 影响的相关的疾病具有重要意义。由于Fe-CDs 表面存在丰富的活性官能团,我们探索了其在传感器领域的潜在应用。如图6(a)所示,Fe-CDs 在酸性环境下的荧光强度随着pH的减小逐渐降低(λex=449 nm,λem=571 nm)。当pH 降低至2 时,Fe-CDs 95%的荧光强度被猝灭;当pH 为7 时Fe-CDs 荧光强度达到最高值。在碱性环境下,随着pH 的逐渐增大,Fe-CDs 荧光强度变化不大。通过玻尔兹曼函数拟合曲线,得到Fe-CDs 的pKa 为5.32,且在pH 4.4~6.2 范围内,Fe-CDs 荧光强度与pH 具有良好的线性相关性,y=4086 pH-16 800.5(图6b)。上述实验结果证明Fe-CDs 可作为监测酸性条件下pH 变化的新型荧光探针。
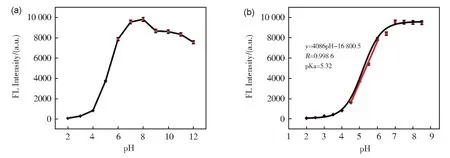
图6 Fe-CDs随pH值的荧光强度变化(a)pH为2~12的荧光强度变化;(b)pH为2~7范围的荧光强度变化Fig.6 The fluorescence intensity change of Fe-CDs at pH(a) pH 2-12; (b) pH 2-7
通过检测不同pH 下的Fe-CDs 的Zeta 电位、荧光寿命及紫外吸收光谱,研究了Fe-CDs 检测pH 的作用机理。由Zeta 电位结果可知,pH 从7降至2 时,随着体系中H+浓度的升高Fe-CDs 的所带电荷由-9.39 mV 升高至16.6 mV。同时Fe-CDs 的荧光寿命由1.70 ns 升高至2.23 ns(图7a)。从紫外吸收光谱可知,随着pH 的逐渐减小,Fe-CDs 在425 nm 处的吸收峰逐渐红移至450 nm(图7b)。因此,推测Fe-CDs 表现出pH 依赖的荧光特性可能是由于pH 值的变化导致Fe-CDs 中π→π*和n→π*电子跃迁变化引起的[48-49],Fe-CDs 表面的羧基、氨基等官能团的质子化和解质子化造成其费米能级的偏移使其表现出pH 依赖的荧光特性[50]。
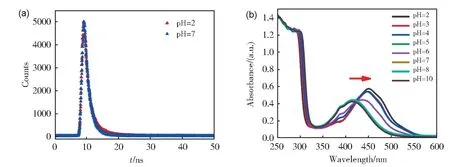
图7 (a)Fe-CDs在pH为2、7时的荧光衰减曲线;(b)在不同pH环境中Fe-CDs的紫外吸收光谱Fig.7 (a) Fluorescence lifetime of Fe-CDs at pH 2 and 7; (b) UV absorption spectra of Fe-CDs in various pH systems
2.4 Fe-CDs 的细胞毒性及其在细胞成像中的应用
通过上述研究证明,Fe-CDs 可作为监测酸性条件下pH 变化的新型荧光探针,在成像应用中具有发展潜力。首先,我们选用人宫颈癌HeLa 细胞为模型,采用MTT 标准法检测Fe-CDs 的细胞毒性。如图8 中所示,用不同浓度的Fe-CDs 与HeLa 细胞共孵育24 h 后,即使Fe-CDs 的浓度达到300 μg/mL,HeLa 细胞的存活率仍高于85%,说明Fe-CDs 毒性非常低,具有良好的生物相容性,可有效应用于体内细胞成像。
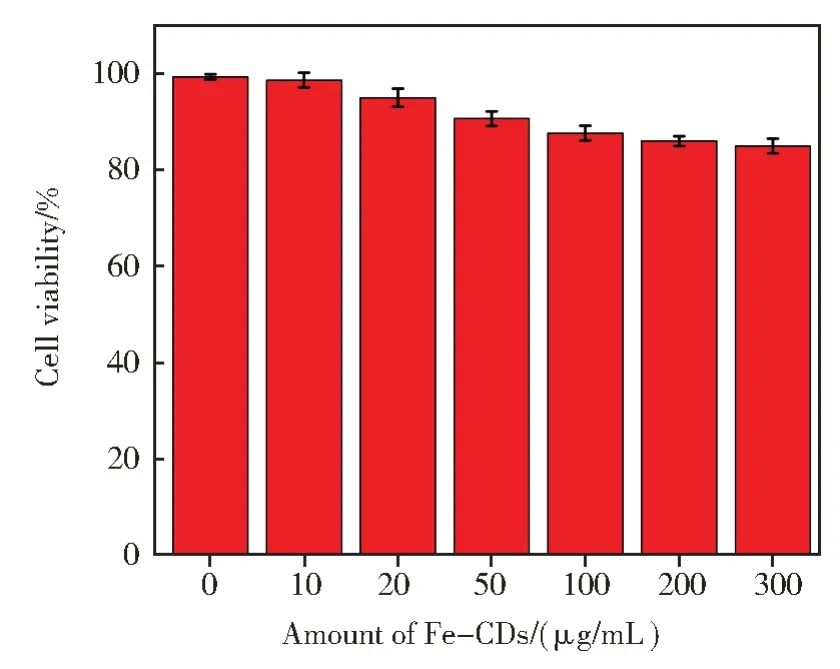
图8 不同浓度Fe-CDs与HeLa细胞共孵育24 h后细胞的存活率Fig.8 The cell viability of HeLa cells incubated with Fe-CDs at different concentrations for 24 h
由于Fe-CDs 具有良好的光学性能及稳定的生物相容性,探索了其作为荧光探针在监测细胞内pH 的可能性。用人宫颈癌HeLa 细胞为模型,将浓度为0.1 mg/mL 的不同pH 值的(pH=2,5,7)Fe-CDs 与HeLa 细胞共孵育半小时进行细胞成像实验,观察细胞形态变化以及细胞内荧光变化。如图9 所示,Fe-CDs 分布于细胞膜、细胞质甚至细胞核区域,说明Fe-CDs具有良好的细胞通透性。当pH 为7 时,细胞内的荧光强度最强(c 和f);当pH 为5 时,Fe-CDs的荧光强度部分猝灭(b 和e);当pH 为2 时,Fe-CDs 的荧光强度几乎全部被猝灭(a 和d)。这与体外实验结果一致,也进一步表明了Fe-CDs 可作为一种良好的pH 荧光探针用于细胞内pH 水平的监测。
3 结论
该工作以邻苯二胺及生物分子血红素为原料,通过一步水热法制备得到铁掺杂荧光碳点(Fe-CDs)。由于原料中的血红素具有大环结构,利于碳点在合成过程形成大的共轭平面;并且微量的铁元素掺杂有助于改变碳点的电荷分布,进而大幅提高了碳点的荧光量子产率,可达26.8%。同时,Fe-CDs 展现出良好的水溶性,稳定的光学性能,优异的抗盐及抗干扰能力。由于其表面丰富的氨基、羧基等官能团及铁元素的掺杂,Fe-CDs 可以作为荧光探针用于酸性环境下的pH 检测。同时Fe-CDs 具有低毒性且易于被细胞摄取,可实现细胞内pH 的荧光成像应用。以上研究证明Fe-CDs 作为一种制备简便、性能优异的荧光探针在生物传感领域具有良好的应用潜力。
