烯醇化酶1通过影响mRNA定位调节人胚胎干细胞自我更新能力
2023-06-05赫佳音杨嘉宾陈仲扬马艳妮
赫佳音,杨嘉宾,陈仲扬,马艳妮,余 佳
中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系医学分子生物学国家重点实验室,北京 100005
人胚胎干细胞(human embryonic stem cells, hESCs)于1998年首次从着床前囊胚的内细胞团中被分离出来,并通过适当的培养体系建立而成,能够长期保持良好的自我更新能力和多能性[1]。作为一种重要的研究模型,了解hESCs命运调控机制显得十分必要。近年来,人们对hESCs多能性的研究大多集中在转录调控网络上,但对转录后水平调控的认知却不充分[2],值得探究。转录后水平过程复杂,包括RNA的代谢及定位等。而在细胞环境中,RNA通常以核糖核蛋白复合体(ribonucleoprotein, RNPs)的形式存在,其中RNA结合蛋白(RNA binding proteins, RBPs)作为调节器,通过直接结合或辅助RNA发挥作用[3],可见RBPs对RNA转录后水平活动的调控至关重要,并可能通过调节RNA影响hESCs的命运决定。
烯醇化酶1(enolase1, ENO1)作为一种代谢酶,负责催化2-磷酸甘油酸(2-phosphoglycerate, 2-PGA)合成磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP),是糖酵解的重要步骤。2015年,人们发现ENO1还可以通过与RNA结合发挥功能,并将其定义为一种新的RBP,但对其具体的作用机制却知之甚少[4]。2021年,ENO1被发现可以作为RBP在肝癌细胞中通过结合铁调节蛋白1(iron regulatory protein, IRP1)的mRNA以调节肝癌细胞内的铁平衡[5];2022年,ENO1被发现结构改变后与RNA结合能力增强,阻滞糖酵解过程,影响小鼠胚胎干细胞(mouse embryonic stem cells, mESCs)的分化[6],由此可见,ENO1作为RBP时可能通过结合RNA发挥多方面的作用,调节多种细胞生命活动。本研究旨在探究ENO1作为RBP在hESCs自我更新能力调节过程中发挥的作用,探讨其在转录后水平对RNA的调控及潜在的作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞系及质粒载体:H1 hESC细胞系(中国医学科学院血液学研究所赠送);人胚肾细胞系HEK-293T(北京协和医学院基础学院细胞中心);pLKO.1质粒、pSPAX2质粒和pMD2G质粒(Origene公司)。
1.1.2 主要试剂: Matrigel(Corning公司); mTeSR1、ReLeSR和Accutase(StemCell公司); DMEM/F12(Gibco公司);限制性核酸内切酶AgeⅠ、EcoRⅠ,10×T4 DNA ligase (NEB公司);Neofect(北京码音科技有限公司);Opti-MEM无血清培养基(ThermoFisher公司);AP染色试剂盒(Millipore公司);Trizol、M-MLV 反转录试剂盒(Invitrogen公司);SYBR green mix(全式金生物科技有限公司); 多能分化基因 qPCR 引物(天一辉远生物科技公司);抗ENO1抗体、抗 β-actin抗体(Proteintech公司),山羊抗兔二抗(上海碧云天生物有限公司);FISH试剂盒:RNAscope Fluorescent Multiplex Kit、polyA+ RNA 探针(ACD公司)。
1.2 方法
1.2.1 hESCs的体外培养:取解冻后按照说明书定量分装的Matrigel,使用6 mL冷DMEM/F12稀释,摇匀后按1 mL/孔的量加入6孔板中,4 ℃静置过夜,待凝胶凝固后放入孵箱中使其升温至37 ℃后接种hESCs。每孔使用2 mL预热至37 ℃的mTeSR1培养,每4~6 d传代1次: 使用平衡至室温的DPBS清洗细胞,每孔加入1 mL ReLeSR,室温静置1 min,弃去。将细胞放至37 ℃孵箱中静置7 min。用预热至37 ℃的mTeSR1将已消化下来的细胞重悬,加入新的培养皿中。
1.2.2 shRNA载体的构建:登录shRNA干扰片段在线设计网站http://rnaidesigner.thermofisher.com/rnaiexpress/,在相应窗口中输入ENO1的序列,设计相对应的shRNA(序列:5′-CGTACCGCTTCCTTAG AACTT-3′),并在设计好的shRNA序列两端添加AgeⅠ、EcoRⅠ酶切位点黏性末端序列,交由天一辉远生物科技有限公司合成。将合成的片段95 ℃退火,将退火后得到的产物片段与线性化处理的pLKO.1载体连接。
1.2.3 慢病毒的包装及感染hESCs:使用HEK-293T细胞进行慢病毒包装,在10 cm细胞培养皿中培养293T细胞使其汇合达到60%~80%,开始转染。转染:取500 μL Opti-MEM无血清培养基,加入4.5 μg pSPAX2骨架质粒、1.5 μg pMD2G骨架质粒及6 μg目的质粒,轻弹混匀,室温静置5 min,加入12 μL Neofect,轻弹混匀,室温静置30 min,逐滴滴入293T细胞培养皿中,48 h后收取含有病毒的上清液。病毒浓缩:吸取含有病毒的上清液,使用0.45 μm滤膜过滤,45 000×g离心3 h后使用mTeSR1稀释。将稀释后的病毒逐滴加入含hESCs的培养皿中,并加入终浓度为5 g/L的polybrene,于孵箱中37 ℃、 5% CO2培养48 h。
1.2.4 蛋白质印迹法(Western blot)检测细胞中蛋白表达: 收集细胞,提取蛋白,将对照组和实验组定量后进行SDS-PAGE电泳,电泳条件为恒定电压值120 V。电泳结束后,利用湿转法,在电流恒定为260 mA的条件下将蛋白样品转移至PVDF膜上,使用5%脱脂牛奶室温孵育PVDF膜 1 h,加入稀释后的兔源抗体,4 ℃ 摇床孵育过夜。第2日,洗膜15 min,加入稀释后的山羊抗兔二抗,室温孵育1 h,洗膜15 min,用化学发光法显影。
1.2.5 克隆形成能力检测及碱性磷酸酶(alkaline phosphatase, AP)染色: 在6孔板中按照每孔8×103个单细胞接种hESCs,于正常条件下培养6 d,进行AP染色:每孔加入2 mL 4%多聚甲醛,室温静置3 min,弃去4%多聚甲醛,清洗1次,将试剂盒中的试剂按照说明书所示比例混合,每孔加入1 mL混合液,室温避光静置30 min,弃去混合液,清洗1次,置于镜下观察并拍照。
1.2.6 实时荧光定量PCR(RT-qPCR)检测RNA表达水平:收集细胞沉淀,使用Trizol法提取total RNA,检测A260/A230值和浓度值。取等质量RNA,使用M-MLV反转录试剂盒进行反转录,得到cDNA后进行qPCR。按照说明书配置反应体系,该体系总体积10 μL,每个样品设置3个复孔,反应程序:94 ℃ 10 s,58 ℃ 10 s,72 ℃ 20 s,循环40次。本实验所需引物序列(表1)。

表1 RT-qPCR引物Table 1 Primer sequences for RT-qPCR
1.2.7 RNA荧光原位杂交(fluorescence in situ hy-bridization,FISH)技术: 实验前4~16 h将细胞种在盖玻片上,使其完全贴壁,弃去培养基,加入适量PBS,清洗后弃去,加入4%多聚甲醛,室温静置30 min,PBS清洗3次,依次加入50%乙醇、70%乙醇、无水乙醇静置后弃去,使细胞梯度脱水。滴加蛋白酶A使其覆盖载玻片,室温静置10 min以通透细胞,滴加RNA探针约50 μL,在湿盒中40 ℃孵育2 h,弃去。清洗载玻片,依次滴加AMP1、AMP2、AMP3、AMP4,每次孵育条件均为40 ℃,15 min。孵育结束后清洗盖玻片,滴加含DAPI的封片剂约70 μL,轻轻盖上盖玻片,防止产生气泡,并涂抹指甲油固定,置于-20 ℃避光保存。次日用Leica显微镜DM6B拍照,使用CellProfiler 4.2.5软件进行荧光信号统计。
1.2.8 分子结合预测所用网站:蛋白质与RNA结合网络预测网址为:http://rnact.crg.eu;蛋白质结合网络预测网址为:www.hitpredict.org及https://cn.string-db.org/。
1.3 统计学分析

2 结果
2.1 ENO1与参与hESCs多能性与分化相关信号通路的RNA结合
与ENO1结合的RNA功能包括参与对Wnt信号通路的调控、MAPK级联反应的调控、与Akt通路相关的对丝氨酸/苏氨酸激酶活性的调控以及发育过程等(图1)。在过往研究中发现,ENO1结合RNA后影响糖酵解过程,抑制mESCs的分化[6]。基于以上结果,推测ENO1对hESCs命运决定可能具有潜在调控作用。
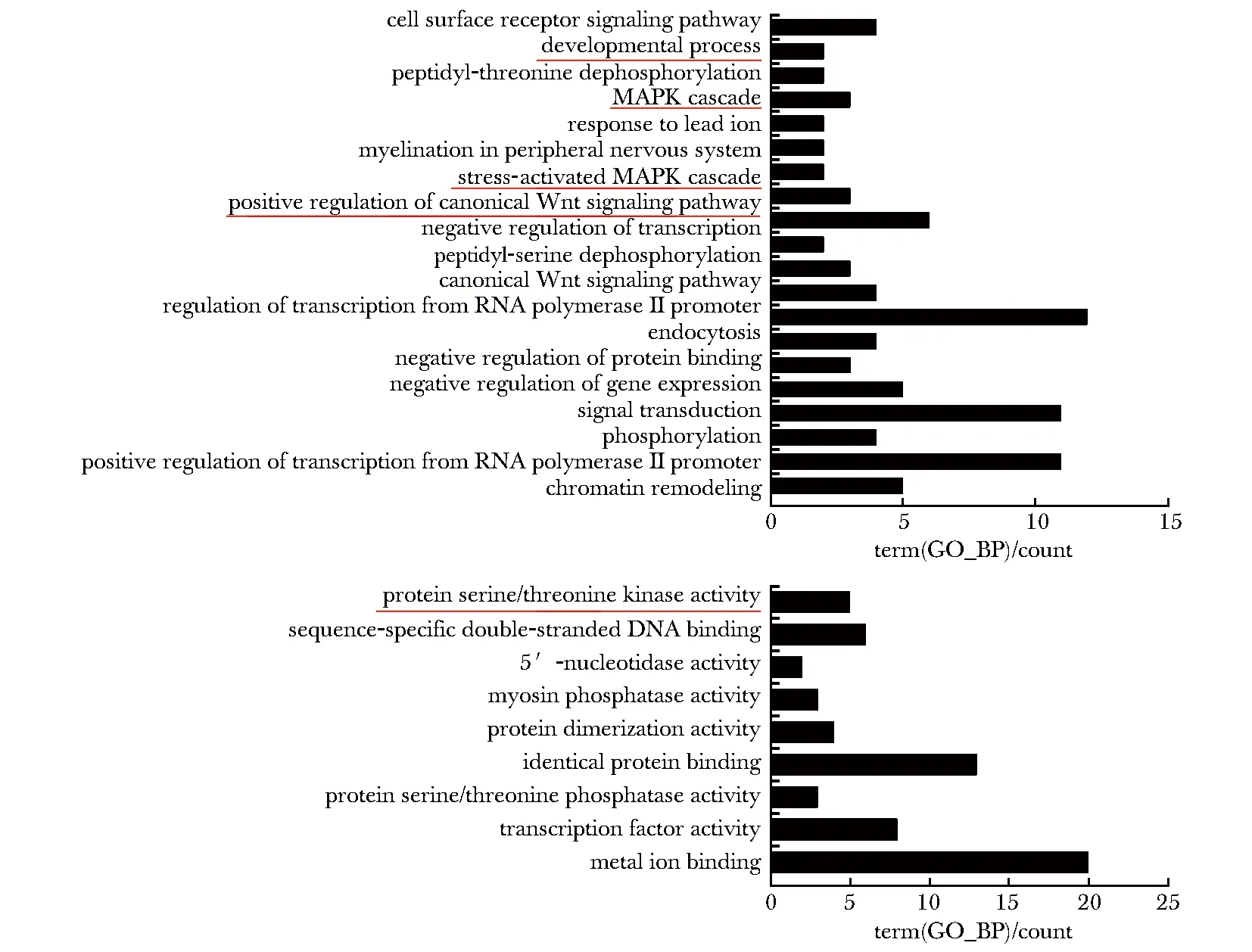
图1 结合ENO1的RNA参与hESCs命运决定的相关信号通路Fig 1 RNA binding to ENO1 regulates signaling pathways involved in hESCs’ fate determination
2.2 抑制内源ENO1表达使hESCs自我更新能力下调
shRNA能够显著抑制ENO1蛋白的表达(图2A),使用此条shRNA进行后续功能实验。ENO1表达下调导致hESCs 细胞克隆体积显著变小、形状趋于不规则且细胞状态变差(图2B),hESCs克隆形成能力降低(P<0.05)(图2C)。同时,分化标志基因在RNA水平的表达显著上调(P<0.001),但多能性标志基因的表达大部分仅有微弱的变化(图2D)。

A.Western blot showed ENO1 protein expression in ENO1 shRNA treated cells, detecting the efficiency of knocking down ENO1; B.cell clone morphology was observed under microscope, showing the volume of cell clone and the number of dead cells; C.AP staining of shNC and ENO1 shRNA treated cells maintained under hESC culture conditions and colony formation assay,the data represent the means±SD(n=3, from biological repeats); *P<0.05 compared with shNC; D.relative expression of pluripotent marker genes (OCT4, SOX2, NANOG, GATA1) and differentiation marker genes (HAND1, GATA2, BRACHYURY, GATA3) determined by RT-qPCR after ENO1 inhibition, **P<0.01, ***P<0.001 compared with shNC.图2 ENO1对hESC自我更新与分化的影响Fig 2 Effect of ENO1 on self-renewal and differentiation of n=3)
2.3 抑制内源ENO1表达减弱poly(A)+ RNA的出核能力
抑制内源ENO1表达后,通过RNA荧光原位杂交观察poly(A)+RNA的定位,在阴性对照组hESCs中,poly(A)+RNA的核质分布无明显差异,但当ENO1表达受到抑制后,poly(A)+RNA在细胞质中分布减少,在细胞核内出现明显的信号聚集(图3A),核质信号比增大(P<0.01)(图3B)。

A.FISH staining of poly(A)+RNA in shNC and shENO1 treated hESC cells, the poly(A)+RNA signal decreases in the cytoplasm, but increases in the nucleus with ENO1 inhibition; B.fluorescence signals of 29 cells in the negative control group and 30 cells in the ENO1 knockdown group; *P<0.01 compared with shNC.图3 ENO1对mRNA出核能力的影响Fig 3 Effect of ENO1 on mRNA n=3)

A.the 50 proteins that bind ENO1 the most in the protein binding prediction network; B.ENO1 binds proteins with various functions, including multiple items related to RNA metabolism, such as RNA splicing and regulation of mRNA stability, cell differentiation, proliferation and other functional regulation related to stem cell life activities.图4 ENO1结合蛋白网络及其功能预测Fig 4 ENO1 interacting protein network and its function prediction
2.4 ENO1与参与RNA代谢的蛋白质结合
与ENO1相结合的蛋白功能多样,包括多条与RNA代谢相关的条目,如RNA剪接、对mRNA稳定性的调控等;同时也参与细胞分化、增殖等与干细胞生命活动相关的功能调控。在细胞组分层面,部分蛋白功能与核周区域、核斑点区域密切相关。
3 讨论
本研究通过抑制ENO1内源表达并检测hESCs的自我更新能力及poly(A)+ RNA的核质分布,探究了ENO1对hESCs自我更新能力的影响和可能的机制。结果表明抑制ENO1的表达能够在细胞水平和分子水平上下调hESCs的自我更新能力,促使其分化,并影响了hESCs中poly(A)+ RNA的细胞定位, 减弱其出核能力。这一发现既揭示了ENO1作为非经典RBP发挥功能的新机制,也为探究转录后调控过程对hESCs多能性的影响提供了新思路。
ENO1作为一种代谢酶,近年来已被指出其在常规代谢活动之外,发挥着其他重要作用。2022年,Huppertz等人在HeLa细胞系中证明ENO1可以作为RBP结合RNA,并倾向于结合编码调控RNA生命过程相关蛋白质的RNA。该团队同时在mESCs中对ENO1进行了编辑,发现高度乙酰化后的ENO1表现出更强的RNA结合能力,同时酶活降低,阻滞了mESCs中正常的糖酵解过程,使mESCs分化受阻[6]。以上研究表现出ENO1结合RNA后对干细胞自我更新能力的调控,本文的发现则进一步提示ENO1对干细胞自我更新能力的影响存在新机制,值得后续进行深入研究。
hESCs调控其多能性的网络十分复杂,已发表文献中证明,调控hESCs自我更新的信号通路主要包括Wnt信号通路、MAPK信号通路和PI3K-Akt信号通路等[7-8],相关转录因子包括Oct4、Sox2、Nanog等[9-11]。与ENO1结合的RNA的功能多次涉及以上通路,暗示了ENO1对hESCs的多能性潜在的调控能力。在对ENO1结合的蛋白的预测中,ENO1可能与hnRNPA2B1相结合,hnRNPA2B1作为核内不均一核糖核蛋白家族成员,可结合RNA并在新生前体mRNA(pre-mRNA)加工、mRNA出核等RNA代谢过程中发挥重要作用[12],ENO1可能通过结合hnRNPA2B1完成与其相互作用的RNA的转运。在hESCs中,虽然下调ENO1内源表达不影响多能性标志基因在RNA水平的表达,但是本实验室前期研究已经发现,ENO1在hESCs中与核孔复合物有较强的结合,且敲低ENO1后mRNA出核明显受阻,可以推测ENO1可能通过阻止相关mRNA的出核影响其翻译和发挥后续作用;同时,ENO1可以通过抑制分化标志基因的表达进一步保持hESCs的自我更新能力。另外,考虑到ENO1在糖酵解中发挥的作用,也不能完全排除其表达被抑制后,代谢过程的变化也对hESCs的生命活动造成了一定的影响。总之,ENO1对hESCs命运选择性的调控可能是多角度、多层级的,也是重要的、关键的,其具体机制有待人们进一步探究。
