TPX2的表达对胰腺癌预后的影响
2023-06-05苏靓誉张振西杜文静
苏靓誉,张振西,杜文静,2*
1.中国医学科学院基础医学研究所 北京协和医学院基础学院 细胞生物学系 医学分子生物学国家重点实验室,北京 100005;2.山西医科大学 基础医学院 细胞生理学教育部重点实验室,山西 太原 030606
胰腺癌在中国是致死人数第六的恶性肿瘤,由于其早期病情隐匿,超80%患者确诊时已处于晚期,并且有推测到2030年它将成为美国肿瘤患者死亡的第二大原因[1]。目前无论是手术还是药物治疗的效果都不尽如人意,因此寻求胰腺癌的早期诊断手段及更有效的治疗方法迫在眉睫。
Xklp2靶蛋白(targeting protein for Xenopus kinesin-like protein 2,TPX2)是一种微管相关蛋白[2]。有研究发现,TPX2调控胶质瘤细胞的增殖、凋亡和有氧糖酵解[3],作为一个糖酵解相关基因,它还对前列腺癌[4]、结直肠癌[5]等肿瘤的发生发展有着极其重要的作用。而TPX2在胰腺癌的作用还未被系统分析。
Warburg效应是肿瘤细胞区别于正常组织细胞的代谢差异——即使在氧气充足的条件下也会偏向使用糖酵解作用来取代正常细胞的有氧循环[6],本研究的目标是探索糖酵解在胰腺癌的发生发展中发挥关键作用的基因,从而对其诊疗发挥作用。本研究对胰腺癌患者的糖酵解代谢特征进行综合评价,发现胰腺癌患者存在显著的代谢差异,高速率糖酵解代谢队列预后较差。基于高、低代谢亚群的差异表达基因,发现关键预后基因TPX2,经综合分析发现TPX2的高表达与胰腺癌的发展及不良预后相关, TPX2有望成为胰腺癌预后预测的潜在标志性基因。
1 材料与方法
1.1 材料
1.1.1 数据来源:原始数据均从TCGA(https://cancergenome.nih.gov/)和GEO数据库(https://www.ncbi.nlm.nih.gov/GEO/)下载。200个糖酵解相关基因从MSigDB数据库[GSEA/MSigDB(gsea-msigdb.org)]下载。
1.1.2 细胞系:Bxpc-3人原位胰腺癌细胞系(中国医学科学院基础医学研究所细胞资源中心)。
1.1.3 主要试剂:干扰RNA(small interfering RNA, siRNA)(上海吉玛制药技术有限公司): TPX2#1:5′-GCCUUUCAACCUGUCCCAATT-3;TPX2#2:5′-GGAGCUCGAGAAAUUGCAATT-3′;1640培养基(北京细工生物科技有限公司); 胎牛血清(fetal bovine serum, FBS)(Hyclone公司);Lipofectamine RNAiMAX转染试剂(Invitrogen公司)。
1.2 方法
1.2.1 预后相关hub基因的探索:基于TCGA-PAAD数据集样本的RNA-seq数据,利用MSigDB数据库下载的“HALLMARK_GLYCOLYSIS” 糖酵解代谢特征的包含200个基因的基因集,基于GSVA算法进行富集评分,根据分数的高低,样本被分为3组,得分前25%的为up组,最后25%的down组及余下中间水平50%的zz组。随后使用R包“Survminer”V0.4.9和“Survival”V3.2-13进行Kaplan-Meier分析和对数等级检验(P<0.05)比较两组患者的总生存期(overall survival, OS)。R中的“Limma”包v3.48.3被用来分析up组和down组的差异基因表达,筛选差异表达基因的标准包括|log2(FC)|>1和FDR<0.05。分析的结果用R中的“ggplot2”v3.3.5程序包绘制成火山图。差异基因通过GO功能富集分析和KEGG通路分析,结果可视化用R包“clusterProfiler” v4.0.5和“enrichplot” v1.12.2(P<0.05,q<0.05)。采用单因素Cox回归分析(显著水平:P<0.05)评估胰腺癌患者中差异基因的表达水平与OS的相关性,使用R中的“glmnet”软件包v4.1-2进行最小绝对收缩和选择算子(Lasso)回归分析,以避免过度拟合。多因素Cox回归分析(显著性水平:P<0.05),确定差异基因与OS的相关性。
1.2.2 TPX2的表达与预后分析:GEPIA数据库(http://gepia2.cancer-pku.cn/analysis)用于比较TPX2在胰腺癌及对应正常组织中的表达及其预后价值。GEPIA数据库是一个在线网站,其分析的肿瘤和正常组织数据来自TCGA数据库。使用GEPIA数据库探索TPX2的表达与胰腺癌患者的OS,在GEPIA数据库中,TPX2表达的中位数被用作分组的分界值。Kaplan-Meier绘图通过自动计算最佳分界值来对组进行分类。The Human Protein Atlas数据库(https://www.proteinatlas.org/)用于比较TPX2在胰腺癌及正常组织中的免疫组化染色数据。
1.2.3 细胞的培养与转染:细胞培养使用1640培养基+10%FBS,在5% CO2的培养箱中37 ℃培养。按照说明书使用Lipofectamine RNAiMAX转染试剂转染siRNA到细胞中。
1.2.4 细胞计数实验:细胞转染siRNA 48 h后,重新接种4×104/孔的细胞于24孔板,加入500 μL的 1640完全培养基,每24 h取每组3个重复进行细胞计数,计数7 d细胞数据即可绘制细胞曲线。
1.2.5 集落形成实验:细胞转染siRNA 48 h后,重新接种800个/孔的细胞于6孔板,加入2 mL完全培养基,培养7天后甲醇固定细胞15 min,0.05%结晶紫染色15 min,蒸馏水洗净后拍照。
1.2.6 CCK8检测细胞增殖:细胞转染siRNA 48 h后,重新接种于96孔板,每孔5×103个细胞,1640完全培养基体积100 μL,每组5个复孔,37 ℃、5% CO2培养24 h后弃去培养基,每孔加入10 μL CCK8和90 μL 1640完全培养基,另取3个无细胞并加入等量试剂和培养基作为空白对照孔,培养箱中静置2 h后检测,随后更换为完全培养基继续培养,并于48 h、72 h重复检测。
1.3 统计学分析

2 结果
2.1 糖酵解相关基因评分的分组分析
3个分组生存分析结果显示down组相较于up组和zz组患者的预后显著改善,up组的总体存活率较低(图1A)。主成分分析(PCA analysis)表明不同的评分分组在维度上存在明显差异(图1B);热图显示基因表达存在显著差异,并且大多数基因上调存在于up组中(图1C)。以上结果证明分组合理,组间存在差异。
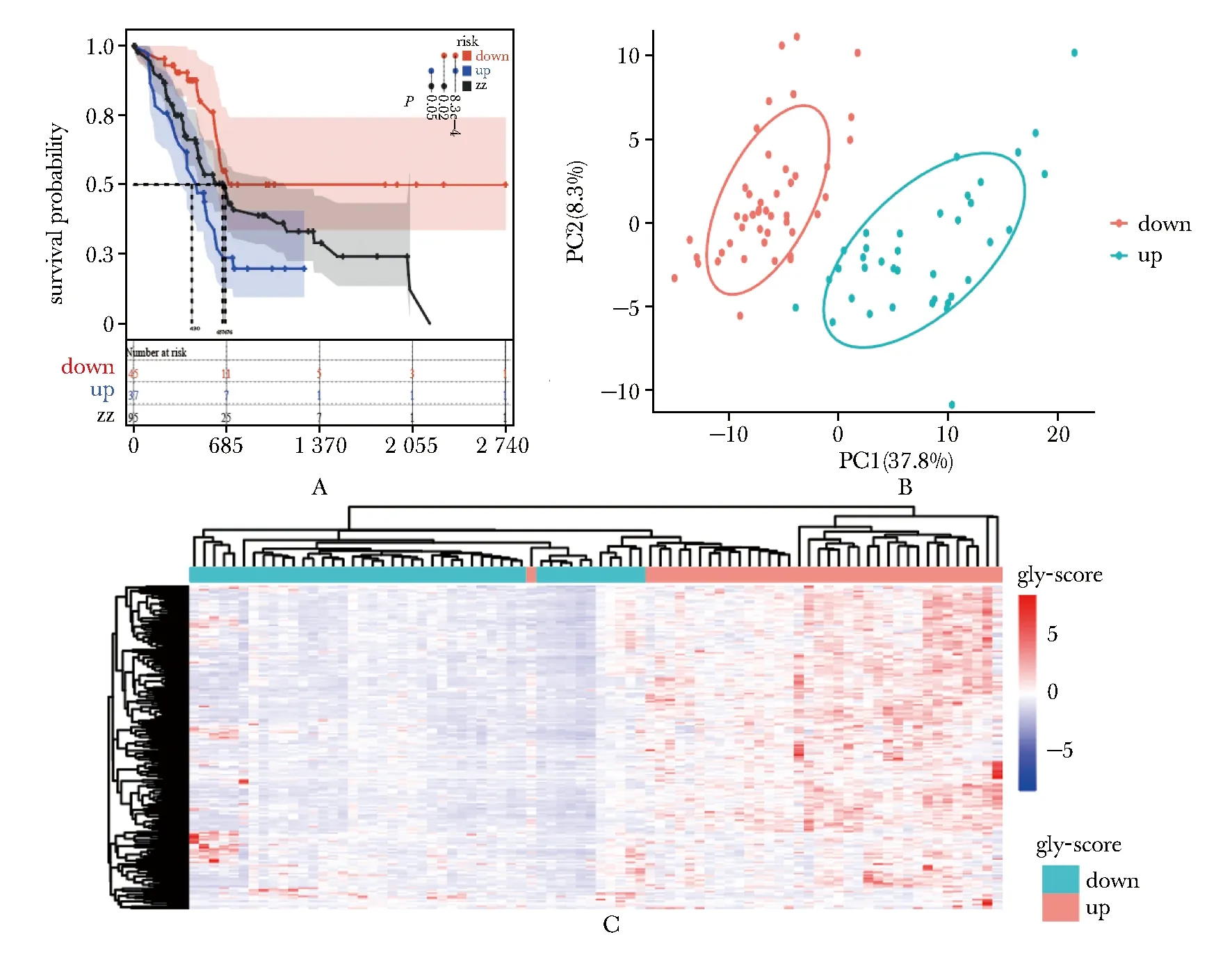
A.survival analysis of three different score groups in patients with pancreatic ductal carcinoma (PAAD) from TCGA; B.PCA of transcriptome spectrum in high and low score groups; C.visual heat map of gene expression level in two groups.图1 糖酵解基因集的富集分群Fig 1 Accumulation and clustering of glycolysis genes
2.2 差异基因的富集分析
糖酵解得分分组之间生存期存在显著差异,为确定引起差异的基因, 分析up组和down组的基因表达数据(图2A),这些差异基因(DEGs)可能是影响胰腺癌预后的关键基因。通过差异基因GO富集分析发现,差异基因主要富集在膜电位调节、神经突触相关以及细胞信号转导相关生物过程(图2B)。KEGG分析显示,这些DEGs主要涉及MAPK信号通路等信号转导相关途径(图2C)。

A.volcanic map of differentially expressed genes (P<0.05, q< 0.05); B.GO enrichment analysis of differential genes (P<0.05, q< 0.05); C.enrichment analysis of differential genes by KEGG pathway(P<0.05,q< 0.05).图2 差异基因富集分析Fig 2 Differential gene enrichment analysis
2.3 风险模型的开发和验证
基于最小似然偏差对识别出的差异基因进行Lasso回归分析(图 3A),5个基因(ANLN、TPX2等)的组合获得了最佳性能(图3B),多变量Cox分析进一步显示,其中两个基因(ANLN、TPX2)对于PAAD患者的生存具有独立的预测作用(图3C)。

A.the trend chart of lasso coefficients of differential genes in univariate Cox regression analysis; B.λ is obtained through the combination of at least five genes; C.multivariate Cox analysis of the screened genes showed that both genes were possible risk factors; D.survival analysis of low risk and high risk groups in TCGA data set; E.ROC curve for predicting prognosis in TCGA data set; F.survival analysis of low-risk and high-risk groups in GEO validation data sets; G.GEO validates the ROC curve for predicting prognosis in the data set.图3 风险模型的构建和验证Fig 3 Development and verification of risk model
本研究重点分析TPX2,根据风险模型中风险得分的中位数,将TCGA数据库和GEO数据库中PAAD患者分别分为低风险组和高风险组。Kaplan-Meier曲线显示,无论是TCGA队列(图3D)还是GEO队列(图3E),低风险组比高风险组患者具有显著的生存优势。TCGA(图3F)和GEO(图3G)队列预测1、3、5年生存期的ROC曲线下面积(AUC)分别为0.812、0.743、0.765和0.619、0.752、0.887,该模型在预测PAAD患者总体生存期方面具有良好的性能。
2.4 胰腺癌中TPX2的表达水平及预后
对比TPX2在正常组织和肿瘤组织的表达水平,GEPIA数据库分析的结果显示TPX2在PAAD中的表达显著高于相对应的正常组织,而 TPX2低表达患者组预后显著良好(图4A,B)。The Human Protein Atlas数据库的免疫组化数据进一步验证,胰腺癌肿瘤组织中TPX2的表达水平确实显著高于正常胰腺组织(图 4C,D)。
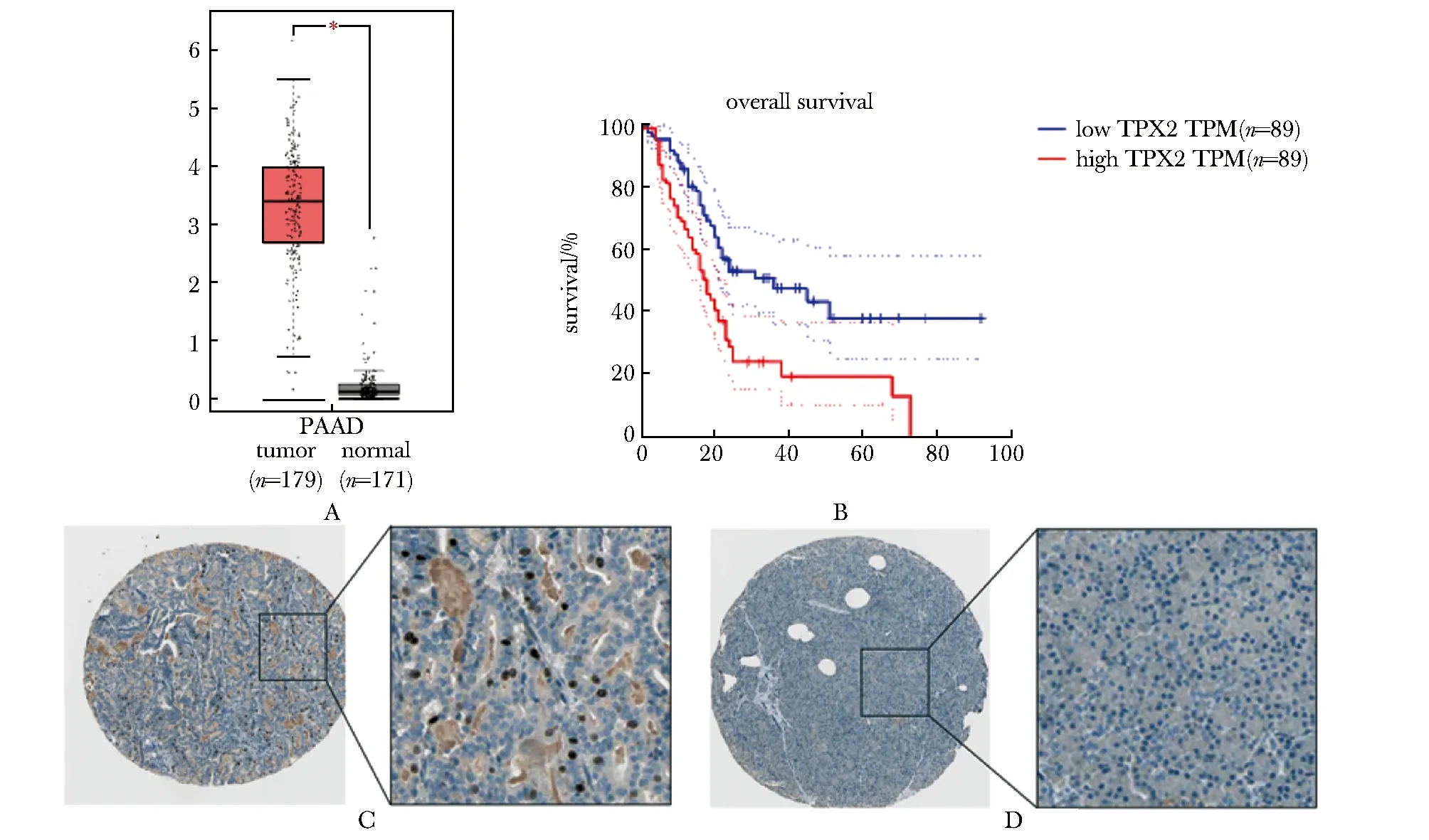
A.expression of TPX2 in normal and tumor tissues, *P<0.05 compared with normal group; B.OS of PAAD patients with high and low TPX2 expression; C,D.immunohistochemistry of pancreatic tumors (C) and corresponding normal tissues(D).图4 胰腺癌中TPX2的表达及预后Fig 4 Expression and prognosis of TPX2 in pancreatic carcinoma
2.5 TPX2影响胰腺癌细胞增殖和糖酵解代谢
细胞水平实验结果显示siTPX2组的 CCK-8、克隆形成及细胞计数相比对照组细胞增殖活性显著降低(图5A~C);细胞增殖相关的基因CDK1、CDK2、CCNE1等的表达水平也随之降低(图5D)。qPCR检测糖酵解代谢关键酶基因, siTPX2组中PKM2、PFKM、PGAM1等基因也显著下调(图5E)。
3 讨论
本研究为TPX2提供了新的见解——可能成为胰腺癌患者生存和预后的潜在标志物,有望成为胰腺癌新的诊疗靶点。本研究构建的风险模型表明TPX2是胰腺癌的预后因素,此外TPX2的下调减少了胰腺癌细胞在体外的增殖,同时还减弱了胰腺癌细胞的有氧糖酵解。
TPX2作为一种微管蛋白,在有丝分裂纺锤体形成的过程中发挥重要的作用[7],TPX2在多种人类肿瘤中呈高表达,其被证明可以增强多种肿瘤的恶性特征。例如,TPX2促进了人乳腺癌细胞的迁移和侵袭[8];在神经母细胞瘤中,TPX2被发现促进了肿瘤的增殖且可作为其预后标志[9];目前还未有研究评估TPX2表达与胰腺癌的关系,本研究发现TPX2与胰腺癌预后、细胞增殖及相关基因以及糖酵解相关基因相关。胰腺癌微环境与肿瘤细胞之间存在复杂的代谢相互作用,有研究表明,大多数与有氧糖酵解相关的酶在胰腺在未发生病变时低表达,而在原发及转移肿瘤中高表达,说明胰腺癌对糖酵解有一定的依赖性[10]。在本研究中,敲降TPX2后,糖酵解相关基因的表达下调,细胞增殖相关指标也发生了下降,推测TPX2可能通过影响胰腺癌细胞的糖酵解代谢,从而影响细胞增殖,但这一点尚需进一步研究。随着TPX2在胰腺癌调控机制的深入研究,TPX2有望成为胰腺癌诊疗的新靶点。
