沉默Fcgr3降低SiO2诱导的小鼠肺泡巨噬细胞系MH-S炎性因子表达
2023-06-05李晓娜齐先梅张田甜
李晓娜,齐先梅,张田甜,王 婧
中国医学科学院基础医学研究所 北京协和医学院基础学院 病理生理学系,北京 100005
硅沉着病是由长期吸入大量有害粉尘引起的以弥漫性肺纤维化为特征的疾病。硅沉着病造成肺功能低下、炎性反应、最终导致呼吸衰竭[1-2]。目前缺乏有效的治疗药物,因此探究硅沉着病的治疗靶点已迫在眉睫。SiO2通过呼吸道进入肺泡,肺泡巨噬细胞吞噬SiO2,最终导致大量炎性因子被释放,主要为肿瘤坏死因子(TNF-α)、白介素1β(IL-1β)和白介素6(IL-6),促进纤维化[1,3]。FcγRⅢ是Fcgr3基因编码的一种膜蛋白,是免疫球蛋白G的受体之一,具有增强摄取、吞噬融合、激活免疫和调节细胞因子的生理功能。在巨噬细胞中,FcγRⅢ对大肠杆菌的吞噬起到了关键的作用,由此影响机体炎性水平[4]。目前,Fcgr3在SiO2吞噬过程中的作用仍未见报道,探究参与吞噬SiO2的受体将有利于新的治疗靶点的发现。
1 材料与方法
1.1 材料
1.1.1 细胞:人胚肾细胞系293T(实验室保存),小鼠肺泡巨噬细胞系MH-S(普诺赛公司)。
1.1.2 试剂:质粒pLKO.1(实验室保存),Opti-MEM 培养基和胎牛血清(Gibco公司),Lipofactamine 2000和FcγRⅢ抗体(Invitrogen公司),高糖DMEM培养基和青链霉素(索莱宝公司),MH-S细胞专用培养基(普诺赛公司),ELISA试剂盒(R&D公司),反转录试剂盒(天根公司),晶体SiO2(Forsman Scientific公司)。
1.2 方法
1.2.1 慢病毒沉默质粒的构建:选择用于shRNA表达的慢病毒载体pLKO.1-shRNA,其图谱如下(图1):pLKO.1-shNC为阴性对照质粒,psPAX2和pMD2.G为包装质粒。
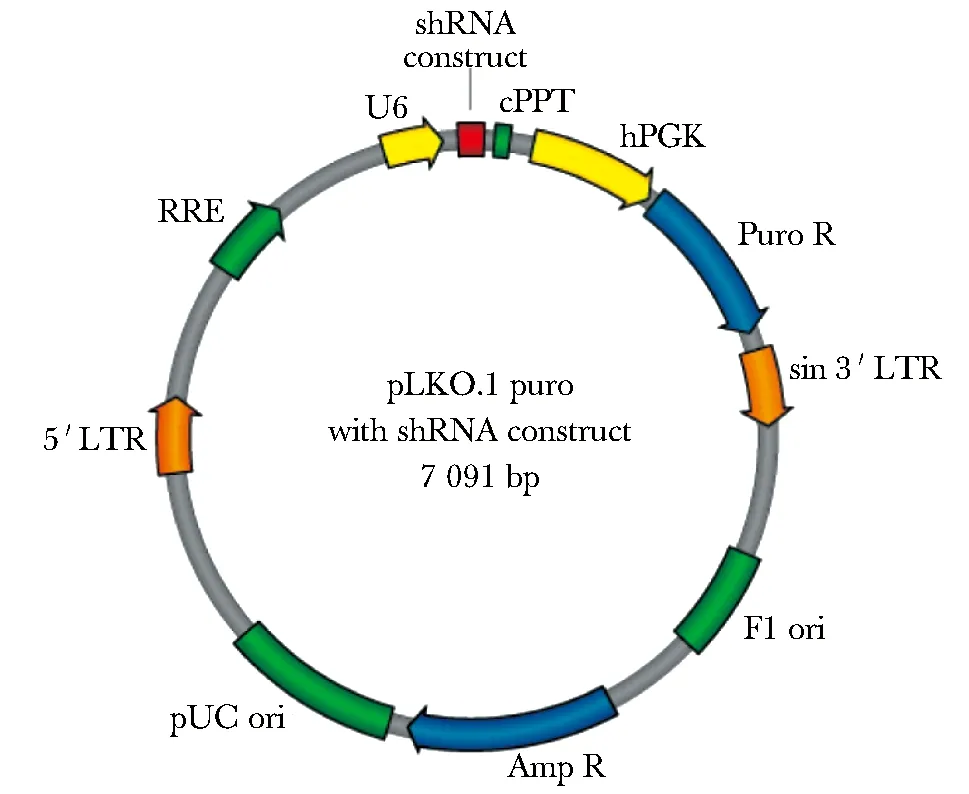
图1 pLKO.1-shRNA质粒图Fig 1 Map of pLKO.1 containing a shRNA insert
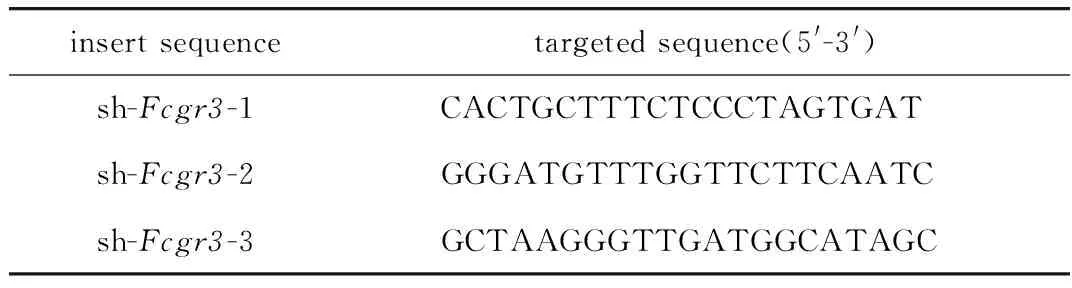
表1 Fcgr3 shRNA序列Table 1 Sequence of Fcgr3 shRNA
1.2.2 慢病毒的包装:将细胞分为4组:对照组(pLKO-shNCshRNA)与FcγRⅢ沉默组(pLKO-Fcgr3shRNA1、pLKO-Fcgr3shRNA2、pLKO-Fcgr3shRNA3)。在FcγRⅢ沉默组中,将pLKO-Fcgr3shRNA1/pLKO-Fcgr3shRNA2/pLKO-Fcgr3shRNA3、psPAX2、pMD2.G各10 μg加入1.5 mL培养基opti-MEM中,同时将25 μL Lipofactamine 2000加入到1.5 mL培养基opti-MEM中,分别室温孵育5 min后,将质粒混合液与Lipofactamine 2000混合液混匀,室温孵育20 min。滴加入无抗生素的含10%血清的细胞培养基中。6 h后更换含有10%血清的DMEM高糖培养基10 mL,24 h后第一次收取细胞上清即病毒液,0.22 μm滤器过滤后-80 ℃冰箱保存。培养皿加入新的完全培养基10 mL,48 h后第2次收取细胞上清即病毒液,0.22 μm滤器过滤后-80 ℃冰箱保存。60 h后第3次收取细胞上清即病毒液,0.22 μm滤器过滤后-80 ℃冰箱保存。
1.2.3 稳定细胞系的建立:将MH-S细胞接种在6孔板中,每孔接种细胞数为5×103个。贴壁12 h后,吸弃培养液,加入2 mL病毒稀释液(病毒∶完全培养基=1∶1),5 μL Polybrene辅助病毒感染细胞,12 h后,吸弃培养液。上述步骤重复两次。加入含2 μg/mL 嘌呤霉素的完全培养基筛选细胞,筛选1周后收集细胞,提取RNA及蛋白质进行检测。
1.2.4 MH-S的分组及处理:将稳定细胞系分为MH-S+sh-NC、MH-S+SiO2+sh-NC、MH-S+sh-Fcgr3和MH-S+SiO2+sh-Fcgr3组。以每孔5×105个细胞接种在6孔板中。贴壁12 h后,吸弃培养液,加入含或不含浓度为100 mg/L SiO2的MH-S专用培养基,共2 mL。连续刺激12 h后,收集细胞上清-20 ℃保存,收集细胞-80 ℃保存。
1.2.5 qPCR检测Fcgr3沉默效率及炎性因子转录水平:细胞经Trizol法提取RNA,反转录为cDNA,设计相应引物,进行PCR实验,分析熔解曲线,通过2-ΔΔCt计算mRNA相对表达水平,比较Fcgr3沉默效率及沉默前后炎性因子的表达。
1.2.6 蛋白免疫印迹法(Western blot)检测Fcgr3沉默效率:提取sh-NC、sh-Fcgr3-1、sh-Fcgr3-2和sh-Fcgr3-3处理的细胞的蛋白。在蛋白液中加入载样缓冲液,将不同样品调整为相同浓度和体积,置于-20 ℃保存。蛋白上样量为20 μg,电泳条件为80 V/30 min、120 V/90 min。电转条件为260 mA/90 min。5%脱脂牛奶封闭1 h,一抗于4 ℃条件下孵育18 h,TBST清洗后,用二抗于室温孵育1 h,TBST清洗后,加入化学发光液曝光,使用化学发光仪拍照,Image J分析吸光值。
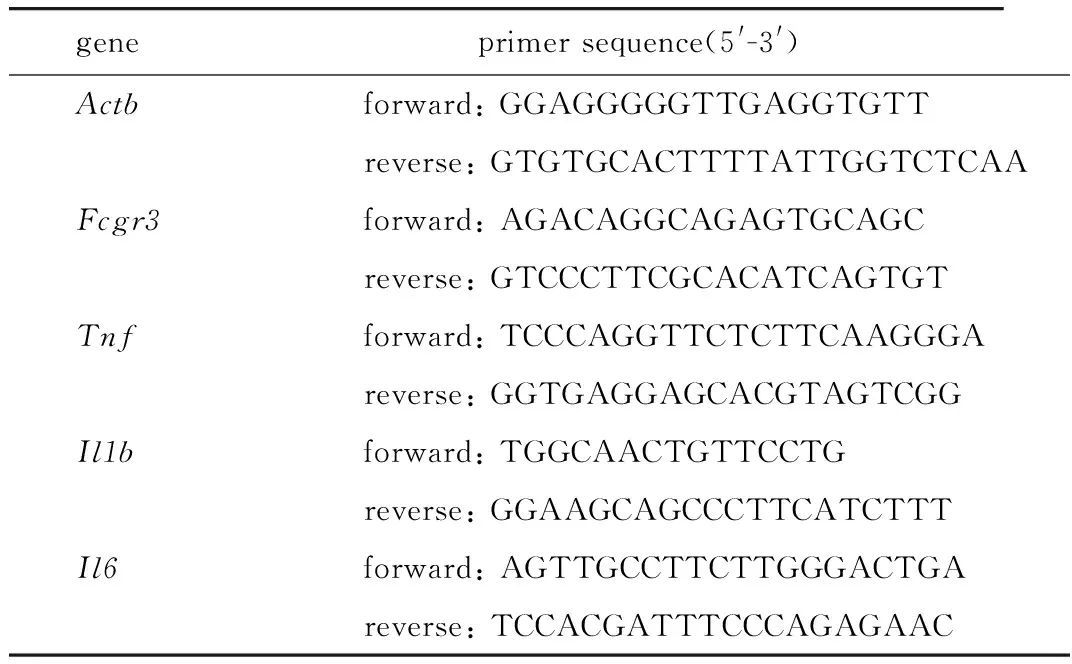
表2 PCR引物序列Table 2 PCR primer sequences
1.2.7 ELISA测定炎性因子表达:收集的细胞上清,常温条件下,800 r/min离心5 min,吸取上清。使用ELISA试剂盒测定炎性因子的含量。
1.3 统计学分析

2 结果
2.1 shRNA能够显著沉默MH-S细胞中的Fcgr3
与对照组相比,在shRNA病毒处理的细胞中,shRNA沉默细胞的Fcgr3转录水平和蛋白水平均改变,其中sh-Fcgr3-3的沉默效率最高(P<0.05)(图2),后续将使用sh-Fcgr3-3稳定表达的细胞系进行实验。
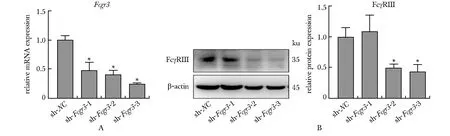
A.mRNA expression of Fcgr3 in MH-S cells; B.protein expression of FcγRⅢ in MH-S cells; *P<0.05 compared with the sh-NC group.图2 MH-S细胞 Fcgr3沉默效率的检测Fig 2 Silencing efficiency validation of Fcgr3 in MH-S cells n=3)
2.2 沉默Fcgr3减少SiO2诱导的MH-S细胞炎性因子mRNA的表达
与MH-S+sh-NC组相比, MH-S+SiO2+sh-NC组细胞的Tnf、Il1b和Il6的mRNA水平明显升高(P<0.05)(图3);而与MH-S+SiO2+sh-NC组相比,MH-S+SiO2+sh-Fcgr3组细胞的Tnf、Il1b和Il6的mRNA水平显著降低(P<0.05)(图3)。

*P<0.05 compared with the MH-S+sh-NC group; #P<0.05 compared with the MH-S+SiO2+sh-NC group.图3 qPCR检测炎性因子的mRNA水平Fig 3 The mRNA levels of inflammatory factors were measured by qPCR n=3)
2.3 沉默Fcgr3减少SiO2刺激的MH-S细胞培养上清中炎性因子的含量
与MH-S+sh-NC组相比, MH-S+SiO2+sh-NC组细胞培养上清中TNF-α和IL-6的表达水平明显升高(P<0.05,图4);而与MH-S+SiO2+sh-NC组相比,MH-S+SiO2+sh-Fcgr3组细胞培养上清中TNF-α和IL-6的表达水平显著下降(P<0.05)(图4)。

*P<0.05 compared with the MH-S+sh-NC group; #P<0.05 compared with the MH-S+SiO2+sh-NC group.图4 ELISA法检测细胞培养上清中炎性因子的含量Fig 4 The inflammatory factors contents in cell culture supernatants were measured by n=3)
3 讨论
FcγRⅢ在结构上分为胞外区、胞膜区和胞质区。其胞质区含有免疫受体酪氨酸激活基序,当受体与其配体结合后,其酪氨酸被磷酸化,招募其他蛋白激酶或衔接蛋白,进一步向细胞内传导信号促进吞噬和炎性因子表达[5]。炎性反应及炎性因子在矽肺纤维化中发挥着重要的作用,肺泡巨噬细胞吞噬SiO2后,诱导巨噬细胞产生TNF-α、IL-1β和IL-6[6-8]。TNF-α和IL-1β促进胶原沉积,而IL-6则与单核细胞、中性粒细胞的浸润有关[9-10]。FcγRⅢ是否可以参与巨噬细胞SiO2的吞噬介导TNF-α、IL-1β和IL-6的表达,目前没有明确的研究报道。有研究表明,巨噬细胞上的FcγRⅢ可以通过募集SYT同源磷酸酶-1(SHP-1),抑制下游磷脂酰肌醇三羟基激酶(PI3K)的磷酸化,抑制具有胶原结构的巨噬细胞受体(MACRO)对大肠杆菌的吞噬,最后导致大肠杆菌清除受影响,使得机体炎性反应增强[4]。亦有研究表明,v-maf肌肉腱膜纤维肉瘤癌基因同源物B(MafB)可以通过上调FcγRⅢ促进巨噬细胞系RAW264.7的吞噬功能[11]。
本研究发现沉默巨噬细胞系Fcgr3后能够显著降低炎性因子TNF-α、IL-1β和IL-6的产生,与以往研究报道的FcγRⅢ的促炎作用相一致[12],巨噬细胞释放的IL-1β较少,浓度较低不在检测范围内,结果未在本文中显示。既往研究证实清道夫受体家族蛋白参与了巨噬细胞对SiO2的吞噬过程,包括MARCO、清道夫受体(SR-A1)、清道夫受体(SR-B1)和清道夫受体(CD36)。MARCO和CD36的激活与FcγRⅢ的下游蛋白的激活同时发生,包括脾酪氨酸激酶(SYK)、PI3K和SH2结构域肌醇磷酸酶(SHIP1),且抑制FcγRⅢ下游蛋白的磷酸化,如PI3K和SYK,可显著抑制清道夫受体的吞噬作用[13-14]。结合先前的研究与本文的结果,推测FcγRⅢ可能通过与清道夫受体家族蛋白协同作用,介导下游信号传导过程,参与巨噬细胞系对SiO2的吞噬过程,进而影响炎性因子的产生,具体的协同机制仍需要更进一步的探索。
综上所述,本研究表明FcγRⅢ促进了SiO2刺激的炎性因子的产生,有望作为硅沉着病治疗的潜在靶点。
