基于IL-6/JAK/STAT3 信号通路探讨大黄灵仙方缓解胆管细胞炎性反应的作用机制
2023-06-05庞浇安陈伟棠刘春丽肖丽君滕金豪叶桂源李乘积甘苡榕
庞浇安,俞 渊 ,陈伟棠,杨 文,刘春丽,肖丽君,滕金豪,叶桂源,李乘积,甘苡榕
(广西中医药大学第一附属医院,广西 南宁 530200)
原发性肝内胆管结石(hepatolithiasis,HL)又称为肝胆管结石,是我国常见的难治性良性胆道疾病,好发于左右肝管汇合处,以胆色素结石最为常见[1]。其发病隐匿,病变复杂,术后残石复发率高且疾病末期具有癌变可能,严重危害着人们的身体健康。流行病学显示,HL 的发病率逐年上升,约占胆石类疾病的30%。该病具有明显的地域性,在中国华南、长江流域及东南沿海地区尤为多见,东南亚地区的发病率约为20%[2],明显高于全球其它地区。目前,HL 以外科手术治疗为主,但由于术后创伤性和患者自身致病因素尚未消除等原因,导致术后结石的复发率颇高[3]。因此,探索针对其机制的有效防治措施是现今亟需解决的难题。
肝胆管结石的病因复杂多样,结石的形成及复发与胆道感染、胆管炎、胆汁淤积、胆汁代谢和胆道解剖结构异常等因素相关[4]。胆道感染是诱发胆管细胞炎症反应的首要危险因素,而反复慢性胆管细胞炎症反应是HL 形成的关键病理环节[4]。当胆道感染时将使胆管细胞产生致炎因子,易造成胆道发生炎性狭窄和梗阻,导致胆囊收缩功能异常,胆汁引流不畅并呈过度饱和状态,淤积于内成石。同时,继发的结石亦会损伤胆道壁,诱导胆管壁发生病理性重塑以及启动纤维化进程和加重胆道狭窄使得感染和炎症再次交互扩大反应。在这种长期相互刺激的恶性循环下可能是导致HL 根治困难的原因之一。由此可见,从源头缓解或抑制胆道感染,下调胆管细胞炎症反应,是预防HL 形成的主要思路之一。
相关文献报道,IL‐6/JAK/STAT3 信号通路的异常活化将诱导相关炎症因子产生炎症瀑布反应,导致机体发生细胞炎性损伤[5],对于该通路的研究多集中在肠道炎症、关节炎、皮肤病、心肺损伤、癌症等疾病,而在HL 形成过程中的调控作用尚未见报 道[6,7]。因 此,探 寻 HL 新 的 治 疗 手 段 尤 为 重 要。课题组前期已证实,大黄灵仙方通过干预TLR4/NF‐κB/MAPK 信号通路可下调信号轴中的炎症因子的表达,缓解胆管细胞炎症反应,但其具体分子机制尚未完全阐明[8]。为进一步完善大黄灵仙方修复胆管细胞炎性损伤的作用机制,本课题通过LPS构建胆管炎症大鼠模型,探究大黄灵仙方对IL‐6/JAK/STAT3 信号通路的表达影响,为后期深入研究HL 的中医学治疗提供理论学依据。
1 材料与方法
1.1 实验动物与实验分组
1.1.1 实验动物 健康雄性SD 大鼠50 只(SPF级),鼠龄8~12 周,体质量:160~200 g。购于湖南斯莱克景达实验动物有限公司,实验动物合格证书SCXK(湘)2019‐0004。饲养于广西中医药大学动物房,饲养环境的室温和湿度分别维持在(20~24℃、45%~55%)。实验方案经广西中医药大学实验动物伦理委员会审批并同意通过(批准号DW20220321‐180)。
1.1.2 动物分组 健康雄性SD 大鼠50 只(SPF级),随机分为 5 组,每组10 只。分别为空白组、模型组、胆宁片组、大黄灵仙方低浓度组、大黄灵仙方高浓度组。本课题均在广西中医药大学仙葫校区6楼动物房进行饲养、造模、取材等操作。
1.2 实验药物与试剂
大黄灵仙方(生大黄15 g、批号19110323,威灵仙30 g、批号19100653,黄芪30 g、批号19091713,金 钱 草30 g、批 号19091523,泽 兰15 g、批 号19091823,柴胡12 g、批号19120613,郁金12 g、批号19120413,枳壳12 g、批号19110333,鸡内金12 g、批号19110373,磁石10 g、批号19091943,芒硝10 g、批号18122053,炙甘草5 g、批号1911103),上述药材均使用颗粒剂,由江阴天江药业有限公司提供。胆宁片(购于上海和黄药业有限公司,批号051003)、内毒素脂多糖(LPS)、白介素‐6(IL‐6)、Ja‐nus 蛋白酪氨酸激酶 2(JAK2)、信号转导和转录活化因子 3(STAT3)蛋白抗体(均购于北京索莱宝,批号:L8880、KK002264、P009385P),超氧化物歧化酶(SOD)、丙二醛(MDA)、谷草转氨酶(AST)以及谷丙转氨酶(ALT)测试盒(均购于南京建成,批号:A001‐3‐2、A003‐1、C010‐2‐1、C009‐2‐1),白 介 素‐6(IL‐6 )、Janus 蛋白酪氨酸激酶 2(JAK2)ELISA 试剂盒(均购于酶免公司,批号:MM‐0190R1、RA20823),5×Tris‐甘氨酸电泳液、4×SDS‐PAGE分离胶缓冲液、10×电泳转移缓冲液(转膜液)、BCA 蛋白浓度测定试剂盒(均购于索莱宝公司,批号 分 别 为:T1070‐500 mL、P1022‐500、D1060‐500 mL、PC0020)
1.3 造模与给药
模型的构建参考文献[9]:在胆总管一次性注射1.25 mg/kg LPS 以构建肝内胆管炎症大鼠模型。参照《药理实验方法学》[10]中人与大鼠体表面积换算的计算公式,最终确定大鼠的大黄灵仙方给药剂量为2.4 g/kg 并将其作为大黄灵仙方低浓度组,大黄灵仙方高浓度组给药剂量为4.8 g/kg、胆宁片组为0.5 g/kg。模型组第1 d 在胆总管注射 LPS 以构建肝内胆管炎症大鼠模型,第2~8 天继续予蒸馏水灌胃(2 次/d,灌胃量为2 mL/100 g)。胆宁片组、大黄灵仙方低、高浓度组于第1 d 在胆总管注射 LPS以构建肝内胆管炎症大鼠模型,第2~8 天开始予相应浓度的胆宁片和大黄灵仙方灌胃给药(2 次/d,灌胃量为2 mL/100 g)。空白组第2~8 天予蒸馏水灌胃(2 次/d,灌胃量为2 mL/100 g)。所有大鼠均在第8 d 灌胃结束后(在造模和干预期间无死亡),禁食、禁水12 h,随后无菌操作下取材。
1.4 标本采集及方法
大鼠术前12 h 禁食、禁水,使用浓度为3%异氟烷呼吸麻醉大鼠,进行腹部备皮、固定四肢、腹部消毒,置于无菌手术台上在剑突下作竖行切口,腹主动脉采血,静置采血管,随后取血清,进行相关生化指标检测。拨开大鼠肠道,经下腔静脉注射肝素进行全身肝素化预热,待肝脏呈土黄色时,揭开肝叶,暴露胆管,将肝脏和胆管分离,无菌剪剪取胆管和肝门处肝脏组织,随后在无菌盒中用毛刷轻微剔除肝门组织中的肝实质组织,仅留下胆管树,将胆管和胆管树迅速分装于冻存管中,用于Western Blot、PCR 检测。取肝右叶不同部位的肝脏2 块,约 0.5 cm×0.5 cm×0.5 cm 大小,将其浸泡于4% 组织固定液中,进行肝脏HE 病理学检测。
1.5 观察指标及方法
1.5.1 肝脏组织病理学检测 肝脏组织固定、脱水、包埋后,将蜡块切成0.3~0.5 μm 厚的切片,经二甲苯脱蜡、梯度酒精脱水后,予HE 染色,中性树胶封片,光学显微镜下观察肝门和胆管树组织的病理性改变。
1.5.2 肝功能、氧化应激指标检测 大鼠麻醉后腹主动脉穿刺采血,将全血标本在室温下静置4 h,离心机中离心后取上清装于1.5 mL EP 管。严格按照试剂说明书操作,检测大鼠血清中AST、ALT、MDA 活性、SOD 的表达量。
1.5.3 ELISA 检测血清中IL-6、JAK2、STAT3的含量 于−80℃中冰箱取出各组大鼠血清,室温下解冻40 min,未见血清中含有冰晶体后,按照试剂盒说明书操作,检测血清中IL‐6、JAK2 以及STAT3的含量。
1.5.4 RT‐qPCR 技 术 检 测 IL‐6、JAK2、STAT3 mRNA 表达情况 (1)引物合成。根据基因序列设计引物,采用 Primer 5.0 软件设计。见表1。

表1 RT-qPCR 引物序列Tab 1 Primer sequence of RT-qPCR
(2)检 测 方 法。方 法 采 用Solarbio 公 司TriQuick Reagent 总RNA 提取试剂进行,于超微量紫外线光度仪分析RNA 浓度、纯度及完整性,提取质量:OD260/OD280应在1.8~2.0 之间;根据浓度按照逆转录试剂盒将 RNA 进行逆转录从而获得 cD‐NA;依据荧光定量 PCR 反应条件进行扩增反应,检测IL-6、JAK2、STAT3mRNA 表达量,最终采用2‐△△Ct 计算。
1.5.5 Western Blot 技术检测IL‐6、JAK2、STAT3蛋白表达水平 剪取等体积胆管树组织放入1 mL细胞裂解液的EP 管中研磨,待组织完全裂解且肉眼下未见明显纤维组织,置于4 ℃离心机中离心,使用1 000 μL 移液枪取上清液,采用 BCA 法上机检测蛋白浓度。制备电泳凝胶,配置转印缓冲液后电泳分离蛋白,将蛋白电转移至 PVDF 膜上,5% 脱脂奶粉封闭 PVDF 膜1 h,严格按照说明书将IL‐6、JAK2、STAT3 一抗与一抗稀释液配置,4℃孵育过夜。回收一抗,TBST 洗膜3 次,室温下将PVDF 膜加入到二抗孵育液中1 h,丢弃二抗,TBST 洗PVDF 膜3 次,每次5 min。超敏 ECL 化学发光底物在凝胶成像系统中进行检测,Image J 软件计算各组蛋白条带与GAPDH 的灰度值比值。
1.6 统计学分析
使用统计软件GraphPad Prism 9.0 进行数据统计分析,计量资料符合正态分布用(±s)表示,多组间比较采用单因素方差分析,符合正态分布,采用两两比较,若方差齐采用最小显著性差异法(LSD)多重比较法,若方差不齐则采用 Dunnett’sT3 法,P<0.05 为差异具有统计学意义。
2 实验结果
2.1 各组大鼠肝脏组织的病理情况
研究结果显示,空白组的肝脏组织被膜和中央静脉内皮完整,肝细胞围绕中央静脉呈放射状排列,形态正常;肝窦与门管区小叶间动、静脉及小叶间胆管结构较为完结构正常,未见明显淤血和炎性细胞浸润以及纤维组织增生扩张。模型组的肝窦结构被破坏,见淤血扩张及炎性浸润,门管区小叶间胆管周围存在炎性细胞浸润,以杆状核或分叶核的中性粒细胞为主。胆宁片组的肝小叶分叶不明显,胆管周围的肝窦内轻微炎性细胞浸润,以核圆形深染的淋巴细胞为主。而大黄灵仙方低、高浓度组明显好转,肝窦结构趋于正常,未见明显淤血及炎性浸润;门管区小叶间动、静脉及小叶间胆管结构恢复良好,周围未见明显病变。见图1。

图1 各组大鼠肝组织的病理情况(HE 染色,200×)Fig 1 Pathological conditions of rat liver tissues in each group(HE,200×)
2.2 大黄灵仙方对大鼠血清中的肝功能的影响
与空白组相比,模型组血清中ALT、AST 表达水平均有不同程度升高(P<0.05)。与模型组相比,胆宁片组和大黄灵仙方低、高浓度组血清中ALT、AST 表达水平均有不同程度降低(P<0.05)。与胆宁片组对比,大黄灵仙方低、高浓度组血清中ALT、AST 表达水平均有不同程度降低(P<0.05)。表2及图2。

图2 大黄灵仙方对胆管炎症大鼠的肝功能指标的影响Fig 2 Effect of Dahuang Lingxian formula on liver function indexes in rats with bile duct inflammation
表2 大黄灵仙方对胆管炎症大鼠的肝功能指标的影响(U/L,n=10 ,±s )Tab 2 Effect of Dahuang Lingxian formula on liver function indexes in rats with bile duct inflammation(U/L,n=10 ,±s )
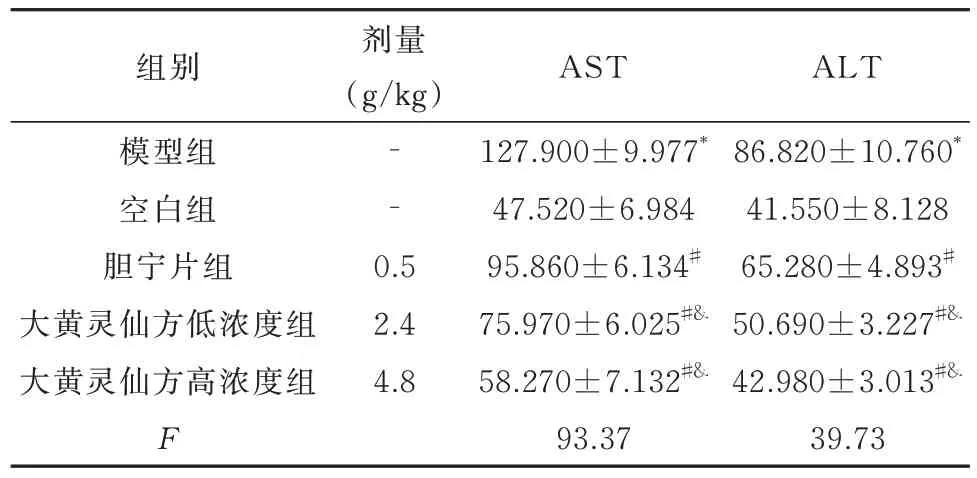
表2 大黄灵仙方对胆管炎症大鼠的肝功能指标的影响(U/L,n=10 ,±s )Tab 2 Effect of Dahuang Lingxian formula on liver function indexes in rats with bile duct inflammation(U/L,n=10 ,±s )
注:与空白组比较 *P<0.05;与模型组组比较 #P<0.05;与胆宁片组比较 &P<0.05。
剂量(g/kg)ALT 86.820±10.760*41.550±8.128 65.280±4.893#50.690±3.227#&42.980±3.013#&39.73组别模型组空白组胆宁片组大黄灵仙方低浓度组大黄灵仙方高浓度组F‐‐0.5 2.4 4.8 AST 127.900±9.977*47.520±6.984 95.860±6.134#75.970±6.025#&58.270±7.132#&93.37
2.3 大黄灵仙方对大鼠血清中氧化应激反应影响
与空白组相比,模型组血清中MDA 表达水平均有不同程度升高,SOD 表达水平降低(P<0.05)。与模型组相比,胆宁片组和大黄灵仙方低、高浓度组血清中MDA 表达水平均有不同程度降低,SOD表达水平升高(P<0.05)。与胆宁片组对比,大黄灵仙方低、高浓度组血清中MDA 表达水平均有不同程度降低,SOD 表达水平升高(P<0.05)。见表3及图3。

图3 大黄灵仙方对大鼠血清中氧化应激反应影响Fig 3 Effect of Dahuang Lingxian Formula on oxidative stress in rat serum
表3 大黄灵仙方对大鼠血清中氧化应激反应影响(U/mL,n=10 ,±s )Tab 3 Effect of Dahuang Lingxian Formula on oxidative stress in rat serum(U/mL,n=10 ,±s )

表3 大黄灵仙方对大鼠血清中氧化应激反应影响(U/mL,n=10 ,±s )Tab 3 Effect of Dahuang Lingxian Formula on oxidative stress in rat serum(U/mL,n=10 ,±s )
注:与空白组比较 *P<0.05;与模型组比较 #P<0.05;与胆宁片组比较 &P<0.05。
剂量(g/kg)MDA 11.79±0.98*3.63±1.08 9.38±0.28#7.32±0.53#&5.45±0.38#&96.65组别模型组空白组胆宁片组大黄灵仙方低浓度组大黄灵仙方高浓度组F‐‐0.5 2.4 4.8 SOD 82.83±6.83*114.00±0.70 93.16±1.01#100.10±1.63#&107.90±0.86#&72.56
2.4 大 黄 灵 仙 方 对 大 鼠 血 清 中IL‐6、JAK2、STAT3 炎症因子的影响
与空白组相比,模型组血清中IL‐6、JAK2、STAT3 表达水平均有不同程度升高(P<0.05)。与模型组相比,胆宁片组和大黄灵仙方低、高浓度组血清中IL‐6、JAK2、STAT3 表达水平均有不同程度降低(P<0.05)。与胆宁片组对比,大黄灵仙方低、高浓度组血清中IL‐6、JAK2、STAT3 表达水平均有不同程度降低(P<0.05)。见表4 及图4。

图4 大黄灵仙方对大鼠血清中IL‐6、JAK2、STAT3 炎症因子影响Fig 4 Effects of Dahuang Lingxian Formula on IL-6,JAK2 and STAT3 inflammatory factors in rat serum
表4 大黄灵仙方对大鼠血清中IL-6、JAK2、STAT3 炎症因子影响(n=10,±s)Tab 4 Effects of Dahuang Lingxian Formula on IL-6,JAK2 and STAT3 inflammatory factors in rat serum(n=10,±s )

表4 大黄灵仙方对大鼠血清中IL-6、JAK2、STAT3 炎症因子影响(n=10,±s)Tab 4 Effects of Dahuang Lingxian Formula on IL-6,JAK2 and STAT3 inflammatory factors in rat serum(n=10,±s )
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与胆宁片组比较,&P<0.05。
剂量(g/kg)组别模型组空白组胆宁片组大黄灵仙方低浓度组大黄灵仙方高浓度组F STAT3(ng/mL)15.44±1.05*2.51±0.27 10.87±2.24#6.17±1.31#&3.06±0.17#&94.37‐‐0.5 2.4 4.8 IL‐6(pg/mL)29.45±3.89*4.59±0.90 21.25±1.31#13.57±1.80#&8.35±0.33#&118.7 JAK2(ng/mL)1.91±0.23*0.35±0.01 0.97±0.11#0.68±0.05#&0.43±0.03#&135.1
2.5 大黄灵仙方对IL‐6、JAK2、STAT3mRNA 表达的影响
与 空 白 组 相 比,模 型 组IL-6、JAK2、STAT3mRNA 表达水平均有不同程度升高(P<0.05)。与模型组相比,大黄灵仙方低、高浓度IL-6、JAK2、STAT3mRNA 表达水平均有不同程度降低(P<0.05)。与胆宁片组对比,大黄灵仙方低、高浓度组IL-6、JAK2、STAT3mRNA 表达水平均有不同程度降低,但仅有高浓度组IL-6、JAK2、STAT3mRNA(P<0.05)。见表5 及图5。

图5 大黄灵仙方对IL6、JAK2、STAT3mRNA 表达影响Fig 5 Effect of Dahuang Lingxian formula on IL6,JAK2,STAT3 mRNA expression
表5 大黄灵仙方对IL-6、JAK2、STAT3 mRNA 表达影响(n=10,±s)Tab 5 Effect of Dahuang Lingxian formula on IL6,JAK2,STAT3 mRNA expression(n=10,±s)

表5 大黄灵仙方对IL-6、JAK2、STAT3 mRNA 表达影响(n=10,±s)Tab 5 Effect of Dahuang Lingxian formula on IL6,JAK2,STAT3 mRNA expression(n=10,±s)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05;与胆宁片组比较,&P<0.05。
组别剂量(g/kg)IL-6 JAK2 STAT3模型组空白组胆宁片组大黄灵仙方低浓度组大黄灵仙方高浓度组F‐‐0.5 2.4 4.8 2.630±0.260*1.010±0.170 2.040±0.320#1.700±0.170#&1.380±0.177#&35.89 2.700±0.350*1.000±0.120 2.180±0.310#1.850±0.190#&1.480±0.150#&37.94 2.500±0.330*1.000±0.110 1.990±0.210#1.660±0.180#&1.360±0.151#&36.35
2.6 大黄灵仙方对IL‐6、JAK2、STAT3 蛋白表达的影响
与空白组相比,模型组IL‐6、JAK2、STAT3 蛋白表达水平均有不同程度升高(P<0.05)。与模型组相比,胆宁片组和大黄灵仙方低、高浓度IL‐6、JAK2、STAT3 蛋白表达水平均有不同程度降低,但仅有胆宁片组的STAT3、低浓度组的IL‐6、STAT3以及高浓度组的IL‐6、JAK2、STAT3 蛋白表达水平差异具有统计学意义(P<0.05)。与胆宁片组对比,大黄灵仙低、高浓度组IL‐6、JAK2、STAT3 蛋白表达水平均有不同程度降低,但仅有高浓度组差异具有统计学意义(P<0.05))。见表6 及图6。

图6 各组IL‐6、JAK2、STAT3 蛋白电泳图Fig 6 Electrophoresis of IL-6,JAK2 and STAT3 proteins in each group
表6 大黄灵仙方对IL6、JAK2、STAT3 蛋白表达影响(n=10,±s)Tab 6 Effect of Dahuang Lingxian Formula on IL6,JAK2,STAT3 protein expression (n=10,±s)

表6 大黄灵仙方对IL6、JAK2、STAT3 蛋白表达影响(n=10,±s)Tab 6 Effect of Dahuang Lingxian Formula on IL6,JAK2,STAT3 protein expression (n=10,±s)
注:与空白组比较, *P<0.05;与模型组比较, #P<0.05;与胆宁片组比较, &P<0.05。
STAT3 0.91±0.03*0.34±0.09 0.72±0.09#0.52±0.16#0.33±0.11#&26.9组别模型组空白组胆宁片组大黄灵仙方低浓度组大黄灵仙方高浓度组F剂量(g/kg)‐‐0.5 2.4 4.8 IL‐6 1.86±0.16*1.04±0.23 1.55±0.16#1.37±0.18#0.92±0.14#&22.40 JAK2 1.58±0.28*1.05±0.17 1.38±0.10 1.27±0.10#0.52±0.18#&24.55
3 讨论
肝脏是人体最大的实质器官,具有清除和促进毒素代谢、抗氧化等功能,然而肝脏容易受到体内外各种致病因素的侵扰而发生病理性损伤,HL 作为常见的难治性良性胆道疾病,一直是肝脏疾病中的研究热点。而中医药对肝胆疾病的治疗由来已久,许多临床实践和实验也证实了其在缓解炎症反应和改善血清学指标等方面具有确切的疗效。大黄灵仙方是唐乾利教授基于“胆病从肝论治”原则而创制的中药复方,该方以疏肝利胆、行气导滞为治疗原则,临床上常用于治疗胆道炎症、胆囊结石等一系列疾病。现代药理学证明:大黄、威灵仙可作用于肝脏的酶和蛋白,调节胆汁酸与肝脏脂质的平衡,增强胆囊收缩,减少胆汁淤积,抑制炎症反应[11],而柴胡中蕴含的皂苷、有机酸、挥发油等化学成分,可促进胆汁、胆固醇的分泌与排泄,枳实中的黄酮类,甘草中的甘草酸、甘草苷,金钱草中的酚性成分等均有疏肝利胆、消肿止痛、行气导滞等功效[12,13]。
胆道炎症的形成与感染互为因果,LPS 是诱发胆道感染的关键因素[14]。2015 年,Peers 等[15]发现,胆管感染以革兰氏阴性菌感染为主,经肝脏排入胆汁中的内毒素大部份仍保留 LPS 完整的分子结构,具有内毒素的生物特性。LPS 作用于细胞膜受体,通过细胞内信号传递级联使基因表达发生变化,介导内皮细胞、平滑肌细胞及单核巨噬细胞激活,诱导炎症因子合成和释放,从而引发胆道内慢性炎症。本研究通过构建胆管炎症大鼠模型并进行病理分析,结果显示,经LPS 干预后,模型组大鼠的肝窦和门管区小叶间胆管等结构均被破坏,周围存在炎性细胞浸润,与人类肝胆管结石的早期炎症病理表现相似,提示模型已成。而药物干预后,胆宁片组和大黄灵仙方低、高浓度组大鼠的肝窦和门管区小叶间动、静脉及小叶间胆管结构均恢复良好,周围炎性细胞显著减少,提示胆宁片、大黄灵仙方能有效调控胆管炎症状态且大黄灵仙方低、高浓度组抑制胆管炎症的作用优于胆宁片组,其作用与剂量呈正相关,以大黄灵仙方高浓度组的治疗效果最佳。
相关文献报道,慢性肝损伤和氧化应激反应与结石的形成紧密相关[17,18]。MA 和NGEE 等也证实了慢性肝损伤易引起胆汁代谢紊乱,胆汁酸和胆盐分泌比例失衡,胆固醇浓度及饱和指数急剧上升,导致氧自由基系统被激活,释放大量活性氧引发氧化应激反应,进而损伤胆囊收缩功能致使胆汁不能及时排出,淤积于内成石[19]。当肝细胞受到损伤时,微血管通透性会增加,细胞内大量的AST 和ALT 会进入血液中,导致肝脏血液灌注不足,影响肝细胞修复并进一步加重肝功能损伤,而受损的肝细胞继续分泌病理性胆汁并形成炎症的级联放大效 应,加 快 术 后 结 石 的 复 发[20]。2015 年,吕 立 升、Wang 等[21]进行相关实验发现,LPS 在诱发胆道感染基础上引起的慢性炎症亦会引起强烈的氧化应激反应,使得血液中SOD 抗氧化酶活性下降和MDA 膜脂过氧化程度升高,进一步侵害肝脏的清除能力,导致肝细胞缺乏氧气和营养,产生更多的氧自由基,利于钙盐晶体的聚集、成核和生长,加快成石的趋势。高洁等[22]发现,氧化应激反应的强弱与结石的形成呈正相关,通过抑制肾脏的氧化应激反应能够减缓草酸钙结石的形成。基于以上研究发现,慢性肝损伤和氧化应激反应是结石形成与复发的重要因素,两者之间相互影响加快成石趋势。因此,将血清中的ALT、AST、MDA、SOD 用于测定肝脏系统受损程度和氧化应激反应的标志物。本研究发现,经LPS 诱导的模型组大鼠血清中ALT、AST、MDA 显著高于空白组,SOD 低于空白组,提示大鼠胆管炎症模型造模成功。在经胆宁片和不同剂量的大黄灵仙方干预下,胆宁片组和大黄灵仙方低、高浓度组大鼠的ALT、AST、MDA 表达均下降,SOD 表达量上升,且大黄灵仙方低、高浓度组治疗效果优于胆宁片组。表明大黄灵仙方能有效调控胆管炎症状态,缓解肝功能损伤,减轻氧化应激反应,具有抗脂质过氧化以及保护肝胆管细胞的作用,可能是影响结石形成的作用机制之一。
信号通路的调控失常及相关因子基因的异常表达与炎症的发生存在关联,而药物治疗胆石症常从削弱炎症信号通路出发,通过减轻炎症反应减少结石形成[23]。Janus 激酶 (JAK)/信号转导和转录激活因子 (STAT)信号转导通路是一种进化上保守的通路,通过介导细胞因子、生长因子、干扰素(IFN)和肽激素等配体而被激活[24]。有研究发现,IL‐6/JAK2/STAT3 信号通路是调控炎症反应的重要代表通路之一,广泛参与细胞生殖、分化、凋亡、应激等病理过程。IL‐6 作为调节炎症反应的显著细胞因子,与其受体的胞外结构域结合,受体通过一系列构象变化和翻译后形成二聚体,在细胞质中与JAK2 产生特异性结合,引发磷酸化反应。而被激活的JAK2 进一步与下游效应因子信号转导和激活转录因子3(STAT3)结合发生磷酸化。磷酸化的STAT3 通过调节基因转录的方式,促进IL‐6、IL‐1β 以及IFN‐γ 和TNF‐α 等炎症因子的表达。同时,过度表达的炎症因子又推动JAK2/STAT3 的磷酸化进程,交互放大炎性反应[25]。顾浩等[26]发现,信号通路的活化与结石的复发紧密相关,术后予抗感染、消炎等措施可有效抑制IL‐6 炎症因子的释放,下调JAK/STAT3 信号通路的表达,降低术后结石的形成。本研究结果显示,与空白组相比,模型组的IL‐6、JAK2 及STAT3 蛋白表达和mRNA含量以及血清表达水平显著增高,提示该炎症信号通路可能被激活。经胆宁片和大黄灵仙方干预后,IL‐6、JAK2 及STAT3 蛋白表达和mRNA 含量以及血清表达量均不同程度降低,且大黄灵仙方低、高浓度组治疗效果优于胆宁片组,其作用呈剂量依赖关系,以大黄灵仙方高浓度组治疗效果最为显著。提示大黄灵仙方可能通过下调IL‐6/JAK2/STAT3信号通路的活化,减少炎症因子的释放,从而缓解胆管细胞炎症反应,可能是防治肝胆管结石的机制之一。
综上所述,大黄灵仙方可有效减缓LPS 诱导的大鼠胆管炎症反应,其机制可能与下调IL‐6/JAK2/STAT3 信号通路的活化有关。本研究结果初步阐释了大黄灵仙方干预胆管细胞炎症的作用机制,为后期降低HL 的形成及术后复发提供理论依据,但是该方是复方中药,具有多靶点、多途径的特征,其确切的抗胆管炎症的机制尚未完全阐明,后续对于具体分子机制以及相关信号通路之间的联系仍需进行基因靶点敲除或网络药理学等研究。
伦理学声明:本研究方案于2022 年03 月23 日经由广西中医药大学实验动物伦理委员会审批,批号:DW20220321‐180,符合实验室动物管理与使用准则。
作者贡献度说明:
庞浇安负责课题设计,资料分析,拟定写作思路,撰写论文;杨文参与资料分析,修改论文;陈伟棠,刘春丽,肖丽君,滕金豪,叶桂源,负责文献检索,收集数据及数据统计分析;俞渊负责指导撰写文章并最后定稿。
实验室依托:广西高校重点实验室‐中医临床研究重点实验室。
