人可溶性DSG2 胞外域蛋白的真核表达、纯化及活性鉴定
2023-06-05李晓月顾欣雨吴同鑫唐香平易永祥
陈 楠,李晓月,顾欣雨,吴同鑫,章 汝,李 云,唐香平,戴 劲,易永祥
(1.南京中医药大学附属南京医院,江苏 南京 210003;2.南京医科大学公共卫生学院,江苏 南京 211166)
桥粒芯蛋白(DSG2)蛋白是一种跨膜蛋白,其在组织中广泛表达,它的基因在染色体的18q12.1上[1]。DSG2 是经典钙黏着蛋白家族中的一员,它帮助调控细胞之间进行连接并促进桥粒装配[2]。桥粒涉及到细胞黏附连接,而黏附连接对肿瘤发生、发展又有重要影响,尤其对癌细胞迁移及侵袭有明显影响[3]。愈来愈多证据显示DSG2 参与了肿瘤发生、发展,如DSG2 就是评判卵巢癌预后最重要的生物 标 志 物 之 一[4]。DSG2 在EGFR/Src/PAK1 通 路中调节肺腺癌发生、发展,高表达也会使肿瘤对奥西美替尼耐药性增强[5,6]。研究发现,DSG2 过表达于人宫颈癌细胞中,并通过介导MAPK 通路活化对宫颈癌细胞恶性行为产生影响,敲除该基因后能抑制宫颈癌细胞增殖、迁移及侵袭[7]。此外,近年来DSG2 被认为是与人55 型腺病毒(HAdV‐55)结合的主要高亲和力受体[8]。HAdV‐55 感染可导致轻、重两种疾病,临床表现为高烧、咳嗽、喉咙痛、支气管炎和肺炎等症状,有时危及生命[9]。在2005 年新加坡军事训练营发生了HAdV‐55 感染爆发,226 人出现了急性呼吸道疾病[10];2015 年北京某培训基地12 名青少年因为HAdV‐55 感染出现了急性呼吸道症状[9];2016 年中国四川、云南和西藏军营三百多人由于HAdV‐55 感染出现急性呼吸道症状[11];2019年中国安徽一名患者因为HAdV‐55 感染而死亡[12]。HAdV‐55 已对公众造成了潜在威胁。
目前,尚无用于HAdV‐55 的预防疫苗或抗病毒药物。腺病毒纤毛蛋白在与其对应受体结合时介导腺病毒黏附靶细胞并引发胞吞作用以促进腺病毒进入细胞[13],这是腺病毒感染致病的第一步。针对病毒进入的抗病毒药物可以从源头上防止病毒感染细胞,而且还避免了细胞内药物输送,防止腺病毒与受体结合可以有效阻止病毒感染、细胞损伤和后续的细胞因子释放[14]。因此设计阻断腺病毒与宿主细胞的结合的抗腺病毒药物至关重要。鉴于DSG2 蛋白在肿瘤发生、发展和腺病毒感染研究中的重要性,如何高效获得DSG2 蛋白是研究其蛋白功能及开发抗腺病毒药物的关键。本研究通过PCR 扩增DSG2 胞外域片段基因(DSG2ex),在双酶切和T4 DNA 连接酶的作用下连接到真核表达质粒pCMV3‐IgG1 中,构建重组真核表达质粒pCMV3‐DSG2ex‐IgG1。将构建好的真核表达质粒转染入293T 细胞中外分泌表达DSG2胞外域蛋白,通过Protein A 纯化出高纯度且具有良好生物活性的可溶性DSG2 胞外域蛋白,建立一种简单高效的人可溶性DSG2 胞外域蛋白真核表达及纯化方法。一方面表达纯化的DSG2 胞外域融合蛋白可以用于后期蛋白功能的研究;另一方面表达纯化的DSG2 胞外域融合蛋白也可阻断HAdV55 腺病毒与其天然受体结合,为抗腺病毒药物的研究奠定了基础。
1 材料和方法
1.1 材料
1.1.1 质粒、细胞和蛋白 pCMV3‐IgG1 质粒(含有外分泌信号肽)、pCDNA4To‐DSG2 质粒、293T 细胞、CAR 胞 外 域 蛋 白 和HAdV‐55 腺 病 毒Fiber Knob 蛋白由本实验室保存,Top10 感受态细胞购自昂羽生物。
1.1.2 主要试剂及仪器 DMEM 培养基购自江苏凯基生物公司,胰蛋白酶‐EDTA (0.05%)含酚红,Opti‐MEM 培养基和Freestyle 293 培养基购自美国Gibco 公司,EZ Trans 细胞转染试剂(高效)购自上海李记生物有限公司,Super Red 核酸染料、Fast Blue 蛋白快速染色液购自南京普诺恩生物技术有限公司,无内毒素质粒大量快速提取试剂盒购自北京君诺德生物技术有限公司,琼脂糖凝胶DNA 回收试剂盒购自美基生物,PCR 产物纯化试剂盒购自Omega 公司,Pyrobest DNA 聚合酶,DL2000 Mark‐er、DL15000 Marker 和6×loading buffer 购 自Taka‐ra 公司,蛋白纯化仪、Protein A 柱子购自思拓凡公司,Anti‐Human IgG antibody 购 自Abcam 公 司,HRP Goat Anti‐Rabbit IgG(H+L)Antibody 购 自APExBIO 公司,50×TAE、氨苄青霉素溶液(100 mg/mL)购自索莱宝公司。辣根过氧化物酶标记山羊抗人IgG(H+L)、BCA 蛋白浓度测定试剂盒购自碧云天生物技术公司。
1.2 方法
1.2.1 引物设计与合成 在Uniprot 上查找人DSG2 胞外区的氨基酸序列(50‐609)(Uniprot ID:Q14126),然 后 再NCBI 上 找 到 对 应 的DNA 序 列(Gene ID:1829),根据DSG2 胞外区DNA 序列和pCMV3‐IgG1 质粒图谱上的多克隆位点AfeⅠ酶和BmtⅠ酶,使用Snapgene 软件设计出DSG2 胞外区上游引物和下游引物,上下游引物交由南京金斯瑞公司合成。
DSG2ex上 游 引 物:5′‐GCCGAGCGCT‐GCCTGGATCACCGCCCC‐3′
(下划线部分为AfeⅠ酶切位点)
DSG2ex下 游 引 物:5′‐ATCGGCTAGC‐GCCCACATAGGAGTCATGC‐3′
(下划线部分为BmtⅠ酶切位点)
1.2.2 真 核 表 达 载 体 的 构 建 以 pCD‐NA4To‐DSG2 质粒为模板、使用上下游引物,Py‐robest DNA 聚合酶通过PCR 扩增得到DSG2 胞外区片段,扩增条件:95 ℃ 5 min,98 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,共30 个循环,72 ℃终延伸2 min,冷却至12 ℃。使用AfeⅠ酶和BmtⅠ酶将pC‐MV3‐IgG1 载体和DSG2 胞外区片段双酶切之后,在T4 DNA 连接酶的作用下构建真核表达载体pC‐MV3‐DSG2ex‐IgG1(图1)。将 该 载 体 转 化 至Top10 感受态细胞中,37 ℃培养过夜,经氨苄抗性标记筛选得到的阳性克隆菌落PCR 鉴定之后,交由南京斯普金公司进行测序。利用SnapGene 和DNAMAN 软件对测序结果进行分析。
1.2.3 质粒的大量提取 取10 ng 重组质粒加入冰上融化的Top10 感受态细胞,冰上放置25 min、42 ℃热激45 s、冰上静置2 min 后,加入1 mL LB 液体培养基,在37 ℃恒温摇床上以200 r/min 摇晃1 h使其复苏;然后将菌液以5 000 r/min 在小型离心机上离心1 min,留100 μL 上清吹打混匀之后将其涂布在LB 固体培养板(含氨苄青霉素)上,37 ℃细菌恒温培养箱中静置过夜培养。挑取PCR 出目的片段的单克隆菌加入到含有5 mL LB 液体培养基的摇菌管中,再加入至5 μL 氨苄青霉素溶液,将摇菌管放在37 ℃的恒温摇床上以200 r/min 摇晃6~8 h,再以1∶1 000 的比例转接至150 mL 氨苄抗性(终浓度1%)的LB 液体培养基中在37 ℃的恒温摇床上以200 r/min 培养过夜,第二天收集菌液,12 000 r/min离心5 min,弃上清液,根据无内毒素质粒大量提取试剂盒说明书的要求提取质粒。
1.2.4 293T 细胞的转染 将293T 细胞接种于6 孔板中(5×105个/孔),置37 ℃,5% CO2培养箱中孵育12~16 h,使细胞密度在80%左右,按EZ Trans细胞转染试剂(高效)操作说明,将大量提取的质粒pCMV3‐DSG2ex‐IgG1 和EZ Trans 转染试剂以1∶3比例(推荐比例),3 μg 质粒和9 μL 转染试剂混合转染293T 细胞,6 h 后换成Freestyle 293 培养基,分别于转染后48 h、72 h 和96 h 收集培养上清。
1.2.5 表达产物检测 分别收集转染后48 h、72 h、96 h 和120 h 的上清,12 000 r/min,离心5 min 去除细胞碎片等杂质,取等量的48 h、72 h、96 h 和120 h上清放置在ELISA 板子中,用PBS(pH 7.4)稀释,每孔的量保持100 μL,4 ℃包被过夜。次日倒掉抗原,甩干,每孔加入200 μL PBS 在摇床上洗涤3 次,每孔加入250 μL 的5%脱脂奶粉‐PBST,37 ℃封闭1 h。每孔加入200 μL PBST,3 min/次,洗3 次。每孔 中 加 入100 μL 用5% 脱 脂 奶 粉‐PBST 稀 释 的HRP‐山羊抗人IgG 抗体(1∶250 稀释)37 ℃孵育1 h。每孔加入200 μL PBST,3 min/次,洗5 次。每孔加入100 μL 酶反应底物TMB,室温放置5~10 min(避光),每孔加入50 μL ELISA 终止液终止反应。将ELISA 板子放在酶标仪上在450 nm 波长处测定其OD450值。
1.2.6 DSG2 胞外域蛋白纯化 将293T 细胞接种于10 个10 cm 细胞培养皿中,置37 ℃,5%CO2培养箱中孵育12~16 h,使细胞密度在80%左右,按EZ Trans 细胞转染试剂(高效)操作说明,将大量提取的 质 粒pCMV3‐DSG2ex‐IgG1 和EZ Trans 转 染 试剂以1∶3 比例(推荐比例),12 μg 质粒和36 μL 转染试剂混合转染293T 细胞,6 h 后换成Freestyle 293培养基,于转染后96 h 收集细胞培养上清。将收集的细胞培养上清,于10 000 r/min,4 ℃离心15 min去除细胞碎片等杂质。将离心之后的上清再用0.45 μm 的滤膜过滤,将过滤之后的上清以2 mL/min 与HiTrap Protein A HP 5 mL 预装柱结合,用6倍柱体积的PBS 缓冲液(pH 7.4)洗涤预装柱,然后用3 倍柱体积的0.1 mol/L 柠檬酸缓冲液(pH 3.5)洗脱目的蛋白至含450 μL 1 mol/L Tris‐HCl 缓冲液(pH 9.0)的收集管中,根据洗脱出峰位置得到3管纯化产物,取20 μL 产物加5 μL 蛋白Loading buf‐fer,在100 ℃水浴锅中5 min 使其完全变性,用10%SDS‐PAGE 分析其纯度。
1.2.7 DSG2 胞外域蛋白的鉴定 将收集的3 管纯化产物经超滤管浓缩之后,用BCA 试剂盒测定其浓度,对浓缩产物进Western Blotting 分析,一抗为1∶10 000 稀释的兔Anti‐Human IgG antibody,二抗为1∶5 000 稀释的山羊抗兔IgG(H+L)HRP,特超敏ECL 化学发光显影。
1.2.8 DSG2 胞外域蛋白生物活性检测 蛋白包被:将纯化后的DSG2 胞外域蛋白以及CAR 胞外域蛋白按照400 ng/孔剂量加入 96 孔 ELISA 板中,4 ℃包被过夜。
洗板:第二天倒掉抗原,用PBS 洗3 次。
封闭:加入5 %脱脂奶粉‐PBST,每孔250 μL,37 ℃封闭1 h。
洗 板:每 孔 加 入200 μL PBST,3 min/次,洗3 次。
蛋白孵育:将 Fiber Knob 蛋白按1 ng/孔,0.5 ng/孔,0.25 ng/孔,0.125 ng /孔加至包被有DSG2胞外域蛋白和 Fiber Knob 蛋白的孔中,置于37 ℃温箱孵育2 h,使蛋白充分结合。
洗 板:每 孔 加 入200 μL PBST,3 min/次,洗5 次。
结合第二抗体:每孔加入100 μL 适当稀释度His Tag Antibody(HRP),37 ℃孵育1 h。(用封闭液稀释)
洗 板:每 孔 加 入200 μL PBST,3 min/次,洗5 次。
显色:每孔加入100 μL 酶反应底物TMB,室温放置5~10 min。
终止反应:加入50 μL ELISA 终止液终止反应。
结果测定:用酶标仪检测OD450值。
1.3 统计学处理
数据结果均采用GraphPad Prism 9.4.0 软件进行统计分析,结果用(±s)表示,两组之间的比较采用独立样本t检验,多组之间的比较采用单因素方差分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 重 组 表 达 质 粒pCMV3‐DSG2ex‐IgG1 的 构 建及鉴定
以pCDNA4To‐DSG2 质 粒 为 模 板,PCR 扩 增出DSG2 胞外域片段,通过0.7%琼脂糖凝胶电泳进行鉴定,扩增片段约为1 680 bp 左右,与理论序列大小位置一致(图2)。使用AfeⅠ酶和BmtⅠ酶将pCMV3‐IgG1 载体双酶切经0.7%琼脂糖凝胶电泳检测到一条7 500 bp 左右的条带,与空质粒pC‐MV3‐IgG1 大小相符合(图2)。重组表达质粒pC‐MV3‐DSG2ex‐IgG1 经AfeⅠ酶 和BmtⅠ酶 双 酶切,可见约1 680 bp 的目的基因条带,大小位置和理论一致(图2),表明重组表达质粒构建正确。测序结果显示,获得的基因序列与目的基因序列完全一致。
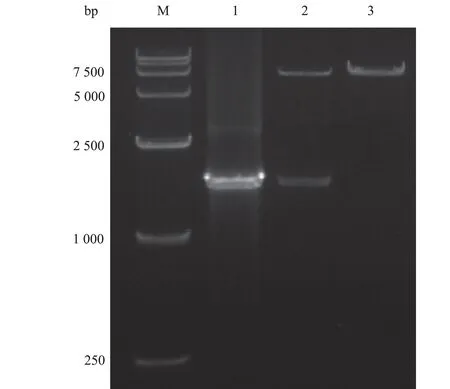
图2 重组表达质粒pCMV3‐DSG2ex‐IgG1 的构建及鉴定图Fig 2 Construction and identification of recombinant ex-pression plasmid pCMV3-DSG2ex-IgG1
2.2 表达产物的检测
ELISA 结果显示,48 h 能检测上清中有分泌的DSG2 胞外域蛋白(DSG2ex‐IgG1)表达,与pCMV3‐IgG1 空质粒转染比较,pCMV3‐DSG2ex‐IgG1 转染后随着时间的增加上清中DSG2 胞外域蛋白(DSG2ex‐IgG1)表达量逐渐增加(P<0.000 1),96 h上清中表达量最高,120 h 上清中蛋白表达量比96 h略 低。表 明pCMV3‐DSG2ex‐IgG1 质 粒 转 染 成 功并表达出来了DSG2 胞外域蛋白(DSG2ex‐IgG1),选择转染96 h 后细胞上清收集进行后续大量纯化蛋白。见图3 和表1。
表1 DSG2胞外域蛋白不同时间段含量检测(n=3,±s)Tab 1 Detection of DSG2 extracellular domain protein con-tent at different time periods(n=3,±s)
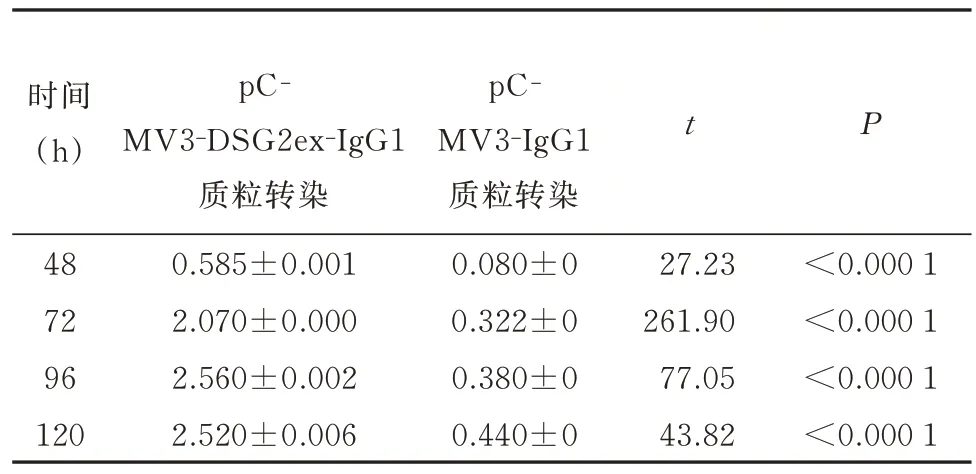
表1 DSG2胞外域蛋白不同时间段含量检测(n=3,±s)Tab 1 Detection of DSG2 extracellular domain protein con-tent at different time periods(n=3,±s)
时间(h)t P 48 72 96 120 pC‐MV3‐DSG2ex‐IgG1质粒转染0.585±0.001 2.070±0.000 2.560±0.002 2.520±0.006 pC‐MV3‐IgG1质粒转染0.080±0 0.322±0 0.380±0 0.440±0 27.23 261.90 77.05 43.82<0.000 1<0.000 1<0.000 1<0.000 1
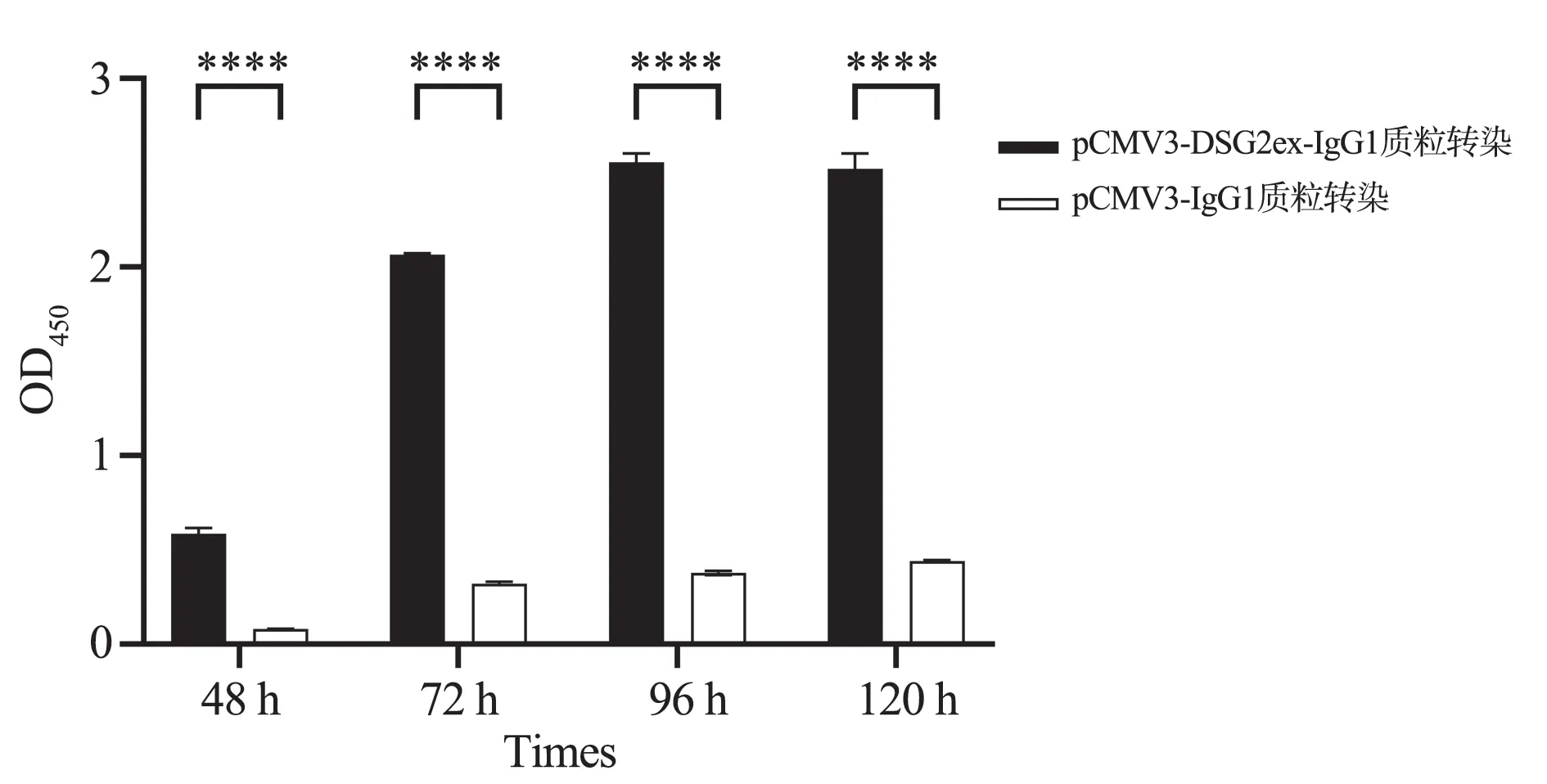
图3 DSG2 胞外域蛋白不同时间段含量检测Fig 3 Detection of DSG2 extracellular domain protein content at different time periods
2.3 DSG2 胞外域蛋白(DSG2ex‐IgG1)Protein A亲和层析结果
转染96 h 后收集细胞培养上清,将收集的细胞培养上清经过Protein A 亲和层析结果如图4,相对分子质量在100~130 kDa 之间出现条带,与预期大小一致,纯化的融合蛋白经SDS‐PAGE 分析,可见其纯度达90%以上。

图4 DSG2 胞外域蛋白Protein A 亲和层析结果Fig 4 DSG2 extracellular domain protein Protein A affin-ity chromatography results
2.4 DSG2 胞外域蛋白Western blotting 鉴定
Western Blotting 分 析 显 示,纯 化 的DSG2 胞 外域 蛋 白 可 与 兔Anti‐Human IgG antibody 特 异 性 结合,相对分子质量在100~130 kDa 检测到特异性条带,与预期大小一致,见图5。超滤管浓缩之后BCA测蛋白浓度为0.8 mg/mL。
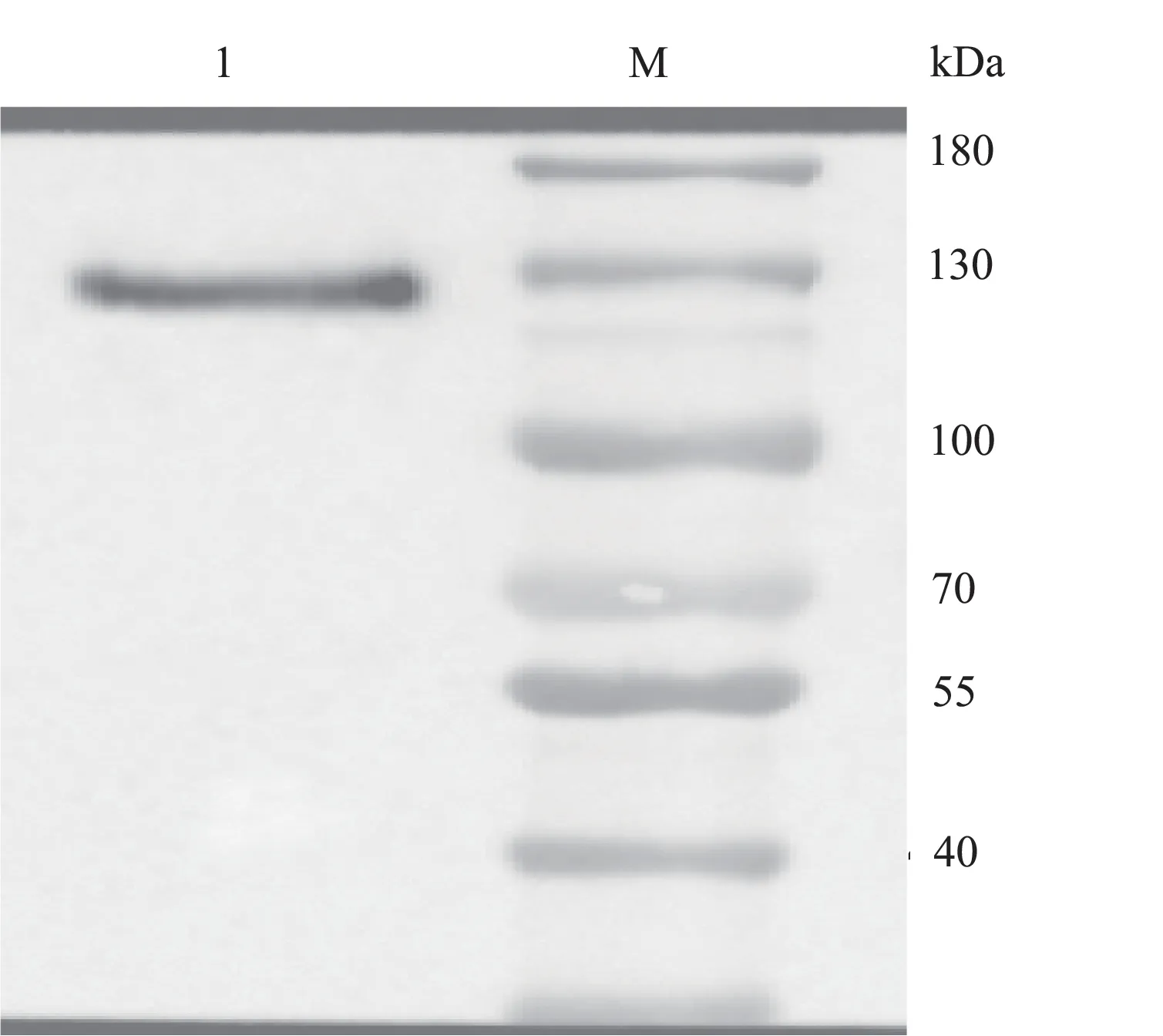
图5 纯化的DSG2 胞外域蛋白Western Blotting 鉴定Fig 5 Western Blotting identification of purified DSG2 extracellular domain protein
2.5 纯化的DSG2 胞外域蛋白生物学活性检测
ELISA 结 果 显 示:将400 ng 的DSG2 胞 外 域 蛋白包被在ELISA 板中,用不同浓度的Fiber Knob 蛋白与之孵育。与阴性蛋白比较,结果表明Fiber Knob 蛋白与DSG2 胞外域蛋白之间存在直接的相互作用,并且这种相互作用是剂量依赖性的(P<0.000 1)。表明制备纯化的DSG2 胞外域蛋白具有明显结合Fiber Knob 蛋白的活性。见图6 和表2。
表2 真核表达纯化的DSG2 胞外域蛋白生物学活性检测(n=3,±s)Tab 2 Detection of biological activity of eukaryotic expressed and purified DSG2 Ectodomain protein (n=3,±s)

表2 真核表达纯化的DSG2 胞外域蛋白生物学活性检测(n=3,±s)Tab 2 Detection of biological activity of eukaryotic expressed and purified DSG2 Ectodomain protein (n=3,±s)
浓度(ng/孔)DSG2 胞外 域蛋白‐Fiber Knob 蛋 白CAR 胞外域蛋白‐Fiber Knob 蛋白(阴性对照组)t P 1 0.5 0.25 0.125 1.820±0.005 1.200±0.001 0.720±0.002 0.430±0.001 0.057±0.000 0.056±0.000 0.056±0.000 0.056±0.000 43.21 76.64 27.80 25.87<0.000 1<0.000 1<0.000 1<0.000 1
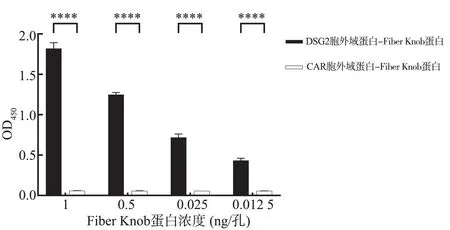
图6 真核表达纯化的DSG2 胞外域蛋白生物学活性检测Fig 6 Detection of biological activity of eukaryotic ex-pressed and purified DSG2 Ectodomain protein
3 讨论
近些年来,越来越多的研究发现DSG2 与许多肿瘤的发生、发展密切相关,因此关于DSG2 蛋白功能的研究非常重要。近几年关于HAdV‐55 引起的急性呼吸道疾病报道逐渐增多。HAdV‐55 正成为社区特别是军营暴发急性呼吸道疾病的主要原因。但是尚无HAdV‐55 感染治疗的特效药物及预防疫苗。DSG2 蛋白是HAdV‐55 结合的主要高亲和力受体,所以DSG2 蛋白成为抗腺病毒药物研究的一个重要方向。如何高效获得DSG2 蛋白是研究其蛋白功能及开发抗腺病毒药物的关键。
本 研 究 成 功 构 建 了pCMV3‐DSG2ex‐IgG1 真核表达载体,通过其转染293T 细胞成功表达了DSG2 胞外域蛋白,并通过信号肽的作用成功将胞外域蛋白分泌到细胞培养基中,不需要对细胞进行裂解来提取蛋白,节省了时间和成本,而且真核表达可使蛋白产物适当折叠以增加可溶性并避免原核表达中蛋白不能正确折叠而导致包涵体生成的麻烦。另外,整合人IgG Fc 标签对构建重组载体和蛋白构象稳定等方面都具有重要影响,可提高抗原的清除率和加强纯化蛋白的半衰期[15],同时也能促使融合蛋白以异二聚体的形式存在[16]。融合人Fc片段所制备的抗体是一种全人源化单克隆,能显着降低融合蛋白对人体的免疫原性[17]。
本研究中当质粒与转染试剂以1∶3 比例转染时,DSG2 胞外域蛋白表达含量在96 h 达到最高,120 h 蛋白表达含量比96 h 略低,且随着转染时间的延长,细胞状态也越来越差并且时间久蛋白也会降解影响其后续的活性。所以本研究中选择96 h 收集细胞培养基进行后续蛋白纯化。但是质粒与转染试剂的比例也可能导致蛋白量表达发生变化,所以这也是一个值得需要优化的条件。
综上所述,本研究成功建立了一种简单高效的人可溶性DSG2 胞外域蛋白真核表达及纯化的方法,且纯化出具有生物活性的DSG2 胞外域蛋白,为后期其蛋白功能研究及抗腺病毒药物的研究奠定了基础。
作者贡献度说明:
陈楠:进行研究构思、实验操作、数据分析、文稿起草;李晓月、顾欣雨:参与质粒构建和ELISA 实验;吴同鑫、章汝:参与细胞培养与蛋白纯化;唐香平、李云、戴劲:参与West‐ern blotting 实验和数据分析;易永祥:研究经费支出和文章修正。
所有作者声明不存在利益冲突。
