结核分枝杆菌微滴数字PCR检测试剂盒企业参考品的研制
2023-06-04李小红李俊花危宏平
王 诺,李小红,周 雪,李俊花,危宏平
(中国科学院 武汉病毒研究所,武汉 430070)
0 引言
结核病大多是由结核分枝杆菌复合群(包括结核分枝杆菌、牛分枝杆菌、田鼠分枝杆菌和非洲分枝杆菌)引起的慢性传染病,以肺结核最为多见[1]。结核分枝杆菌主要经空气传播,潜伏及感染时间长。世界卫生组织已将其作为重点控制的传染病之一。
结核分枝杆菌检测方法主要有培养法、痰涂片法、胶体金抗原检测法及核酸检测法。培养法是检测的金标准,但存在培养方法复杂、检测速度慢及培养阳性率低等缺点。非结核分枝杆菌会导致痰涂片结果呈阳性,而胶体金抗原检测法灵敏度低,易造成假阴性。荧光PCR法是结核病检测经常使用的一种检测技术,敏感性及特异性很高,技术操作也不复杂,故被广泛应用于临床筛查及结核病辅助诊断。微滴数字PCR法是第三代PCR技术,是基于PCR反应的单分子绝对定量技术,通过对样本的微滴化处理,大大提升了检测灵敏度及准确性,只需要很少的模板量就能进行检测,较荧光PCR法有较大的优势[2]。
为满足结核分枝杆菌复合群核酸检测试剂盒(微滴数字PCR法)的质量评价及注册申报需要,研制了结核分枝杆菌微滴数字PCR检测试剂盒企业参考品,检测项目包括阳性参考品符合率、阴性参考品符合率、最低检出量及精密性[3-5]。
1 材料与方法
1.1 菌株
结核分枝杆菌减毒株H37Ra、BCG、耻垢分枝杆菌及海分枝杆菌均来源于中国科学院武汉病毒研究所保藏中心。
1.2 主要试剂及仪器
7H9液体培养基、7H10固体培养基外购自BD公司(Becton,Dickinson and Company),WK30两性表面活性剂由德国赢创研发生产[6],结核分枝杆菌复合群核酸检测试剂盒(荧光PCR法)来自武汉赛思锐微生物技术有限公司,QX200 微滴式数字PCR系统购自BIO-RAD。
1.3 菌种培养及鉴定
将结核分枝杆菌减毒株H37Ra与BCG菌株接种于7H9液体培养基上,使用37 ℃、5%的CO2培养3~4周,充分震荡混匀,制备菌悬液,平均分成2份,其中一份-20 ℃冻存,另一份取0.5 mL均匀涂布在7H10固体培养基上,使用37℃、5%的CO2培养1周,采用平板计数法计算浓度。95 ℃水浴30 min灭活1 mL菌液,使用16S测序法进行鉴定,将经鉴别无误且无污染的合格菌液作为参考品原菌液。
将耻垢分枝杆菌与海分枝杆菌接种于7H9液体培养基上,耻垢使用37 ℃培养3 d,海分枝杆菌使用30 ℃培养6 d。充分震荡混匀,制备菌悬液,平均分成2份,其中一份-20 ℃冻存,另一份取0.5 mL均匀涂布在7H10固体培养基上,使用相应的条件培养1周,采用平板计数法计算浓度。95 ℃水浴30 min灭活1 mL菌液,使用16S测序法进行鉴定,将经鉴别无误且无污染的合格菌液作为参考品原菌液[7]。
1.4 原菌液的制备
阳性与阴性参考品原菌液的制备:-20 ℃冻存的菌液,采用95 ℃水浴30 min灭活,利用平板计数法计算浓度,均用5%WK30稀释H37Ra、BCG、耻垢分枝杆菌、海分枝杆菌菌液至106CFU/mL,作为灭活的阳性质控品与阴性质控品菌液,-20 ℃以下保存。
最低检出量及精密性参考品原菌液的制备:使用灭活的结核分枝杆菌H37Ra菌液,加入5%WK30稀释到106CFU/mL,-20 ℃以下保存。
1.5 参考品的制备与分装
阳性参考品的制备:将2株结核分枝杆菌复合群菌液H37Ra、BCG以5%WK30做10倍系列稀释至103CFU/mL,定量分装,1 mL/管,-20℃以下保存,分别记为P1、P2。
阴性参考品的制备:将2株非结核分枝杆菌耻垢分枝杆菌、海分枝杆菌的菌液以5%WK30做10倍系列稀释至104CFU/mL,定量分装,1 mL/管,-20 ℃以下保存,分别记为N1、N2。
最低检出量参考品的制备:最低检出量参考品原菌液以5%WK30分别10倍系列稀释,分别制备103、102、101、100CFU/mL的菌液,定量分装,1 mL/管,-20 ℃以下保存,依次记为S1、S2、S3、S4。
精密性参考品的制备:按确定的细菌浓度,将精密性参考品原菌液以5%WK30稀释,制备102CFU/mL菌液,定量分装,1 mL/管,-20 ℃以下保存,每10管为一组,分别记为J1~J10。
1.6 参考品的验证
按照荧光PCR试剂盒说明书方法检测参考品并对其进行确认,每份样品平行检测3次。
准确性:对阳性参考品(P1,P2)进行检测,要求均为阳性。
特异性:对阴性参考品(N1,N2)进行检测,要求均为阴性。
精密性:对精密性参考品进行检测(J1~J10),应全部为阳性,且CV≤5%。
最低检出量:对最低检出量参考品进行检测(S1~S4),S1与S2要求为阳性,S3与S4不做要求。
1.7 参考品的稳定性分析
冻融稳定性:将阳性参考品(P1~P2)、精密性参考品、最低检出限参考品分别于-20 ℃冰箱取出,于室温放置1 h,再放于20 ℃冰箱,重复此步骤3次、5次。用微滴数字PCR检测试剂盒进行检测,用-20 ℃保存的参考品进行平行测定。
加速稳定性:将阳性参考品(P1~P2)、精密性参考品、最低检出限参考品分别放置于2 ℃~8 ℃、25 ℃、37 ℃条件3 d及7 d,用微滴数字PCR检测试剂盒进行检测,用-20 ℃保存的参考品进行平行测定。
1.8 参考品的应用
使用本参考品对连续3个生产批的结核分枝杆菌复合群核酸检测试剂盒(微滴数字PCR法)进行检验,评价试剂盒质量。
2 结果
结果显示,外购荧光PCR试剂盒的3次重复检测均符合准确性(阳性参考品符合率2/2)、特异性(阴性参考品符合率2/2)及精密性(均为阳性且CV均≤5%)的要求,最低检出限达到1.0*102CFU/mL,详见表1。
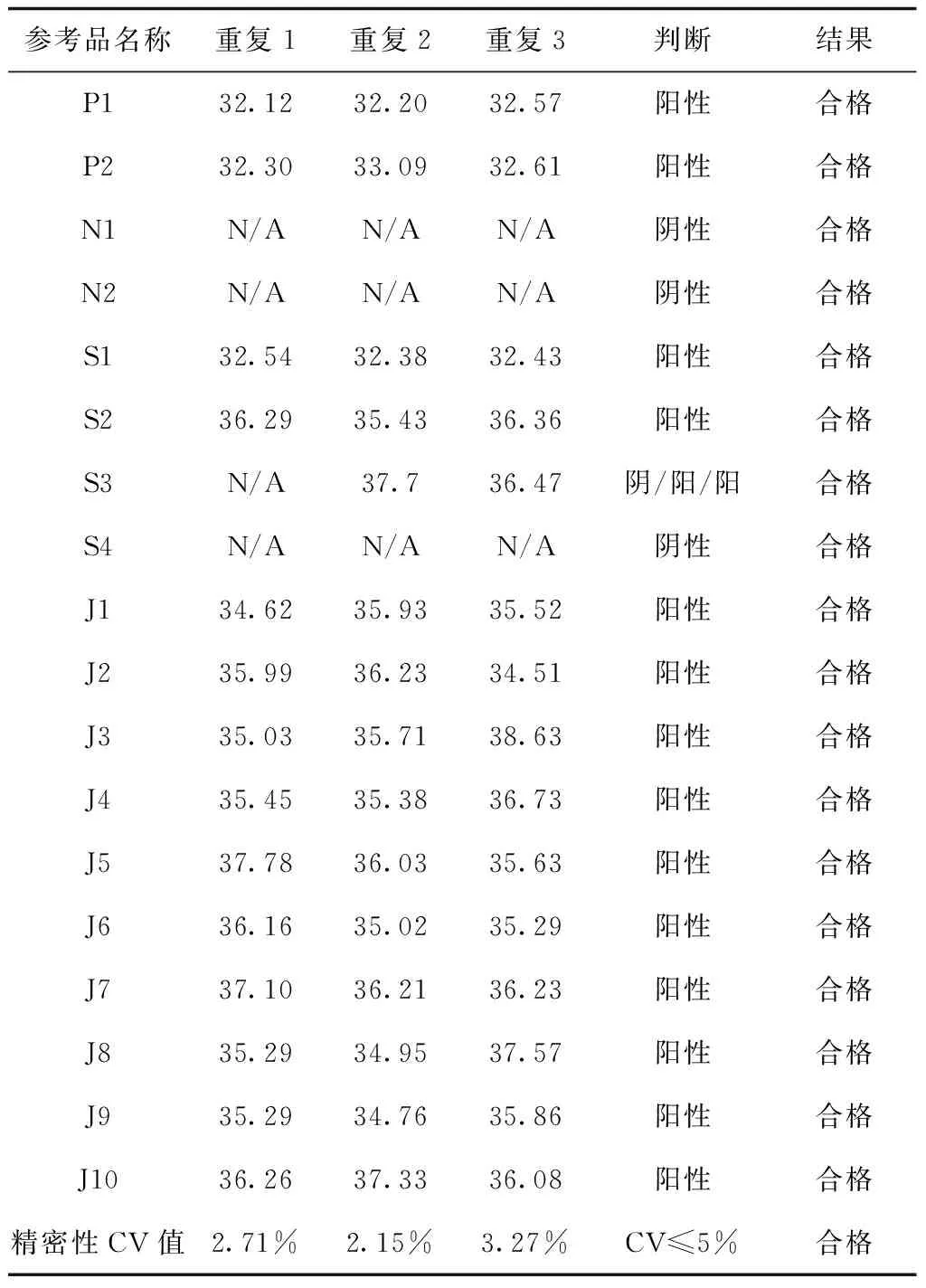
表1 参考品检验结果Tab.1 Results of reference test
冻融稳定性:经反复冻融3次、5次处理后,与-20 ℃保存的各参考品检测结果相比,阳性微滴数的差异无统计学意义,表明参考品的冻融稳定性良好,见表2。
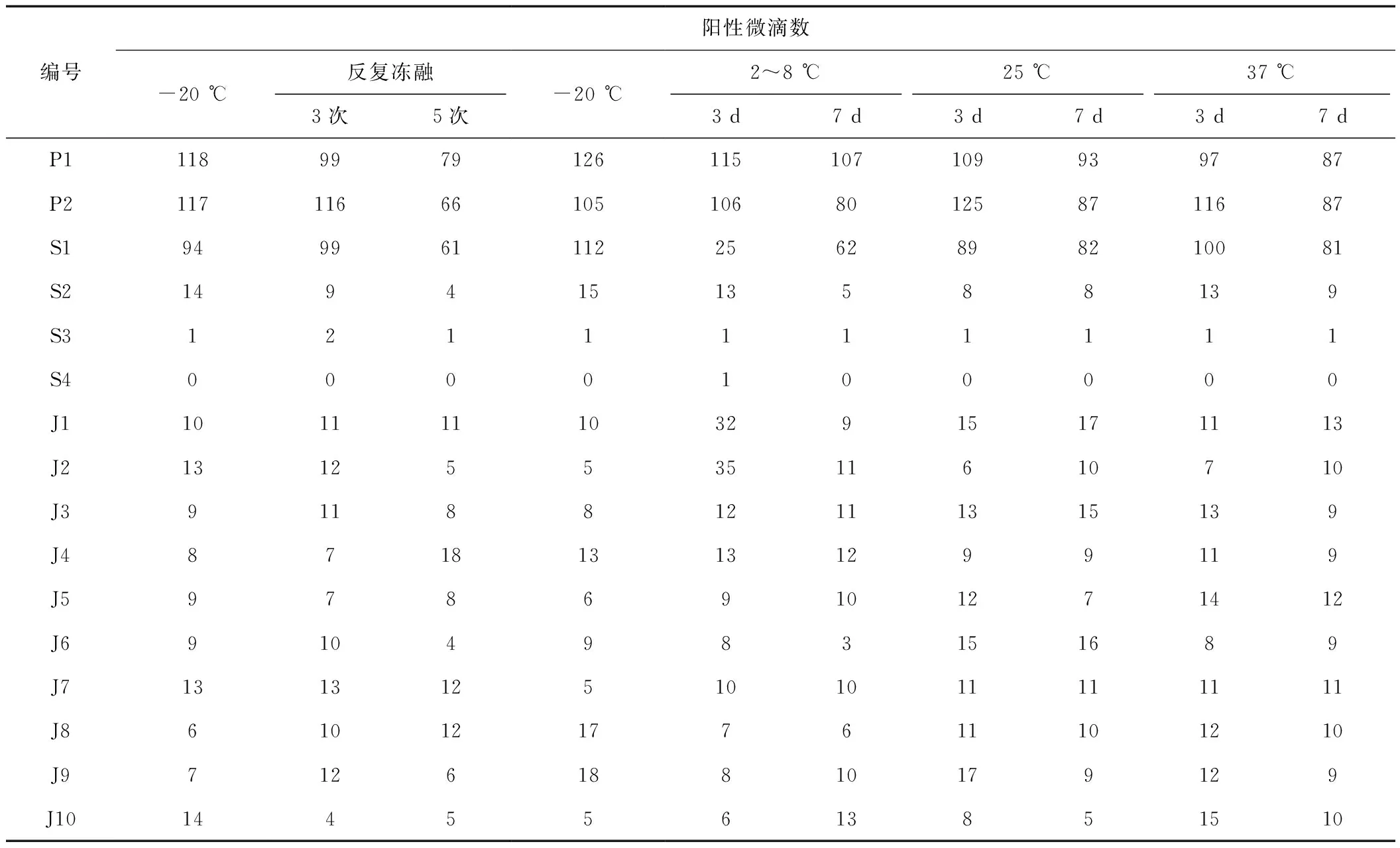
表2 参考品冻融稳定性及加速稳定性结果Tab.2 Freeze-thaw and accelerated stability of reference
加速稳定性:将各参考品分别于2~8 ℃、25 ℃、37 ℃放置3 d和7 d,与-20 ℃保存的参考品检测结果相比,阳性微滴数差异无统计学意义,表明本参考品在加速破坏条件下具有较好的稳定性,见表2。
使用该参考品对结核分枝杆菌复合群核酸检测试剂盒(微滴数字PCR法)各3批进行出厂检测,检测结果见表3。
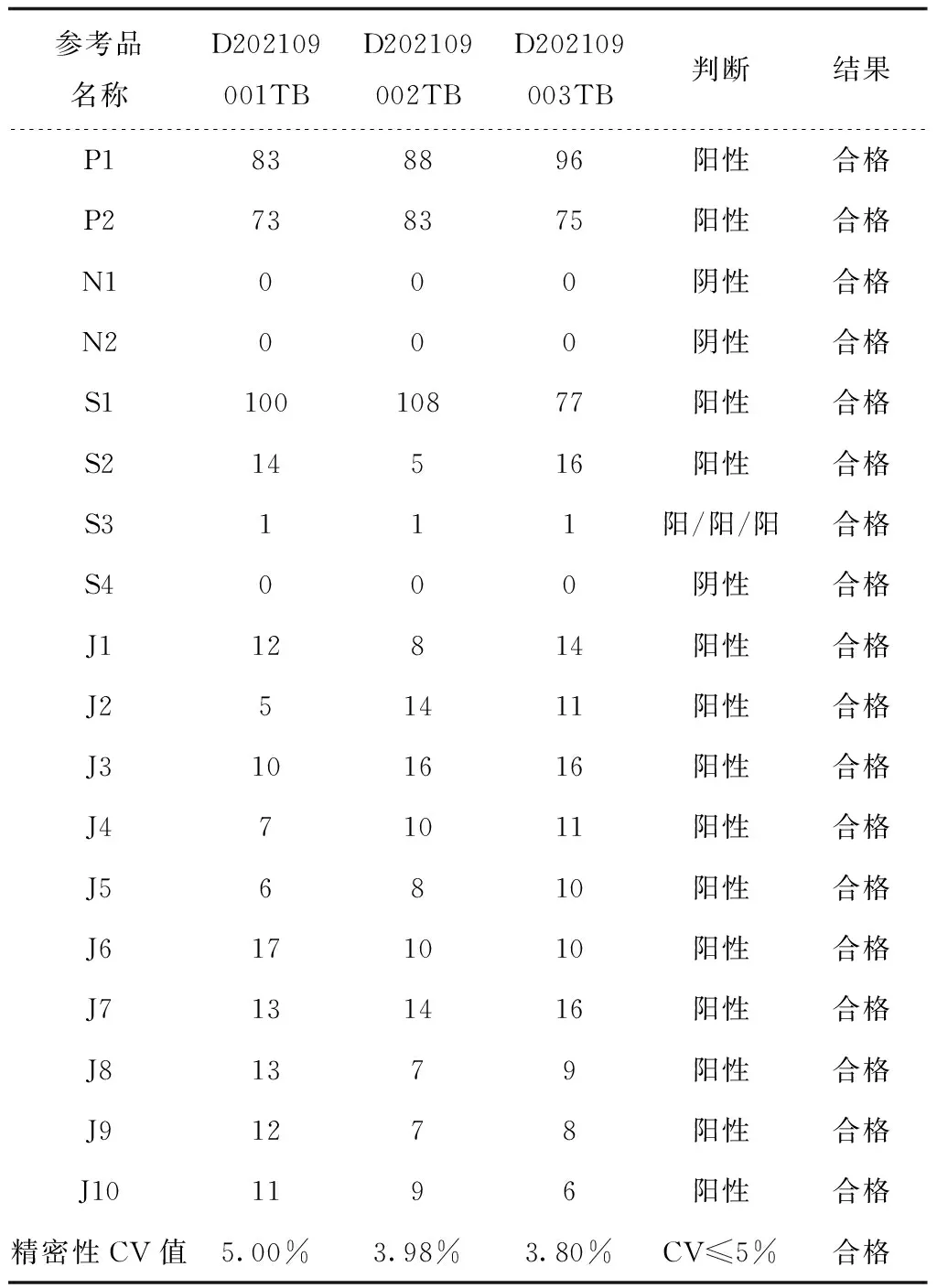
表3 微滴数字PCR检验结果Tab.3 Results of microdrop digital PCR test
以上结果表明,连续3个生产批的结核分枝杆菌微滴数字PCR试剂盒可通过该参考品作出厂检测质量评价。
3 讨论
该参考品选择了2株结核分枝杆菌及2株非结核分枝杆菌,阴性参考品使用了分类学上与结核分枝杆菌地位接近的耻垢分枝杆菌属菌与海分枝杆菌,阳性参考品使用灭活的结核分枝杆菌菌株减毒株及卡介苗疫苗株,符合法规需要,降低了生物安全风险。设置了精密性参考品,来自H37Ra灭活稀释后的菌悬液将细菌浓度定为102CFU/mL,略高于国家参考品规定的102个菌/mL应检出阳性的标准。设置了最低检出量参考品,使用10倍梯度稀释制备,最低检出量标准为101CFU/mL,满足微滴数字PCR试剂盒的灵敏度要求。对分装后的参考品进行验证,结果表明,本参考品具有较好的准确性、特异性及重复性。制备参考品的过程中使用WK30代替生理盐水对灭活菌液进行稀释,减少了DNA酶对其的降解,并对其稳定性进行验证,结果显示,最多冻融5次或37 ℃放置14 d时,本参考品依然可以正常使用,满足了保存及运输要求。但由于缺乏长期稳定的数据,需要在后续研究中持续监测。该结核分枝杆菌微滴数字PCR检测试剂盒企业参考品可用于拟注册申报试剂盒质量评价及出厂检验。
