乌梅水提取物对金黄色葡萄球菌的抑菌作用
2023-06-04刘明雨邢扬帆
臧 蕾,刘明雨,邢扬帆,李 振
(临沂大学 医学院,山东 临沂 276000)
金黄色葡萄球菌(SA)是临床上常见的致病菌,广泛存在于自然界中,是医院和社区感染致病的重要病原菌[1],随着抗菌药物的广泛使用,致使耐药菌菌株数量渐增。而化学合成药物研发难度大,时间长,毒副作用明显,故从中草药中获取抗菌物质、提高机体抗病力成为研究热点。
乌梅是蔷薇科植物梅的用药部分[2],研究发现其含有有机酸、萜类、脂类、黄酮[2]等多种有效成分,具有抑菌[3]、抗炎、抗氧化、增强免疫和降血糖等作用[4]。探讨乌梅水提取物对金黄色葡萄球菌的抗菌活性及作用机制,可为其开发及临床应用提供理论依据。
1 材料与方法
1.1 仪器
高速中药粉碎机(浙江哈瑞工贸有限公司生产)、分光光度计(上海元析仪器有限公司生产)、旋转蒸发器(上海贝茵生物科技有限公司生产)、台式离心机(长沙湘仪离心机仪器有限公司有限公司生产)、电子天平(沈阳龙腾电子有限公司生产)、高压灭菌锅(浙江新丰医疗器械有限公司生产)、电热套(常州润华电器有限公司生产)、SW-CJ-1D 超净工作台(苏州精华设备总厂生产)、生化培养箱(常州欣耀宇仪器制造有限公司生产)、酶标仪(济南好来宝医疗器械有限公司生产)、超纯水机(杭州亿捷科技有限公司生产)、电热恒温鼓风干燥箱(鹤壁市冶金机械设备有限公司生产)。
1.2 药物与试剂
乌梅(山东老百姓大药房提供)、营养琼脂培养基及营养肉汤培养基(青岛高科学海博生物技术有限公司生产)、碱性磷酸酶(ATP)试剂盒与乳酸脱氢酶(LDH)试剂盒及蛋白定量测定试剂盒(上海嘉楚生物工程有限公司生产)、磷酸氢二钠与氯化钾(天津市鑫铂特化工有限公司生产)。
1.3 菌种
金黄色葡萄球菌(中国药品检验研究院生产)。
1.4 方法
1.4.1 乌梅提取物的制备
取20 g乌梅粉置于500 mL烧瓶,加入200 mL蒸馏水,浸泡0.5 h,煮沸回流1.5 h,过滤,制得提取液。滤渣,再加蒸馏水100 mL,再次煮沸回流45 min并过滤,合并提取液,浓缩,4 ℃保存,备用[5]。
1.4.2 药敏试验
采用管碟法,取融化的营养琼脂培养基适量,置培养皿中静置3~5 min,凝固后每个培养皿中加入107CFU/mL的SA菌悬液适量,用L型玻璃棒涂抹均匀,放置于5个牛津杯。将不同浓度乌梅提取液(50、25、12.5 mg/mL)、青霉素(阳性对照)、生理盐水(阴性对照)按250 μL/个加入牛津杯,放置在生化培养箱中,37 ℃恒温培养18~24 h,测量抑菌圈直径(IZD,mm),进行结果判定。IZD≥20 mm,极度敏感;15≤IZD<20 mm,高度敏感;10≤IZD<15 mm,中度敏感;5≤IZD<10 mm,轻度敏感;IZD<5 mm,不敏感[6]。
1.4.3 最小抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定
利用试管二倍稀释法,取9支干燥无菌试管,各加入1 mL含107CFU/mL的SA菌悬液。第1管加入0.4 g/mL的乌梅提取液1 mL,混匀,吸出1 mL加至第2管中,顺次操作至第7管,混匀,吸取1 mL弃去。第8管加入青霉素1 mL,为阳性对照管。第9管加入生理盐水1 mL,为阴性对照管。置于37 ℃恒温培养16~24 h,以无SA生长的试管所在的药物浓度认定为最小抑菌浓度(MIC)。将未见细菌生长的试管摇匀,分别吸取100 μL加入到营养琼脂培养基上,置生化培养箱内,37 ℃培养18~24 h,观察细菌生长状况,计算平板上的SA菌落,以活菌计数法表示平均菌落数,<5个对应的最小稀释度的提取物质量浓度即最小杀菌浓度(MBC)[6-7]。
1.4.4 乌梅水提取物抑菌机制研究
1)乌梅水提取物对金黄色葡萄球菌碱性磷酸酶的影响[8]。准备LB液体培养基,分别加入乌梅水提取物,使其浓度分别为MIC和2MIC。以不含乌梅水提取物的培养基作为对照,分别加入SA菌悬液,37 ℃、150 r/min摇床继续培养,于0、2、4、6、8 h时吸取菌液,3 500 r/min离心10 min,取上清液,用试剂盒测定AKP活性。
2)乌梅水提取物对金黄色葡萄球菌乳酸脱氢酶活性的影响[9]。分别于0、2、4、6、8 h时取实验组与对照组SA菌悬液,3 500 r/min离心5 min,取上清液,用试剂盒测定胞外LDH活性。
3)乌梅提取物对金黄色葡萄球菌胞外蛋白的影响。分别于0、2、4、6、8 h时取试验组与对照组SA菌悬液,3 500 r/min离心5 min,取上清液,加入考马斯亮蓝染色剂,静置5 min,用酶标仪测定595 nm波长处吸光度。
2 实验结果
2.1 乌梅水提取物抑菌效果
2.1.1 药敏试验
从表1可知,乌梅水提取物可明显抑制SA。浓度分别为12.5、25、50 mg/mL时,抑菌圈直径分别为17.50±0.94、20.11±1.03、22.82±0.88 mm,阳性对照,抑菌圈直径为15.34±1.26 mm,阴性对照,无抑菌现象,说明金黄色葡萄球菌对乌梅水提取物高度敏感。

表1 乌梅水提取物抑菌直径Tab.1 Bacteriostatic diameter of plum extract
2.1.2 对金黄色葡萄球菌的MIC和MBC
MIC和MBC能够直观反映抑制细菌生长的最低浓度。由表2可知,乌梅提取物对SA的MIC和MBC分别为6.25 mg/mL、12.5 mg/mL,阴性对照组菌体生长良好。

表2 乌梅提取物对SA的MIC、MBC测定结果Tab.2 Determination results of MIC and MBC of plum extract against Staphylococcus aureus
2.2 乌梅水提取物抑菌作用机制
2.2.1 对金黄色葡萄球菌碱性磷酸酶的影响
乌梅水提取物对SA碱性磷酸酶(AKP)的影响结果见图1。随着处理时间的增加,经过MIC和2MIC乌梅水提取物处理后,菌悬液中AKP含量持续升高,在6 h后趋于平稳。2MIC乌梅提取物处理的SA菌悬液AKP含量超过MIC,表明乌梅水提取物可破坏SA细胞壁,从而使AKP含量增加[10]。
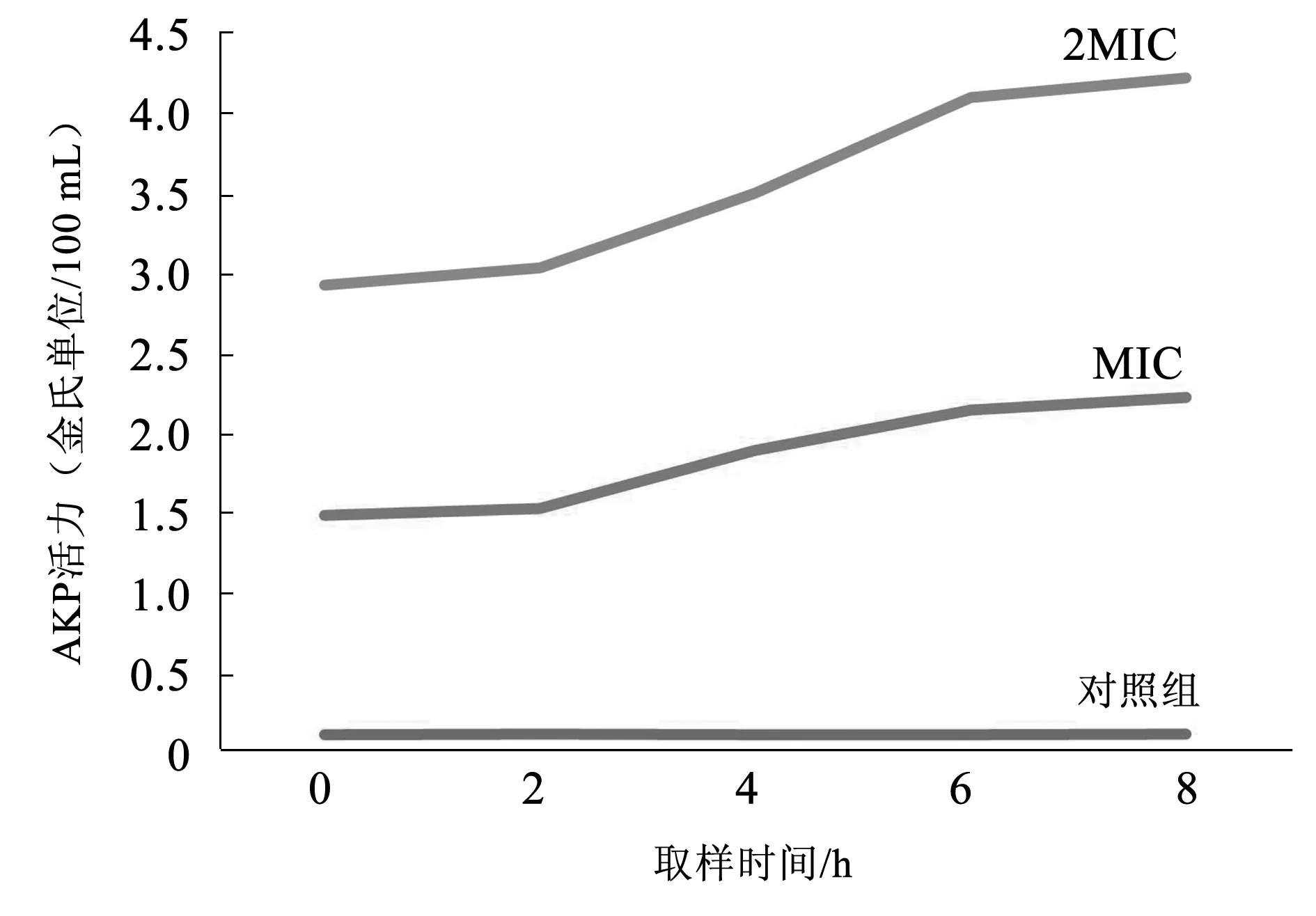
图1 乌梅水提取物对SA碱性磷酸酶的影响Fig.1 Effect of plum extract on alkaline phosphatase of Staphylococcus aureus
2.2.2 对金黄色葡萄球菌乳酸脱氢酶的影响
乌梅水提取物对SA乳酸脱氢酶(LDH)活性的影响结果见图2。随着处理时间的增长,乌梅水提物处理菌液中LDH活性不断增强,2 MIC组乌梅提取物处理的SA菌悬液LDH活性高于MIC组,说明乌梅提取物的处理使SA细胞膜通透性增加,导致LDH含量增加。
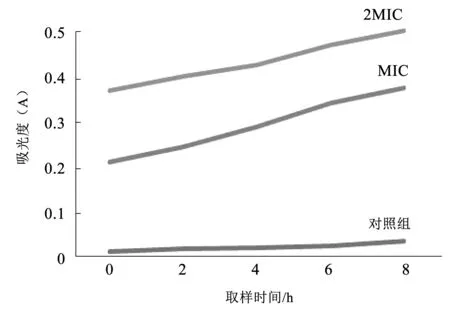
图2 乌梅提取物对SA乳酸脱氢酶的影响Fig.2 Effect of plum extract on lactic dehydrogenase of Staphylococcus aureus
2.2.3 对金黄色葡萄球菌胞外蛋白的影响
乌梅水提取物对SA胞外蛋白的影响如3图所示。随着处理时间的增加,胞外蛋白浓度逐渐增加,其中2MIC乌梅水提取物处理的SA菌悬液胞外蛋白含量高于MIC,表明乌梅水提取物可增加SA的细胞膜通透性,造成细菌蛋白质外泄,从而引起菌体胞外蛋白含量的增加。
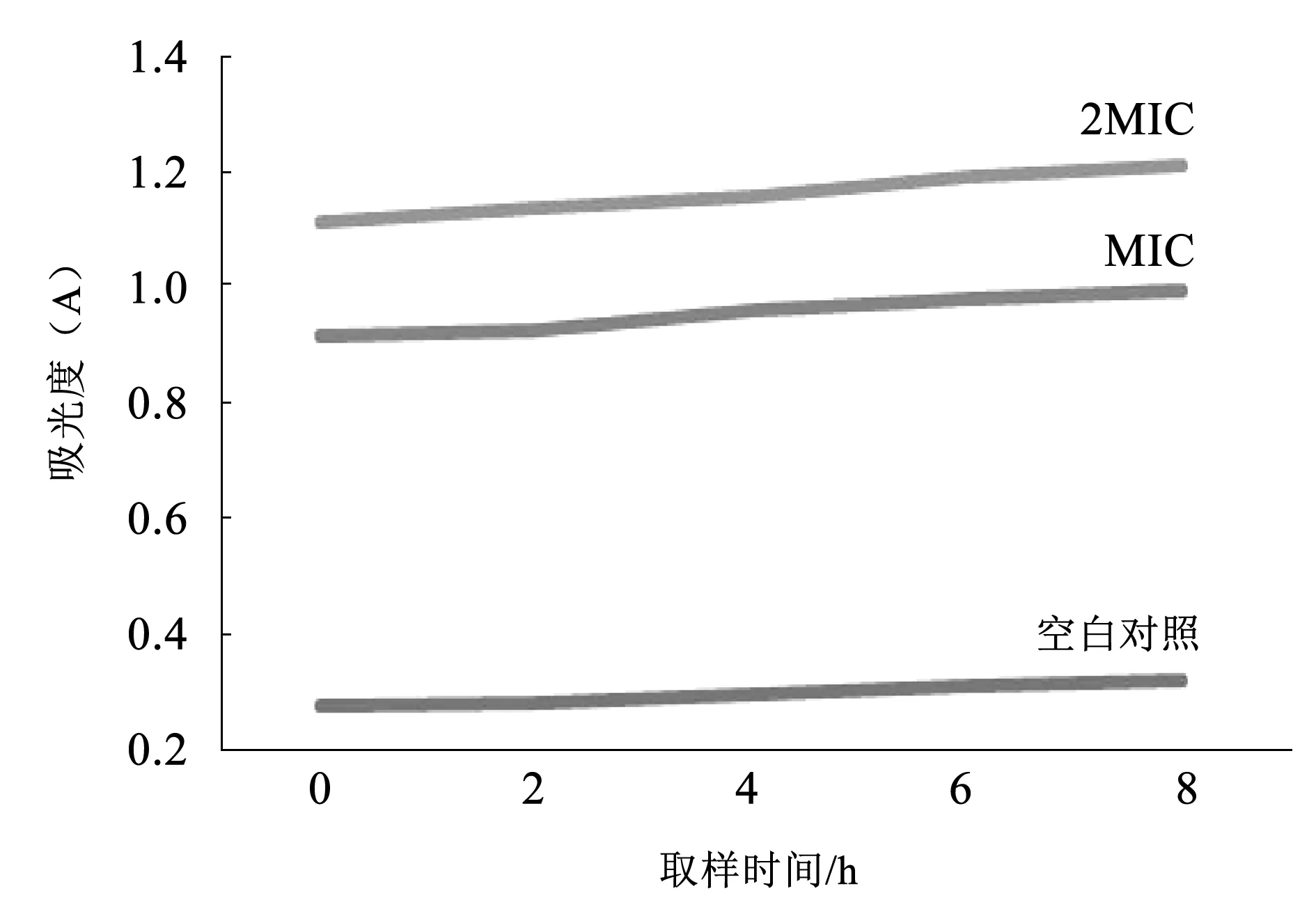
图3 乌梅水提取物对SA胞外蛋白的影响Fig.3 Effect of plum extract on extracellular protein of Staphylococcus aureus
3 讨论
通过宿主细胞内的支撑和保护,金黄色葡萄球菌可以逃避宿主防御机制和大多传统的抗菌药物治疗[11]。研究表明,乌梅提取物浓度分别为12.5、25 mg/mL时,对SA分别达到高度敏感和极度敏感状态,MIC、MBC分别为6.25 mg/mL和12.5 mg/mL,表现出良好的抑菌作用。AKP位于SA细菌细胞壁和细胞膜间隙中,一般不向外分泌,当SA细胞壁遭到破坏,AKP才会进入胞液中,因此细胞外AKP含量变化可表明细菌细胞壁的完好性[8]。细胞膜是细菌的保护屏障,当乌梅水提取物作用SA后,细胞膜通透性增加,细胞浆内的LDH、可溶性蛋白质可释放到培养液中[12],因此LDH水平、可溶性蛋白质含量的变化可间接反映细菌细胞膜的通透性。
4 结论
研究结果表明,乌梅水提取物对SA的最低抑菌浓度为6.25 mg/mL、最小杀菌浓度为12.5 mg/mL。经过乌梅水提取物处理后,SA的胞外AKP、LDH活性及胞外蛋白含量明显增加,因此乌梅水提取物对金黄色葡萄球菌的抑制作用可能是通过破坏菌体细胞壁和细胞膜使细胞内容物外泄所致。
