德谷门冬双胰岛素与甘精胰岛素治疗口服降糖药控制不佳2 型糖尿病的临床疗效
2023-06-02单秋妹
单秋妹
(天津市武清区人民医院内分泌科,天津 301700)
2 型糖尿病(type 2 diabetes mellitus,T2DM)为内分泌科常见病,以胰岛素分泌不足及胰岛素抵抗为主要特征,可累及多个器官组织,易引发心脑血管疾病及肾功能不全等并发症[1,2]。现阶段,口服降糖药为T2DM 首选治疗方式,但随着病情进展,患者胰岛β 细胞功能呈进行性下降,经口服降糖药后血糖控制不佳情况日益增多[3]。对此,需及时给予胰岛素治疗,以控制体内血糖波动,降低糖尿病并发症风险。目前,甘精胰岛素(insulinglargine,IGlar)与德谷门冬双胰岛素(insulin degludec/insulin aspart,IDegAsp)均为临床常用胰岛素种类,前者为基础长效胰岛素类药物,可利用脂肪酸链增加疏水性,使胰岛素注入后形成稳定六聚体结构,通过缓慢释放入血,发挥长效降糖作用[4,5];后者是由德谷胰岛素(insulin degludec,IDeg)与门冬胰岛素(insulin aspart,IAsp)组合而成的双胰岛素复方制剂,二者以稳定且分离的形式存在,可兼顾IDeg 的长效降糖作用及IAsp的峰值降糖优势[6,7]。随着IDegAsp 在我国批准上市,关于该药与传统IGlar 的临床研究逐渐增多,但目前为止,针对IDegAsp 与IGlar 对口服降糖药控制不佳T2DM 患者的研究报道尚不多见。基于此,本研究结合2020 年3 月-2022 年3 月天津市武清区人民医院收治的84 例口服降糖药控制不佳T2DM 患者资料,观察IDegAsp 与IGlar 治疗口服降糖药控制不佳T2DM 的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料 以2020 年3 月-2022 年3 月天津市武清区人民医院收治的84 例口服降糖药控制不佳T2DM 患者为研究对象,采用随机数字表法分为IDegAsp 组(42 例)和IGlar 组(42 例)。IDegAsp 组男25 例,女17 例;年龄43~72 岁,平均年龄(56.74±5.33)岁;病程3~11 年,平均病程(5.62±3.12)年;体重指数20~35 kg/m2,平均体重指数(26.50±4.02)kg/m2。IGlar 组男23 例,女19 例;年龄44~72 岁,平均年龄(56.80±5.41)岁;病程3~11 年,平均病程(5.70±3.25)年;体重指数20~35 kg/m2,平均体重指数(26.41±4.10)kg/m2。两组性别、年龄、病程、体重指数比较,差异无统计学意义(P>0.05),具有可比性。本研究经医学伦理委员会审批,患者及家属均知情且自愿参与并签署知情同意书。
1.2 纳入和排除标准 纳入标准:①符合T2DM 诊断标准[8];②口服降糖药控制不佳(口服降糖药种类>1种,用药时间>12 周,糖化血红蛋白仍≥7.0%);③无药物禁忌。排除标准:①1 型糖尿病患者;②心、肝、肾功能异常者;③免疫系统异常者;④3 个月内出现过低血糖、糖尿病酮症及急性感染的患者;⑤同期接受其他降血糖治疗者。
1.3 方法
1.3.1 IDegAsp 组 于主餐前给予德谷门冬双胰岛素注射液[诺和诺德(中国)制药有限公司,国药准字J20190017,规格:3 ml∶300 U]皮下注射,起始用量0.2~0.3 U/kg,后续依据患者血糖情况进行调整,1 次/d,疗程3 个月。
1.3.2 IGlar 组 于睡前给予甘精胰岛素注射液[赛诺菲安万特(北京)制药有限公司,批准文号S20060062,规格:3 ml∶300 U]皮下注射,起始剂量0.2~0.3 U/kg,后续依据患者血糖情况进行调整,1 次/d,疗程3 个月。
1.4 观察指标 比较两组血糖指标[糖化血红蛋白(HbA1c)、空腹血糖(FPG)、餐后2 h 血糖(2 hPBG)]、血糖波动情况[最大血糖波动幅度(LAGE)、餐后血糖波动幅度(PPGE)]、胰岛功能[空腹胰岛素(FINS)、胰岛素抵抗指数(HOMA-IR)]、体重指数、日平均胰岛素剂量、不良反应(低血糖、一过性视力障碍、脂肪营养不良、注射部位肿胀等)。
1.5 统计学方法 采用SPSS 21.0 软件进行数据处理,计量资料以()表示,组间比较行t检验,计数资料以[n(%)]表示,组间比较行χ2检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组血糖指标比较 两组治疗后HbA1c、FPG、2 hPBG 水平低于治疗前,且IDegAsp 组HbA1c、FPG、2 hPBG 水平低于IGlar 组,差异有统计学意义(P<0.05),见表1。
表1 两组血糖指标比较()

表1 两组血糖指标比较()
注:与同组治疗前比较,*P<0.05
2.2 两组血糖波动情况比较 IDegAsp 组LAGE、PPGE小于IGlar 组,差异有统计学意义(P<0.05),见表2。
表2 两组血糖波动情况比较(,mmol/L)

表2 两组血糖波动情况比较(,mmol/L)
2.3 两组胰岛功能指标比较 两组治疗后FINS 高于治疗前,HOMA-IR 低于治疗前,且IDegAsp 组FINS高于IGlar 组,HOMA-IR 低于IGlar 组,差异有统计学意义(P<0.05),见表3。
表3 两组胰岛功能指标比较()

表3 两组胰岛功能指标比较()
注:与同组治疗前比较,*P<0.05
2.4 两组体重指数、日平均胰岛素剂量比较 两组治疗后体重指数均大于治疗前,但IDegAsp 组体重指数小于IGlar 组,且日平均胰岛素剂量少于IGlar组,差异有统计学意义(P<0.05),见表4。
表4 两组体重指数、日平均胰岛素剂量比较()
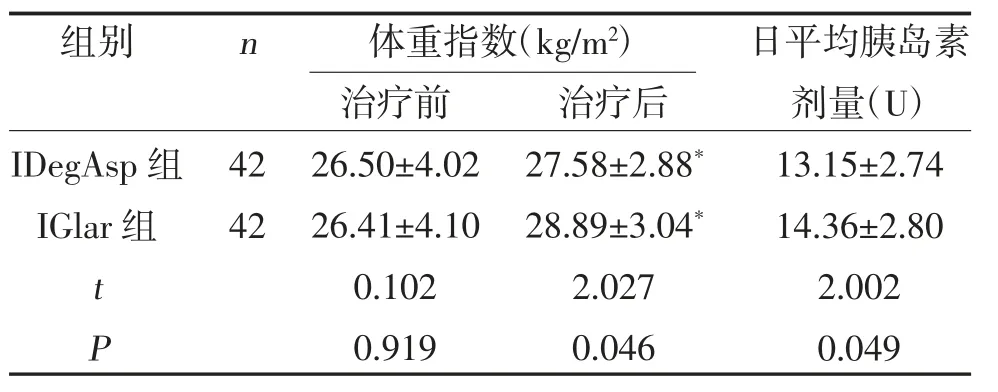
表4 两组体重指数、日平均胰岛素剂量比较()
注:与同组治疗前比较,*P<0.05
2.5 两组不良反应比较 IDegAsp 组不良反应发生率小于IGlar 组,差异有统计学意义(χ2=4.097,P=0.043),见表5。
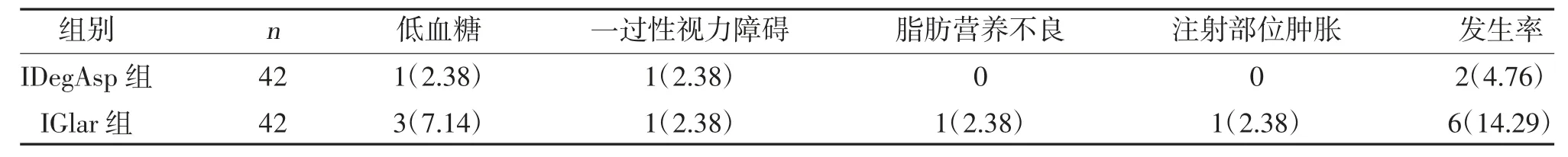
表5 两组不良反应比较[n(%)]
3 讨论
胰岛素是控制高血糖的最有效手段,其作用机制主要为调节血糖、抑制糖异生、糖原分解等[9],对口服药物血糖控制不佳T2DM 患者具有重要治疗作用。目前常用胰岛素种类包括IGlar 与IDegAsp 等,为临床降糖方案提供了丰富选择。IGlar 为当前常用的基础长效胰岛素类型,是将转基因大肠杆菌分泌的甘精胰岛素前体经蛋白复性后制取的胰岛素药物,经皮下注射后,可形成稳定六聚体沉淀物,具有长效稳定等降糖优势[10,11]。研究显示[12,13],IGlar 药效时间约24 h,可有效模拟人胰岛素的分泌,其过程无明显浓度峰及聚集现象,体内代谢平缓,作用稳定。IDegAsp 则属于新型可溶性双胰岛素联合复方制剂,是由IDeg 与IAsp 按固定配比(7∶3)构成,经锌与苯酚溶解后形成的预混胰岛素[14,15]。其中,IDeg为超长效胰岛素,以高度稳定双六聚体形式存在,IAsp 为速效胰岛素,以单六聚体形式存在,二者均保持稳定可溶状态,且相互独立,完整保留了IDeg与IAsp 的药效特点,确保了餐时速效胰岛素覆盖,有利于空腹血糖与餐后血糖的同时控制[16,17]。此外,IDegAsp 注射前无需混悬,经皮下注射后,其IDeg与IAsp 均可随着局部微环境、等电点及构象的改变,以各自方式进行解离,发挥其药效作用,达到长效、平稳、快速的降糖目的[18,19]。
本研究结果显示,两组治疗后HbA1c、FPG、2 hPBG 水平低于治疗前,且IDegAsp 组HbA1c、FPG、2 hPBG 水平低于IGlar 组(P<0.05),提示IDegAsp 与IGlar 在口服降糖药控制不佳T2DM 治疗中均具有确切作用,但IDegAsp 降糖效果优于IGlar。分析认为,IDegAsp 中的IDeg 半衰期可达25.1 h,其持续作用时间超过24 h,而IAsp 则可于15 min 内迅速起效,二者联合应用,可同时发挥基础胰岛素与餐时胰岛素的应用优势,有助于患者的血糖管理[20]。同时,IDegAsp 组LAGE、PPGE 小于IGlar 组(P<0.05),表明IDegAsp 治疗引起的血糖波动小于IGlar,其降糖作用更为稳定。分析原因,IDegAsp 可更好的模拟生理性胰岛素的分泌模式,且克服了长效与速效胰岛素共存时出现的混合六聚体问题,降低了血糖控制变异率,有利于机体血糖的稳定管控[21]。治疗后,IDegAsp 组FINS 高于IGlar组,HOMA-IR 低于IGlar 组(P<0.05),提示IDegAsp可改善患者的胰岛功能,减少胰岛素抵抗,促进胰岛素分泌;同时,两组体重指数均大于治疗前,但IDegAsp 组体重指数小于IGlar 组,且日平均胰岛素剂量少于IGlar 组(P<0.05),说明与IGlar 相比,IDegAsp 治疗引起的体重变化相对较小,且用药剂量明显更少。此外,IDegAsp 组不良反应发生率小于IGlar 组(P<0.05),提示IDegAsp 的胰岛素相关不良风险低于IGlar。究其原因,相较于IGlar,IDegAsp 呈平坦、稳定的基础作用趋势,其作用时间更为持久,降糖疗效变异性更低,因此药物剂量相对更少,体重增加及低血糖等不良反应风险随之降低。
综上所述,IDegAsp 与IGlar 对口服降糖药控制不佳T2DM 患者均具有确切降糖作用,其中,IDegAsp 的降糖作用更为理想,其用药剂量更少,可减少胰岛素治疗引起的血糖波动及体重变化,改善胰岛功能,降低低血糖等不良风险。但受限于本次研究的纳入基数及观察时间,上述结论尚需大样本、长疗程的临床试验进一步验证。
