发热伴血小板减少综合征的死亡预测模型建立
2023-06-02刘旗旗张照如
刘旗旗,张照如
(安徽医科大学附属巢湖医院感染科,安徽 巢湖 238001)
发热伴血小板减少综合征(severe fever with thrombocytopenia syndrome,SFTS)是一种人畜共患病,最早于2010 年4 月由国家疾病控制中心(CDC)从无形体阴性的病例中检出,并于2012 年在新英格兰医学杂志上向全球通报了这类新型传染病。我国病例主要分布在河南、安徽、山东、湖北、辽宁、浙江和江苏省,其中安徽省病例较多(25.60%)[1],大部分患者为农村居民,流行月份为4 月份至8 月份,病死率为5.30%~16.20%[2]。SFTS 感染后一般以非特异性的前驱症状开始,包括发热、身体不适、头痛、肌肉痛、关节痛和头晕等,与死亡患者相关的症状为意识障碍、皮肤瘀斑、消化道出血、肺出血等。目前的研究显示病毒导致的炎症因子风暴促使多器官功能衰竭、弥散内血管内凝血和呼吸衰竭等是导致患者死亡的主要原因[3-5]。根据SFTS 的临床发生、发展及血清学变化水平,一般分为发热期、多器官功能损伤期和恢复期,发热器热程可持续6~16 d,此间可有纳差、乏力、头痛、肌肉酸痛等全身中毒症状,但并无明显特异性,多器官功能损伤期一般与发热器重叠,多数死亡病例发生于此期,死亡时间一般发生在发病后6~10 d,但由于初期症状并无特异性,患者多在家迁延数天后前来医院就诊,故部分患者入院时其血清学指标已显示多器官功能障碍。本研究主要针对SFTS 患者入院后血清学检查、生命体征与其临床转归之间的联系,并进行死亡风险预测及建立评分标准,以期为患者的早期诊治提供参考。
1 资料与方法
1.1 一般资料 选择安徽医科大学附属巢湖医院2020年6 月-2022 年6 月91 例SFTS 患者,根据预后情况将其分为生存组(71 例)与死亡组(20 例)。
1.2 诊断标准 病例诊断标准:疑似病例定义为具有流行病学史(流行季节在丘陵、林区、山地等地工作、生活或旅行史等;或发病前2 周内有被蜱虫叮咬史)、发热等临床表现,且外周血血小板及白细胞降低者。确诊病例定义为疑似病例具备下列之一者:①发热伴血小板减少综合征布尼亚病毒(SFTS)核酸检测阳性;②检测SFTS IgG 抗体阳转或恢复期滴度较急性期呈4 倍以上增高;③分离到SFTSV。
1.3 资料收集 收集患者人口学及临床资料。人口学资料:年龄、性别、职业、基础疾病等;临床表现:发热时间、热程等;辅助检查结果:检测患者入院首诊时的白细胞计数(WBC)、中性粒细胞(NE)、淋巴细胞计数(LYM)、肝脂酶(HL)、降钙素原(PCT)、肌钙蛋白Ⅰ(cTNⅠ)、淀粉酶(AMY)、脂多糖(LPS)、血小板计数(PLT)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、肌酸磷酸激酶(CK)、肌酸磷酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、球蛋白含量(GLOB)、尿素氮(BUN)、肌酐(Cr)等实验室指标结果,相关心电图、超声、影像学检查结果等;SFTS 患者临床治疗及转归情况。
1.4 统计学方法 使用SPSS 24.0,Graphpad prism 4.0.2统计学软件进行数据分析。符合正态分布的计量资料采用()表示,行t检验;不符合正态分布的计量资料采用[M(Pmin~Pmax)],行Mann-WhitneyU检验,单因素分析有统计学意义的危险因素进入二元Logistic 回归分析。考虑具体临床实践最终形成理想的风险预测模型,该模型预测能力通过对模型的拟合优度和预测准确度进行检验。通过比较模型的预测事件和实际事件的发生和不发生的频率来检测拟合优度。选用Hosmer-Lemeshow 统计量来检验,P>0.05 表明该模型的拟合效果好,预测值和实际观察值相近。使用GraphPad Prism 4.0.2 绘制相关危险因子的嵌套巢式柱状图,选用ROC 曲线来检验,根据死亡风险预测模型中危险因素的回归系数β值,按照四舍五入原则确立每个危险因素的实际赋值。
2 结果
2.1 一般资料 SFTS 患者血清学检验结果见表1,既往史中有16 例患有高血压,14 例患有糖尿病,7 例患有冠心病,11 例出现肺部感染。
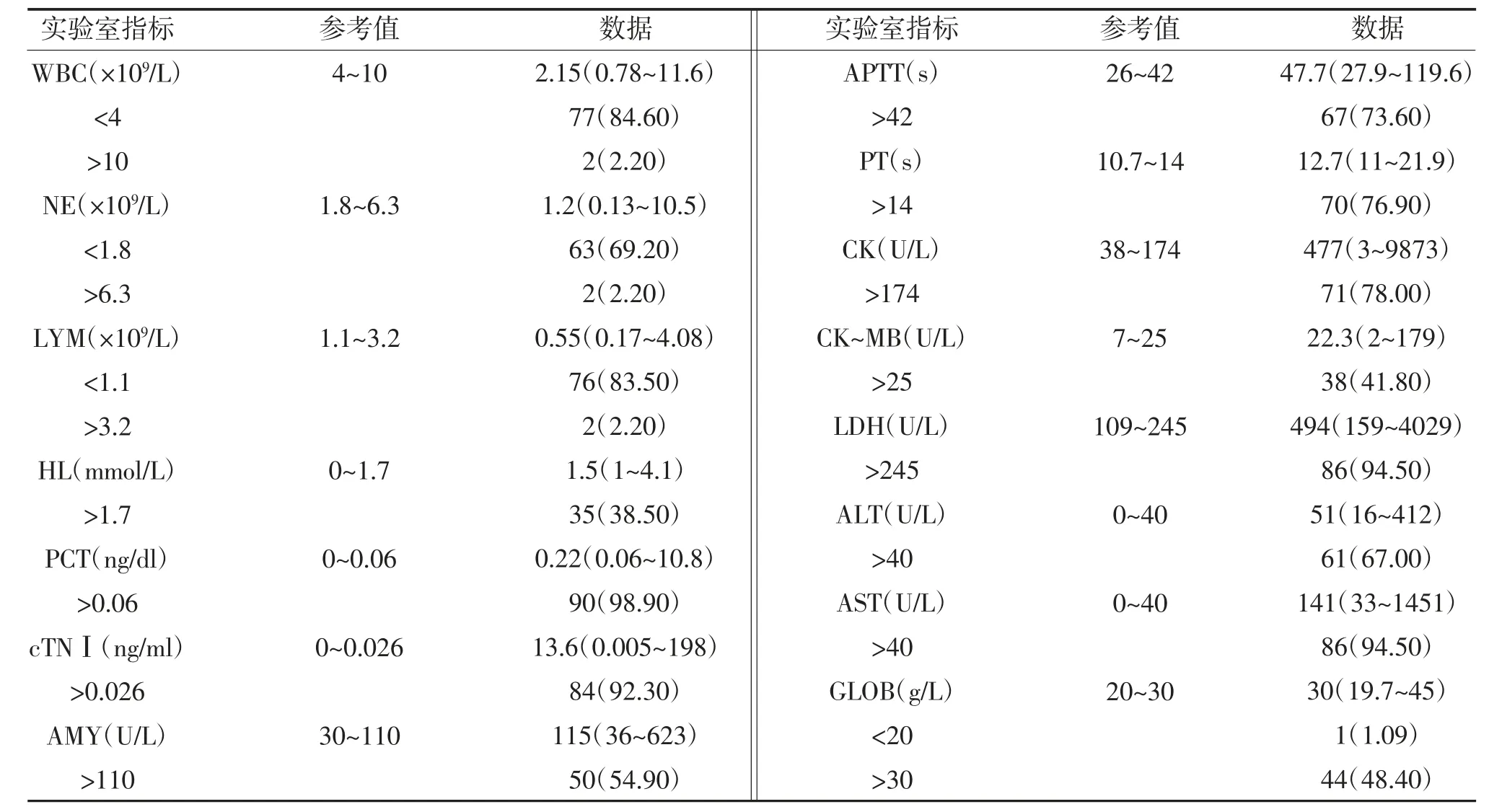
表1 一般资料[M(Pmin~Pmax),n(%)]
2.2 SFTS 患者死亡的单因素分析 生存组与死亡组LYM、Cr、年龄、中热、高热时间及热程比较,差异有统计学意义(P<0.05);两组其余血清学检验指标及相关生命体征参数比较,差异无统计学意义(P>0.05),见表2。
表2 患者死亡的单因素分析[M(Pmin~Pmax),]
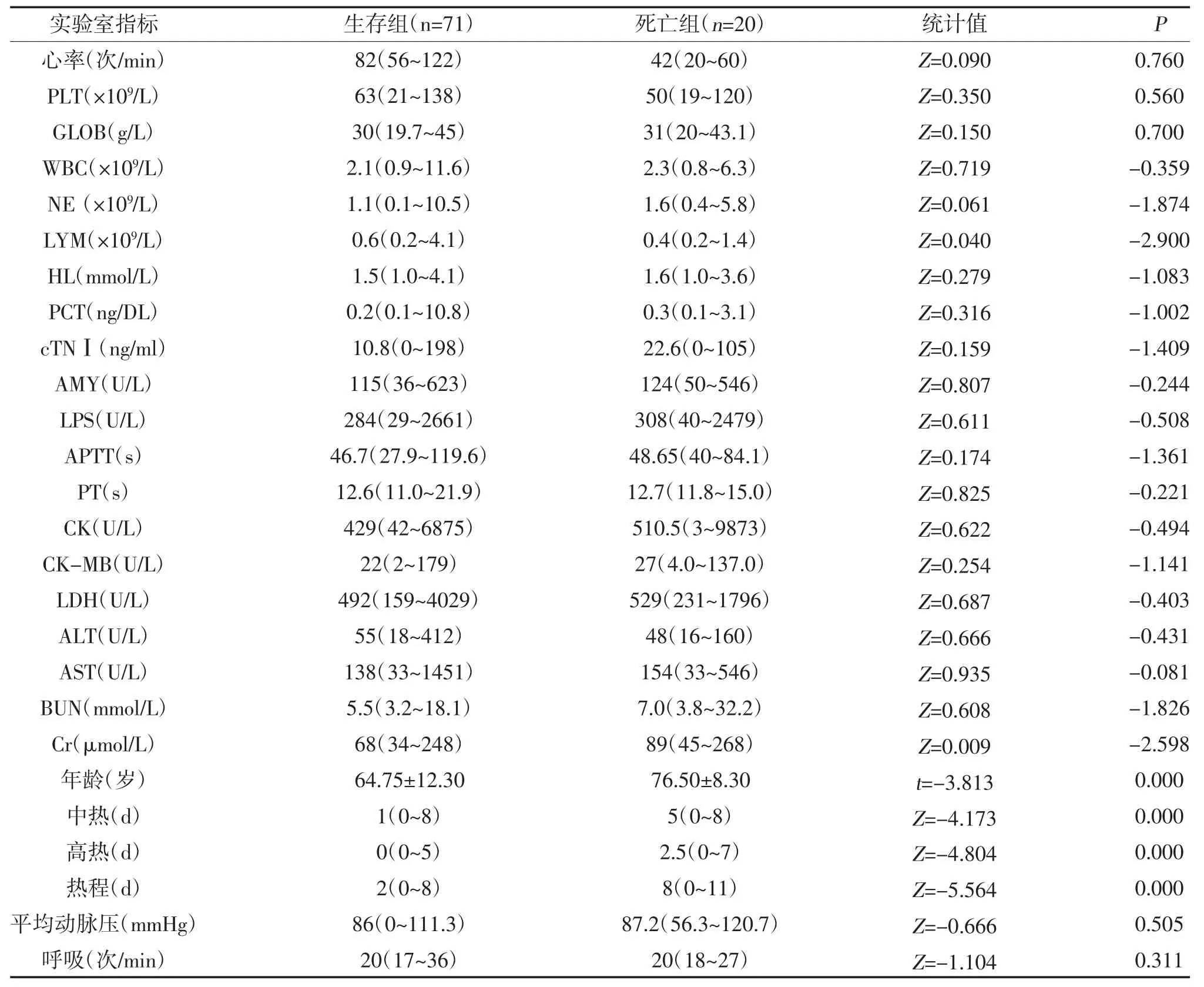
表2 患者死亡的单因素分析[M(Pmin~Pmax),]
2.3 SFTS 患者死亡的多重共线性检验 将单因素中有统计学意义的6 个因素纳入二元Logistic 分析,进行二元Logistic 分析前,上述待选危险因素先进行多重共线性检验,方差膨胀因子(VIF)的值越大,说明变量间的多重共线性程度越强,一般认为VIF>5 的因素之间具有强共线性。检验后5 个危险因素的VIF 值没有达到5。据此,5 个危险因素进入二元Logistic 回归分析,见表3。
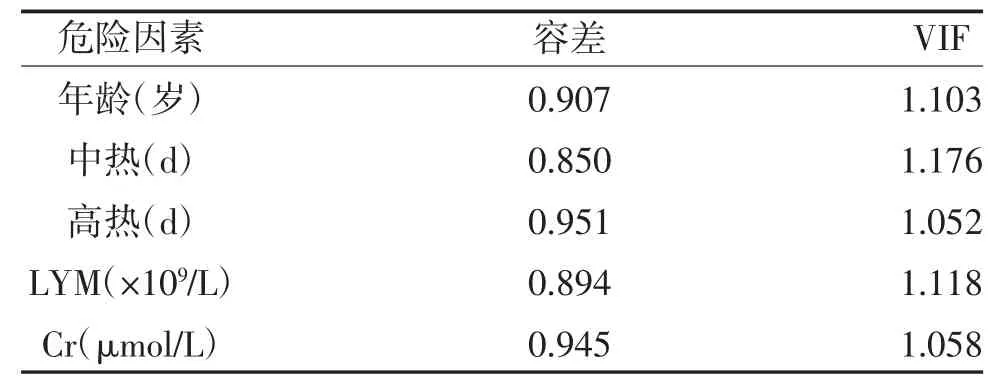
表3 SFTS 患者死亡的多重共线性检验
2.4 SFTS 死亡风险预测模型建立 经过单因素分析所筛选出的5 个危险因素进入二元Logistic 回归分析,结合临床特征与SFTS 疾病特点,筛选出最佳模型。SFTS 患者死亡的独立危险因素为:年龄(OR=1.139,95%CI:1.014~1.280)、中热(OR=1.671,95%CI:1.188~2.351)、高热(OR=2.954,95%CI:1.638~5.327),见表4。通过Logistic 回归方程并考虑临床特征最终形成风险预测模型的数学方程式:P=ea(1+ea),a=-13.427+1.083×高热+0.514×中热+年龄×0.180。其中e为指数函数,P 为患者发生在院死亡的概率。依据二元Logistic 回归所得出的结果,其中年龄、中热、高热为发热伴血小板减少综合征的独立危险因素,将本组病例代入多指标巢式嵌套图(图1)。
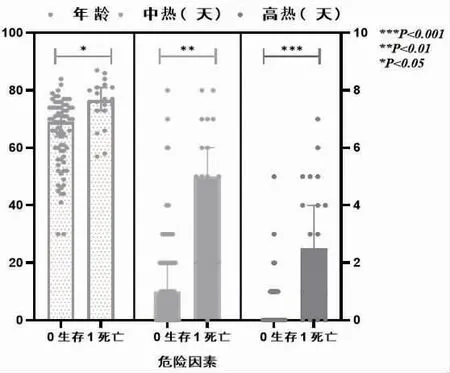
图1 死亡危险因素的巢式嵌套图

表4 SFTS 患者死亡风险二元Logistic 回归分析
2.5 SFTS 死亡风险预测模型检验 对回归模型进行拟合优度和预测准确度检验,拟合优度使用Hosmer-Lemeshow 统计量检验,当P>0.05 时证明模型拟合效果好。本模型检验效果为:χ2=9.637,df=8,P=0.291。结果表明,预测值与实际观察值相近,模型的拟合效果较好。ROC 曲线下面积A=0.948,SD=0.131(95%CI:0.891~1.000,P<0.05),敏感性为95.0%,特异性为90.1%(图2)。当A>0.5 时,A 越接近1 说明预测模型的诊断准确越高。0.5<A≤0.7 表示诊断价值较低,0.7<A<0.9 表示诊断价值中等,A>0.9 表示较高的诊断价值。该模型对于SFTS 患者的死亡风险预测准确度较高。

图2 SFTS 患者死亡曲线预测模型ROC 曲线
2.6 评分标准建立 依据风险预测模型中的各个危险因素权重系数β,按照同比例放大的原则构建SFTS患者死亡风险的评分标准见表5。依据评分标准可进行SFTS 患者死亡风险评分,最低0 分,最高10 分。总分数在0~3 分为低风险,在4~10 分为高风险。

表5 SFTS 死亡风险评分
2.7 风险预测模型验证 根据已经建立的模型进行评分,死亡率在低风险(0~3 分)、中风险(4~6 分)及高风险(7~10 分)的死亡率分别为:4.50%、61.50%、81.80%。进行线性评估死亡率(图3),证明本死亡风险预测模型及死亡风险等级评分的准确性较好。

图3 SFTS 死亡风险预测模型检验组合图
3 讨论
SFTSV 的基因组为负链单链RNA,主要包括3个片段(S、M、L),其中L 片段主要编码依赖于RNA的RNA 聚合酶,促进病毒RNA 的复制与转录;M片段编码病毒表面糖蛋白前体Gn、Gc,其对于病毒和细胞膜的低pH 依赖性融合至关重要[6];而S 蛋白编码核衣壳蛋白(NP)和非结构蛋白(NSS)等。目前研究表明由S 段编码的NSS 在病毒进入宿主细胞后可干扰IFN-β 的生成,同时通过TPL2 信号通路诱导细胞因子IL-10 在短期内大量产生[7],促使早期病毒的大量繁殖,抑制宿主的先天免疫反应等。NSS还可与宿主中的蛋白TBK1 相互作用,从而激活NF-κB 信号、引起炎症细胞的过度激活、细胞因子风暴的形成等[8]。
SFTS 的发病机制尚不明确,通过对患者的横断面研究发现:病毒在急性期首先通过糖蛋白Gn、Gc进入巨噬细胞与树突状细胞[6],在其中大量增殖的同时,激发NK 细胞、单核细胞释放大量的细胞因子与炎性物质[9],其中包括IFN-c、IFN-1、TNF-a、IL-6、IP-10、IL-10、HSP70 和G-CSF。IFN-1 基因的表达被病毒过度激活,其单核细胞表现出最强的干扰素反应,加快了细胞因子的风暴的发展。在病毒大量释放入血后,特异性免疫应答受到了病毒及其产生的非结构蛋白NSS 抑制,一方面病毒主要感染了浆细胞,患者不能产生特异性抗体IgG[10],另一方面抗原提呈细胞在早期遭受了大量的破坏,特别是淋巴细胞与NK 细胞在早期的大量凋亡机制仍不明确,即使是浆细胞产生了针对病毒糖蛋白的特异性抗体,含有病毒颗粒的NSS 也能通过旁分泌的方式被临近细胞内吞,从而进行非受体依赖性的传播,并且在血液中被抗体中和的时间窗极小[11]。
SFTS 的潜伏期一般为7~14 d,早期的症状并无特异性,包括发热、头晕、头痛、乏力、纳差、肌痛、恶心呕吐等[12,13],这也是本研究并未纳入症状相关危险因素的原因,本研究证明发热时间与患者的预后在统计学上有意义:中热(OR=1.671,95%CI:1.188~2.351)、高热(OR=2.954,95%CI:1.638~5.327)均是其危险因素。年龄(OR=1.139,95%CI:1.014~1.280)作为危险因素在本研究中也得到了验证,这提示针对老年入院患者的不良预后风险层级更高。同样的,相关研究发现死亡患者的细胞因子载量随着病毒RNA 的低度而变化,病毒滴度越高,多器官功能障碍越重,相关指标:ALT、AST、CK、PLT、BUN 和LDH、APTT 均明显升高[14],其中血小板减少为多因素造成[15],同样预示着死亡风险的提高。
SFTS 没有特异性的治疗方法,从病毒感染患者的血清中提取的抗体在体外和动物研究中能有效抑制病毒的复制,但尚未进行临床试验[16]。利巴韦林和法匹拉韦通过动物实验与回顾性研究被证实可降低重症患者死亡率,但利巴韦林在病毒载量>1×106copies/ml 的分组中并未观察到治疗效果[17],法匹拉韦对于高龄病例(>70 岁)也未见到统计学差异[18]。一项回顾性研究显示钙离子阻滞剂可有效降低SFTS 患者的死亡率,最高可达5 倍,其作用机制可能是阻滞了病毒感染所需钙离子通道有关[19]。早发现、早诊断、早治疗对于重症患者是否能够治愈有着决定性的作用,高水平的病毒复制是老年患者短期内症状加重,病情进展迅速的主要机制,早期阻滞病毒的大量复制或许是今后的治疗方向之一。在日本,对出现神智不清的发热伴血小板患者进行类固醇冲击治疗也获得了良好的疗效[20],在疾病早期进行抑制炎症的相关治疗佐证了细胞因子风暴的理论体系。
本风险预测模型以患者的年龄与发热时间为主要诊断依据,在患者入院之后的第一时间内即可判断病情的转归。于年龄较大的患者来说,由于症状变化极快与临床资料的欠缺,本预测模型并未纳入相关症状以减少预测的误差,对于中、高风险的确诊患者来说,入院后即应开始进展抗病毒与体液支持治疗,必要时进行大剂量激素冲击,一旦患者进入多器官功能障碍期后,其细胞因子风暴会形成正反馈调节,此时进行治疗的收效甚微。
综上所述,年龄、中热与高热时间是SFTS 患者死亡的独立危险因素,且年龄越高,发热时间越长,患者的死亡风险越高。
