噻虫嗪及其代谢物噻虫胺在茶树菇及其菌棒上的残留及消解动态
2023-06-02罗雪婷李秋梅潘洪吉
尹 硕,罗雪婷,李秋梅,潘洪吉,吴 迪
(北京市植物保护站,北京 100029)
茶树菇学名柱状田头菇(Agrocybeaegerita),此真菌多野生于油茶树枯干,故得名茶树菇。茶树菇不仅食用味道独特鲜美,且蛋白质含量高、富含多种氨基酸及B族维生素[1],具有较高的食药用价值,市场前景广阔。茶树菇栽培过程中极易受到菇蚊、菇蝇、螨虫、杂菌等有害生物的危害,其中以菇蚊、菇蝇发生普遍且严重,防治不及时可极大地影响产量甚至绝收[2-4]。
我国登记在食用菌上的农药产品共有45个,涉及农药有效成分18种,食用菌:氯氟·甲维盐(有效成分为:高效氯氟氰菊酯和甲氨基阿维菌素苯甲酸盐),蘑菇:噻菌灵,噻霉酮和咪鲜胺锰盐,平菇:吡唑醚菌酯,代森联,二氯异氰尿酸钠(可溶粉剂),三十烷醇,灭蝇胺,赤霉酸和春雷霉素,双孢菇:呋虫胺和吡丙醚,香菇:咪鲜胺,灵芝:多菌灵,菇房:腐霉利,百菌清和二氯异氰尿酸钠(烟剂)。其中在食用菌上登记的仅有1 种杀虫剂氯氟·甲维盐乳油,很难满足生产需要。
噻虫嗪作为种第二代新烟碱类高效低毒杀虫剂,对害虫具有胃毒、触杀及内吸活性,可有效防治蚊蝇类等害虫[5]。JMPR报告中规定噻虫嗪的风险评估定义为噻虫嗪和噻虫胺[6]。噻虫胺既是噻虫嗪的主要代谢产物,也是一种登记使用的新烟碱类杀虫剂[7-8]。我国尚未制定噻虫嗪及其代谢物噻虫胺在食用菌中的残留测定方法及相应的限量标准。目前国内外对噻虫嗪及其代谢物的残留检测方法主要有液相色谱法[9-10]、液相色谱串联质谱法[11-15]等,对其在茶树菇中农药残留的研究尚未见报道。本研究利用液相色谱-质谱联用法(LC-MS/MS)同时针对茶树菇和及其菌棒中噻虫嗪及其代谢物噻虫胺农药残留进行了检测,并对其残留消解动态及最终残留进行了研究,旨在为其科学合理使用以及制定最大残留限量(MRL)标准提供依据。
1 材料与方法
1.1 仪器及试剂 LC-MS 8045型三重四级杆液相色谱质谱联用仪;TDL-40B低速台式大容量离心机;RJ-TDL-40B低速台式离心机;DFY-500C型粉碎机;QL-901旋涡混合器。
噻虫嗪(thiamethoxam)、噻虫胺(clothianidin)标准品:国家农药质检中心 (沈阳);30%噻虫嗪悬浮剂。
乙腈,色谱纯;C18、PSA:40~63 μm;无水硫酸镁、氯化钠,分析纯。
1.2 田间试验
1.2.1 消解动态试验 试验小区面积5 m2,设立2个重复小区,每个小区菌棒数约为400个,出菇后喷雾施药1次;施药剂量噻虫嗪0.009 g a.i./m2,分别于施药后2 h及1、2、3、5、7、10、14、21、28 d取蘑菇和菌棒样品。
1.2.2 最终残留试验 设4个不同施药剂量和不同施药次数的小区,每个小区面积5 m2,菌棒数量约400个,以噻虫嗪有效成分0.009、0.013 5 g a.i./m2的计量施药2~3次,施药间隔期7 d。于末次施药间隔3、5、7、10 d取茶树菇和菌棒样品。另设对照区,不施药,采集对照样品。
1.2.3 采样方法 茶树菇的采集:在试验小区内以“对角线法”取不同位置采集12个点的生长正常的茶树菇样本,总量≥1 kg,粉碎混匀后四分法缩分,装入封口样品容器中,于-20℃保存,待测。
菌棒的采集:在小区内选择对角线上6个点,取走整包菌棒。菌棒从出菇顶分为上(0~5 cm),中(5~10 cm),下(10~15 cm)三段,分别粉碎,装入封口样品容器中,于-20℃保存,待测。
1.3 样品前处理方法 称取茶树菇样品10 g,加入10.0 mL乙腈、3 g氯化钠,涡旋5 min,以3 800 r/min离心5 min,取1 mL上清液,加入50 mg C18、50 mg PSA、50 mg无水MgSO4,涡旋1 min,取上清液过0.22 μm有机系滤膜,待LC-MS/MS分析测定。
称取菌棒样品5 g,加入25.0 mL乙腈、3 g氯化钠,涡旋5 min后提取净化,步骤同上。
1.4 仪器分析测定条件 液相色谱条件:使用Athena C18-WP 3.0 μm×2.1 mm×50 mm,柱温为40℃,进样体积1 μL。流动相为(A)0.1%甲酸水溶液和(B)乙腈,流速为0.3 mL/min,流动相比例(V/V)为A∶B =20∶80。
质谱条件:电喷雾电离源(ESI),正负离子模式,多反应监测(MRM);离子源温度:300℃;DL管温度:250℃;加热块温度:400℃;雾化气流速:3.0 L/min;干燥气体流速:10 L/min;加热气流速:10 L/min。定性定量检测参数(表1)。
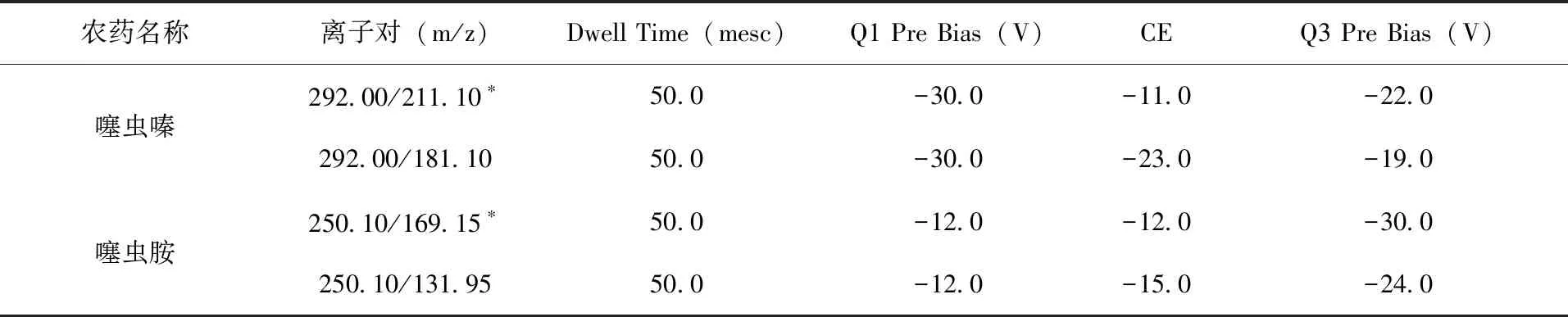
表1 噻虫嗪和噻虫胺主要质谱检测参数
1.5 方法学验证 准确称取噻虫嗪、噻虫胺标准品各0.010 0 g(精确至0.000 1 g),用乙腈溶解并定容于10 mL容量瓶中,配成质量浓度1 000 mg/L的标准储备液,于-20℃冰柜中避光保存。为降低基质效应的影响,本文采用农药残留检测领域常用的基质匹配校准法进行定量分析[16]:分别用茶树菇、菌棒的空白提取溶液稀释标准储备液,配制成0.01、0.02、0.05、0.1、0.5 mg/L的茶树菇基质匹配标准工作液和0.004、0.008、0.02、0.04、0.2 mg/L的菌棒基质匹配标准工作液,以质量浓度为横坐标,以定量离子峰面积响应值为纵坐标,绘制标准曲线。
在空白茶树菇、菌棒样品中添加3 个水平的噻虫嗪、噻虫胺标准溶液,每个水平重复5 次。空白茶树菇样品中添加水平为0.01、0.05、0.10 mg/kg;空白菌棒样品中添加水平为0.02、0.10、1.00 mg/kg,计算添加回收率及相对标准偏差(RSD)。
2 结果与分析
2.1 方法有效性评价 由表2可知,在线性范围内,噻虫嗪、噻虫胺在茶树菇及其菌棒中的峰面积与其质量浓度间呈良好的线性关系,其标准曲线(图1、2),R2均>0.999,能够满足本试验定量分析的要求。按照添加回收的最低浓度确定方法的定量限,则噻虫嗪、噻虫胺在茶树菇和菌棒样品上的定量限(LOQ)分别为0.01和0.02 mg/kg。

表2 噻虫嗪、噻虫胺在茶树菇和菌棒基质中的线性方程、决定系数及定量限
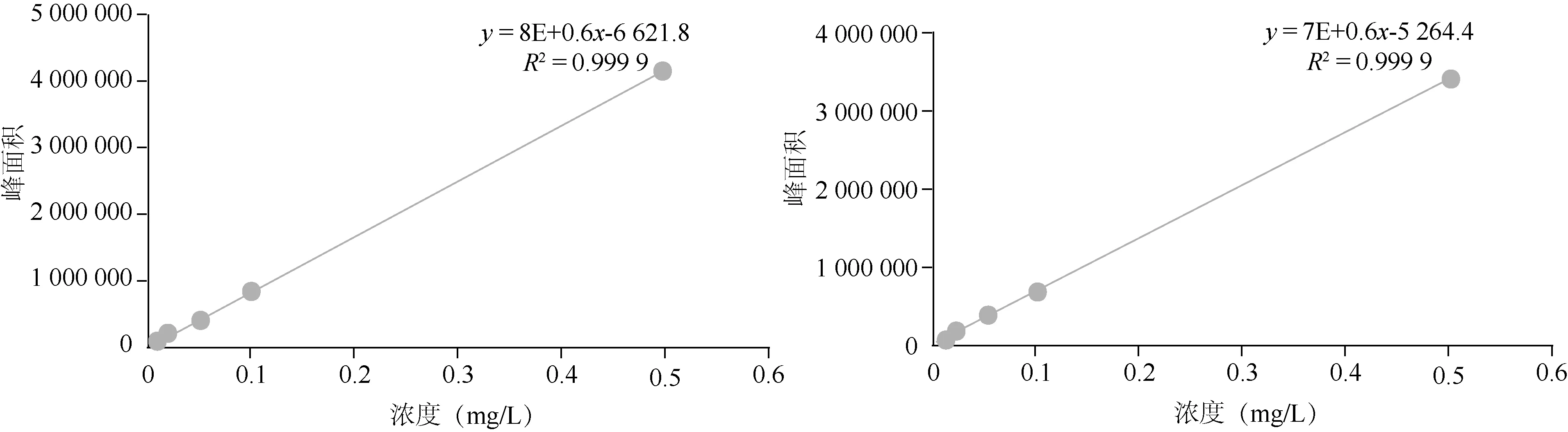
图1 噻虫嗪、噻虫胺在茶树菇基质中的标准曲线
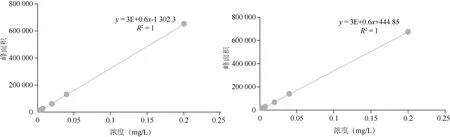
图2 噻虫嗪、噻虫胺在菌棒基质中的标准曲线
噻虫嗪、噻虫胺在茶树菇、菌棒中的添加回收率结果(表3)。由表3可知:噻虫嗪、噻虫胺在茶树菇上平均回收率为97%~100%、98%~101%,RSD 在0.7%~2.0%之间;菌棒平均回收率在96%~102%、97%~103%,RSD 在1.4%~4.2%之间。(图3~图8)分别为基质空白、基质标准溶液及噻虫嗪、噻虫胺添加回收质谱图,其准确度、精确度符合农药残留分析标准的要求[17]。
2.2 消解动态 结果表明(表4),噻虫嗪在茶树菇上消解过程符合一级动力学模型,消解曲线为y= 0.058 3 e-0.392x(R2=0.615 3),(图9);半衰期分别为1.77d,其噻虫嗪的代谢物噻虫胺在茶树菇和菌棒中残留量均<定量限。
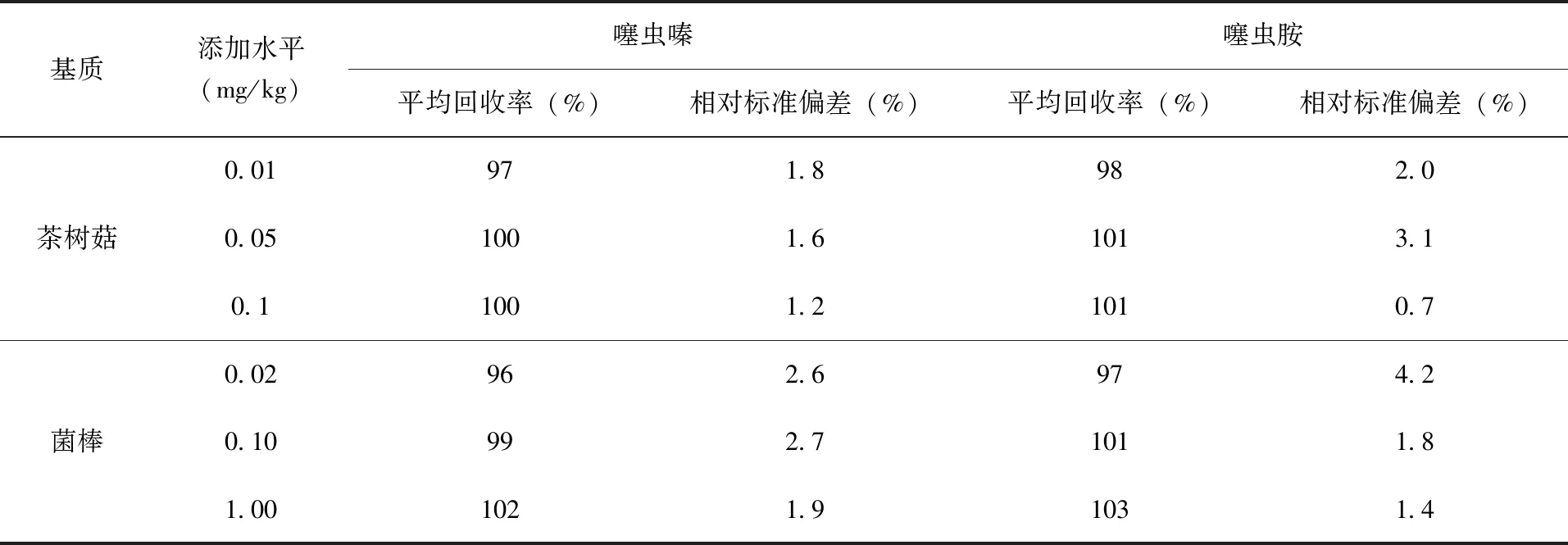
表3 噻虫嗪、噻虫胺在茶树菇和菌棒中的添加回收率及相对标准偏差

图4 茶树菇基质标准溶液质谱图(噻虫嗪0.1 mg/L +噻虫胺0.1 mg/L)
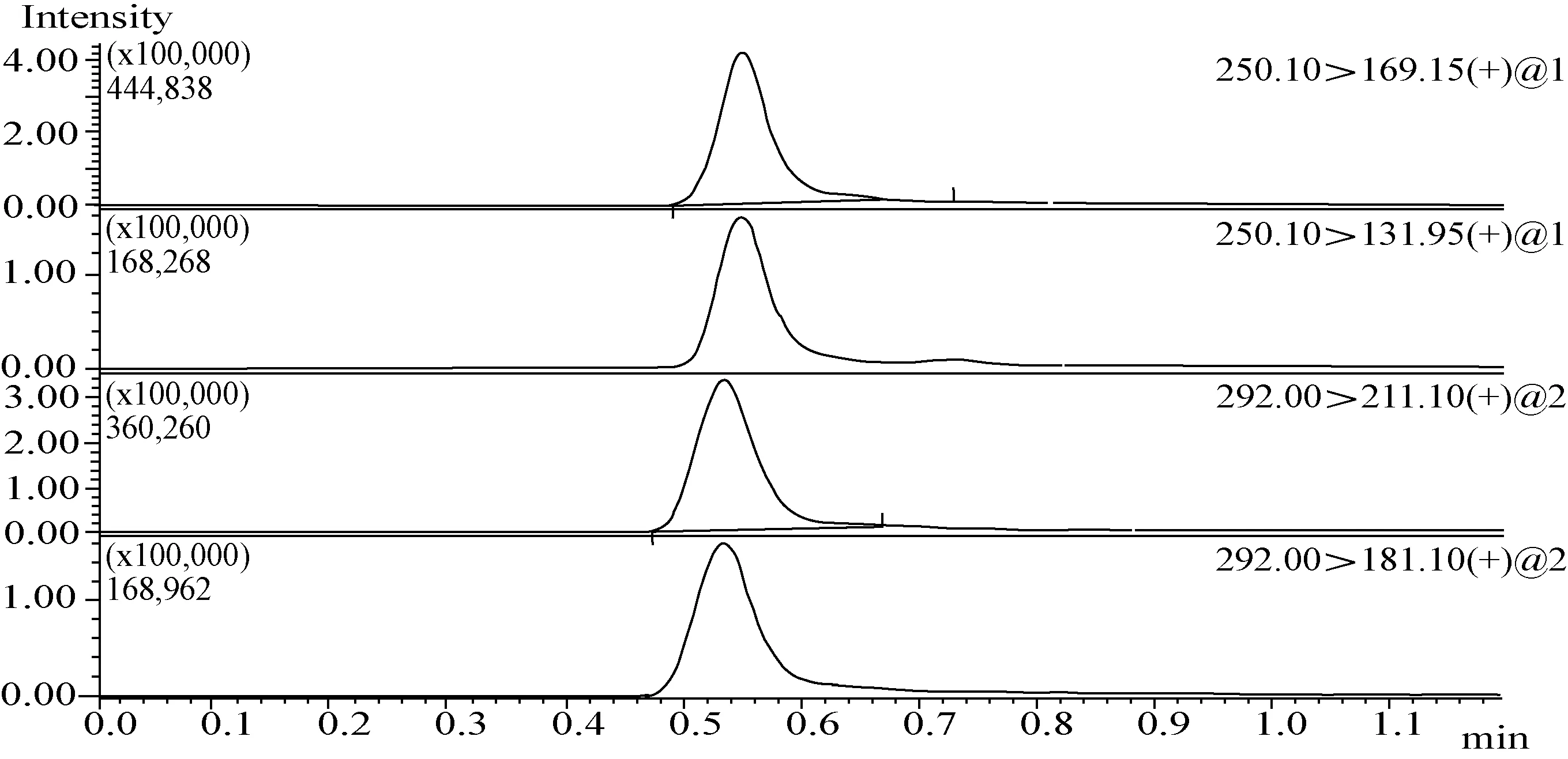
图5 茶树菇添加回收样品质谱图(噻虫嗪0.1 mg/L +噻虫胺0.1 mg/L)

图6 菌棒基质空白溶液质谱图
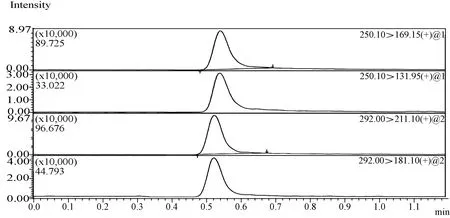
图7 菌棒基质标准溶液质谱图(噻虫嗪1 mg/L +噻虫胺1 mg/L)
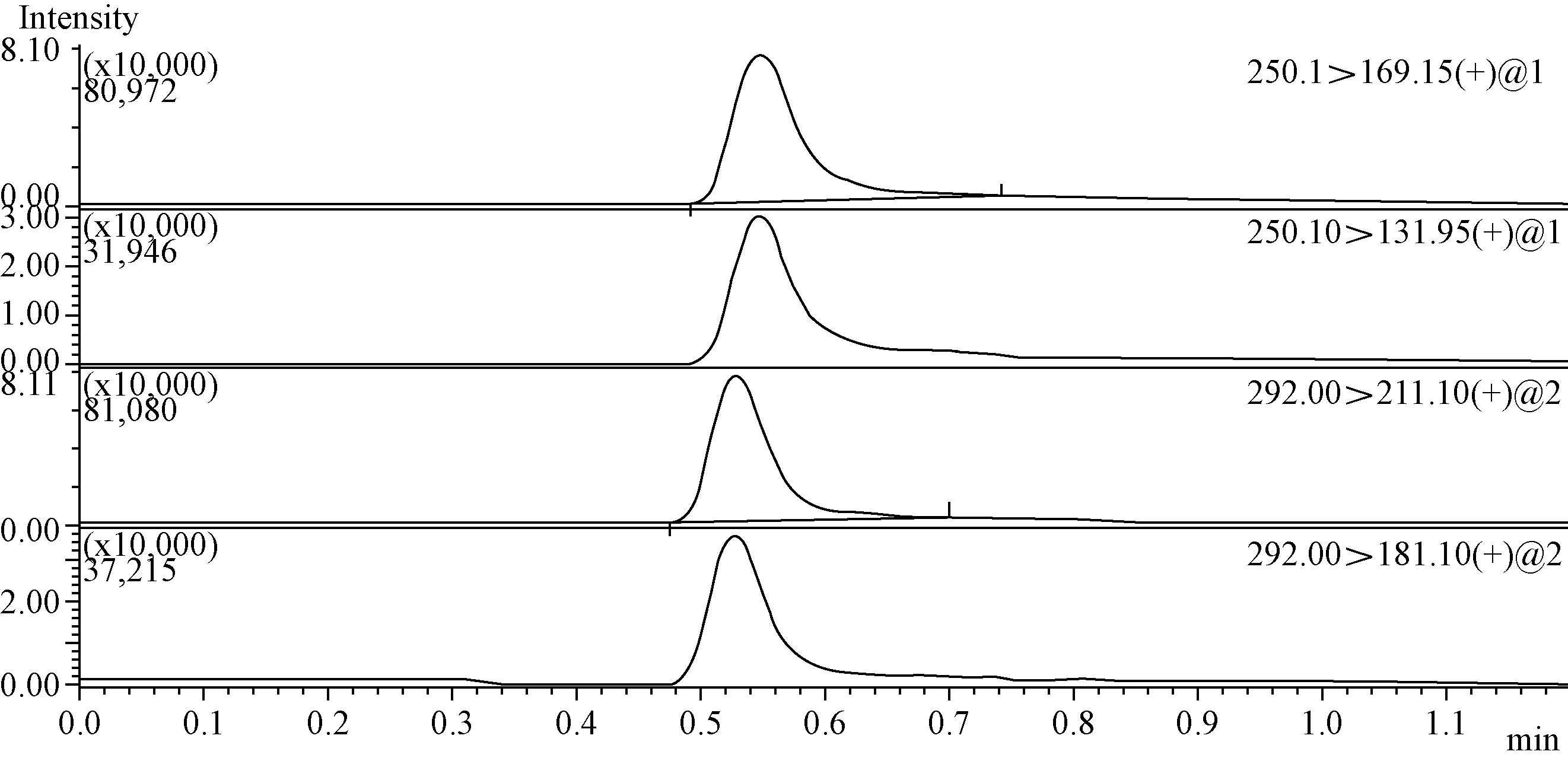
图8 菌棒添加回收样品质谱图(噻虫嗪1 mg/L +噻虫胺1 mg/L)
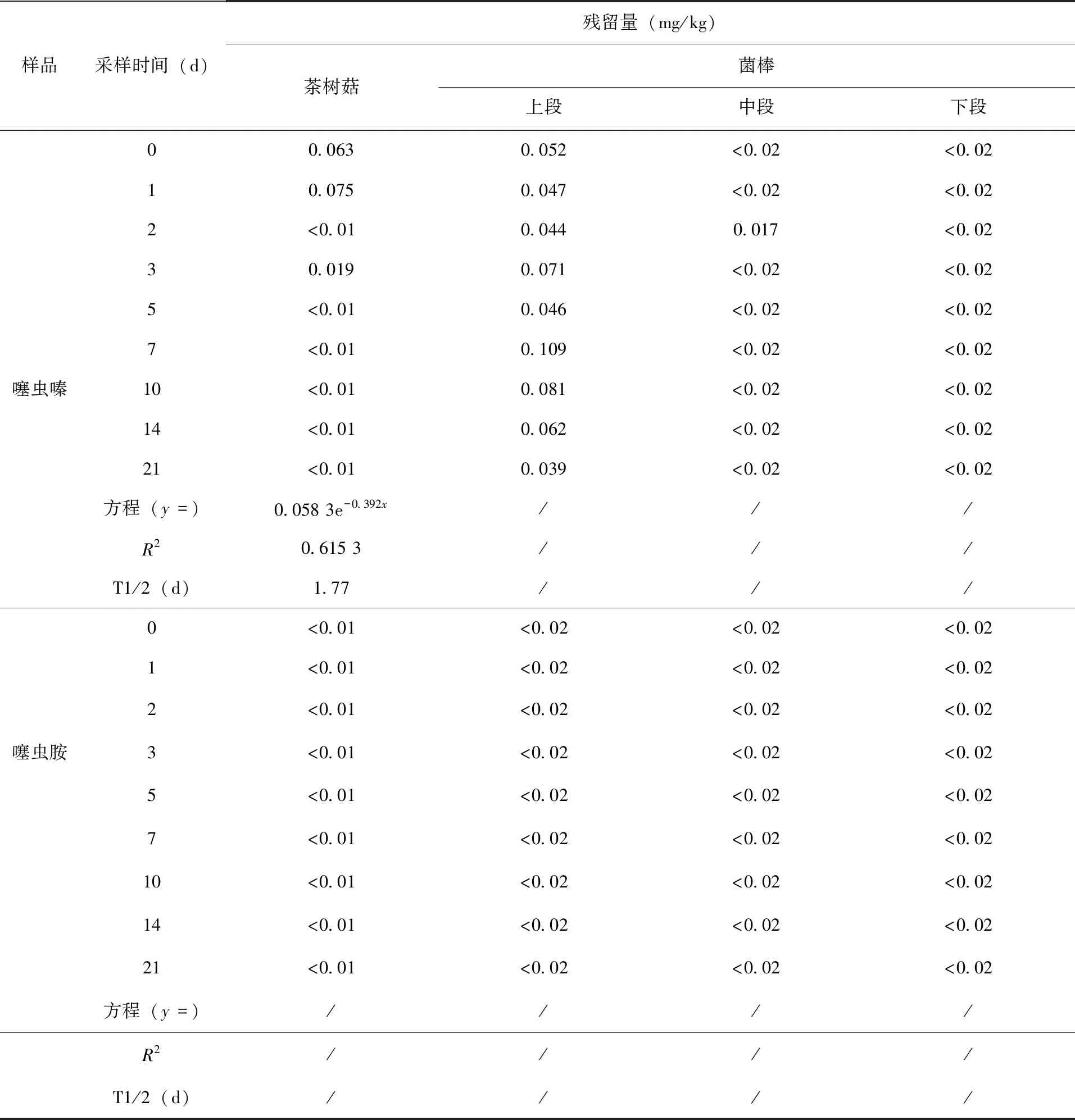
表4 噻虫嗪、噻虫胺在茶树菇、菌棒上的消解动态数据(mg/kg)
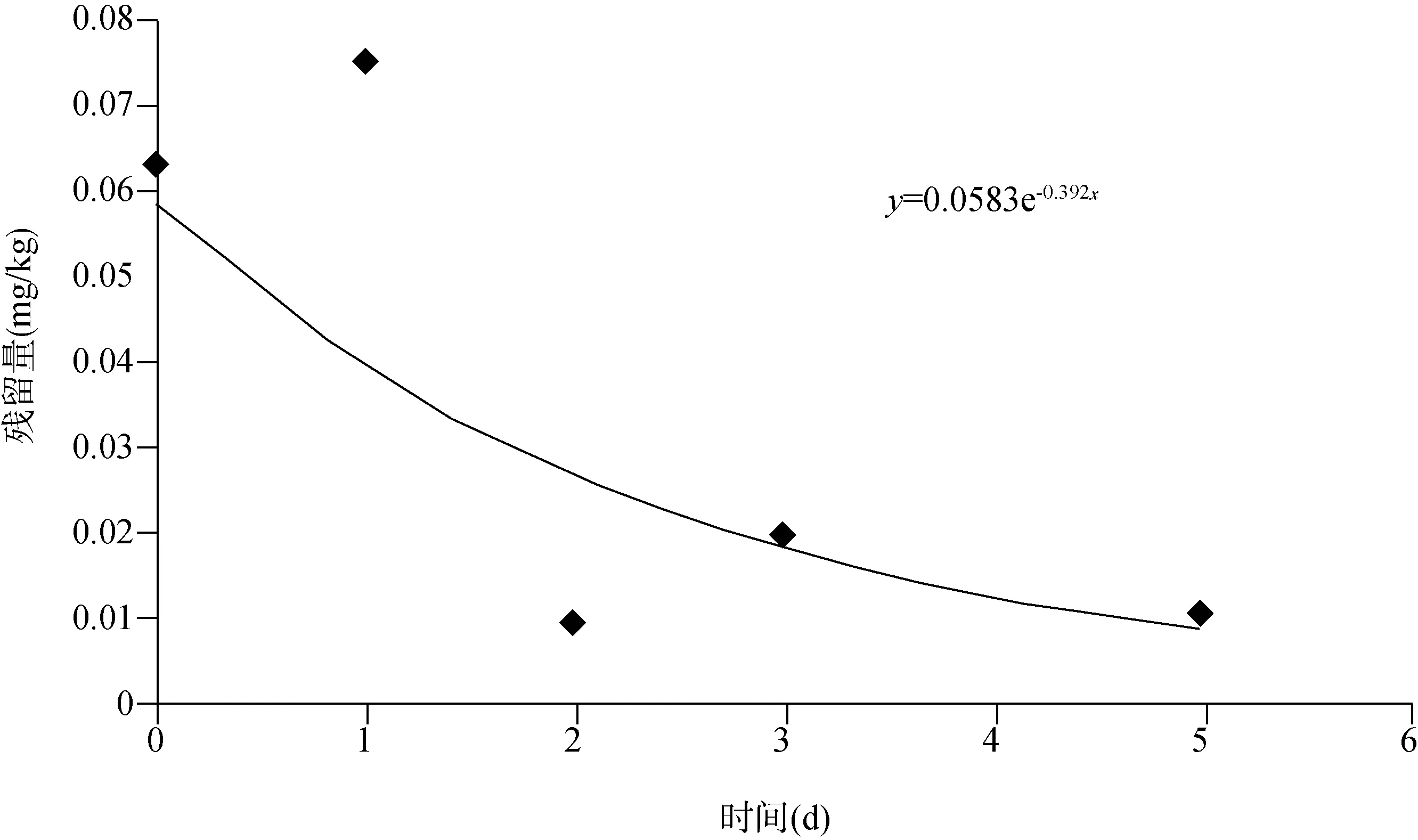
图9 噻虫嗪在茶树菇中的消解动态曲线
2.3 最终残留结果 最终残留试验检测结果(表5)表明,30%噻虫嗪悬浮剂以90~135 g a.i./hm2的剂量,施药2~3次,用药3~10 d后,噻虫嗪在茶树菇中的残留量< 0.01~0.018 mg/kg,在菌棒上段残留量< 0.02~0.129 mg/kg,在菌棒中段和下段残留量< 0.02 mg/kg;噻虫嗪代谢物噻虫胺在茶树菇及菌棒中的残留量均< 定量限,其典型最终残留质谱图(图10、11)所示。
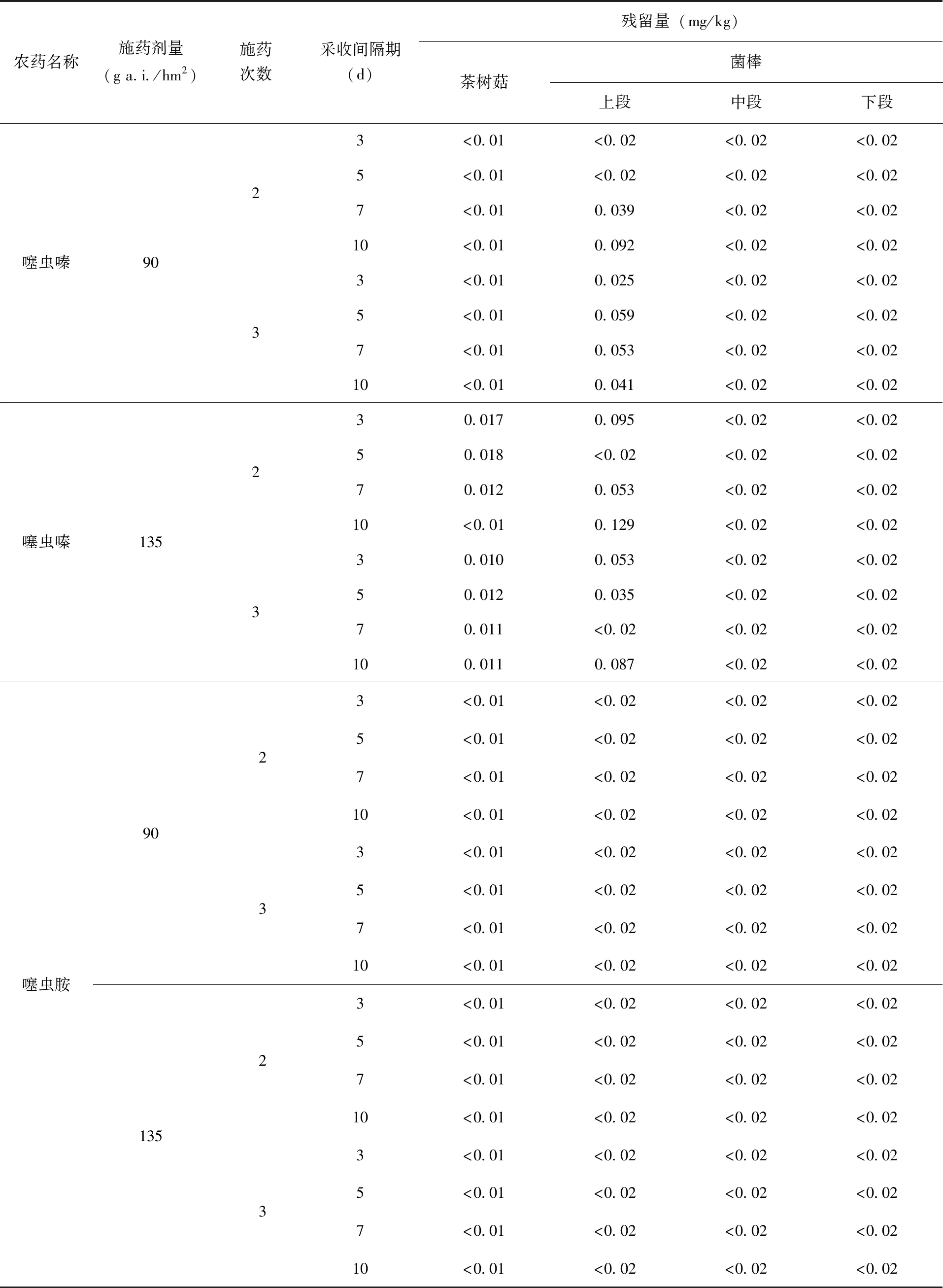
表5 噻虫嗪、噻虫胺在茶树菇、菌棒上的最终残留数据(mg/kg)
2.4 膳食风险评估 噻虫嗪的ADI值为0.08 mg/kg b.w.,噻虫胺的ADI值为0.1 mg/kg b.w.[18]。根据噻虫嗪和噻虫胺在中国登记使用情况[19]以及居民人均膳食结构调查数据[20],结合本试验得到的残留试验结果及茶树菇实际生长情况进行膳食风险评估,选用采收间隔期3 d时噻虫嗪HR值 0.018 mg/kg,噻虫胺HR值 0.01 mg/kg,进行膳食风险评估,噻虫嗪和噻虫胺在所有登记作物中的长期膳食摄入评估(表6、7),计算得出:一般人群噻虫嗪的国家估算每日摄入量(NEDI)为2.90 mg,占日允许摄入量(5.04 mg)的57.6%,噻虫胺的国家估算每日摄入量(NEDI)为0.67,占日允许摄入量(6.3 mg)的10.7%,<100%,不会对一般人群健康造成不可接受的风险。目前,中国和CAC均尚未制定噻虫嗪和噻虫胺在茶树菇中的MRL值。根据膳食风险评估结果和中国农产品及食品中农药最大残留限量制定指导原则,结合施药剂量和采收间隔期(3 d)的HR值,初步建议推荐噻虫嗪在茶树菇上登记使用安全间隔期为3 d,MRL值可暂定为0.05 mg/kg;噻虫胺在茶树菇上登记使用安全间隔期为3 d,MRL值可暂定为0.05 mg/kg(具体试验还需相关部门进一步验证)。
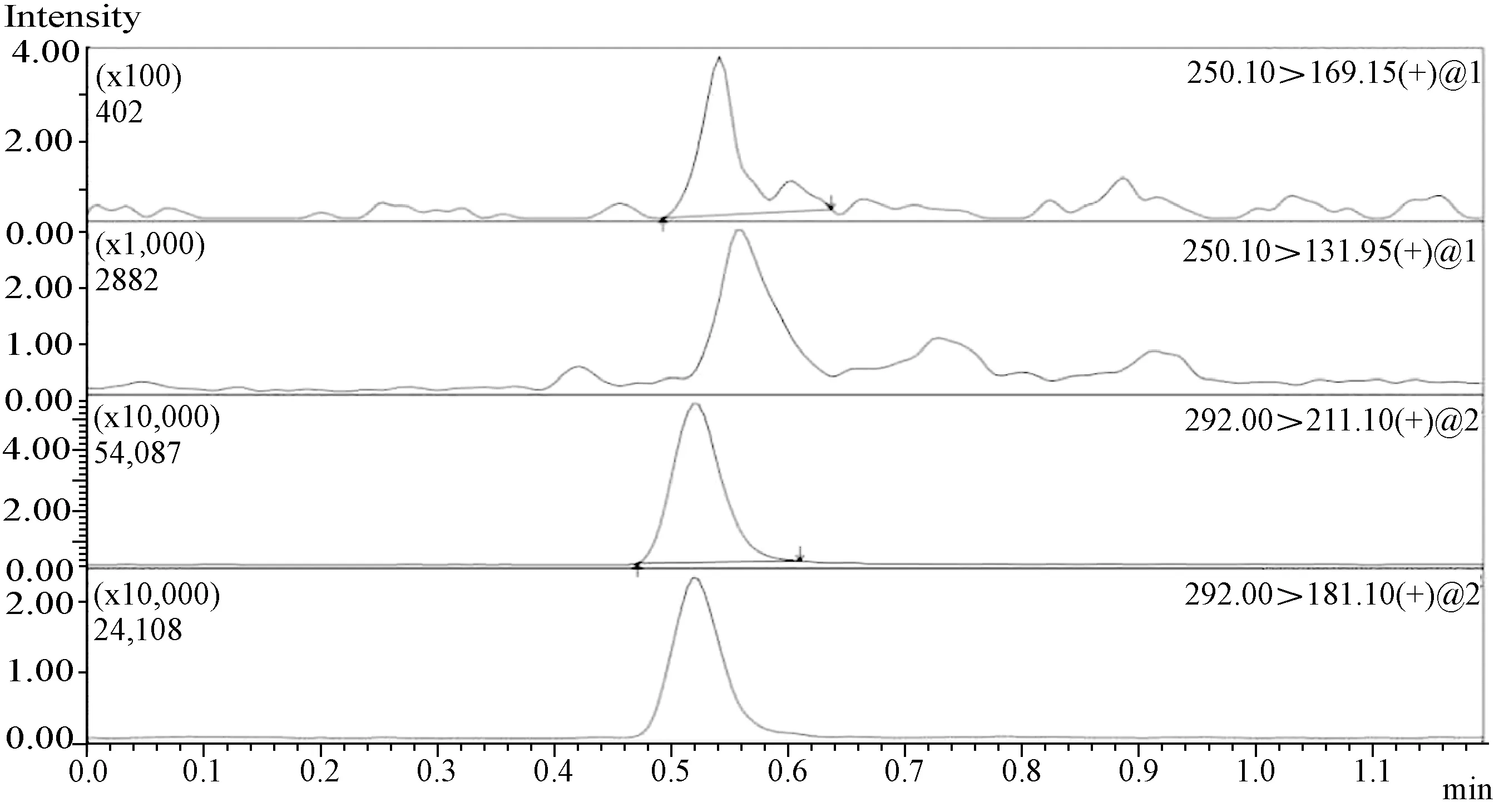
图10 噻虫嗪、噻虫胺在茶树菇上的最终残留质谱图(135 g a.i./hm2,施药2次,用药5 d取样)
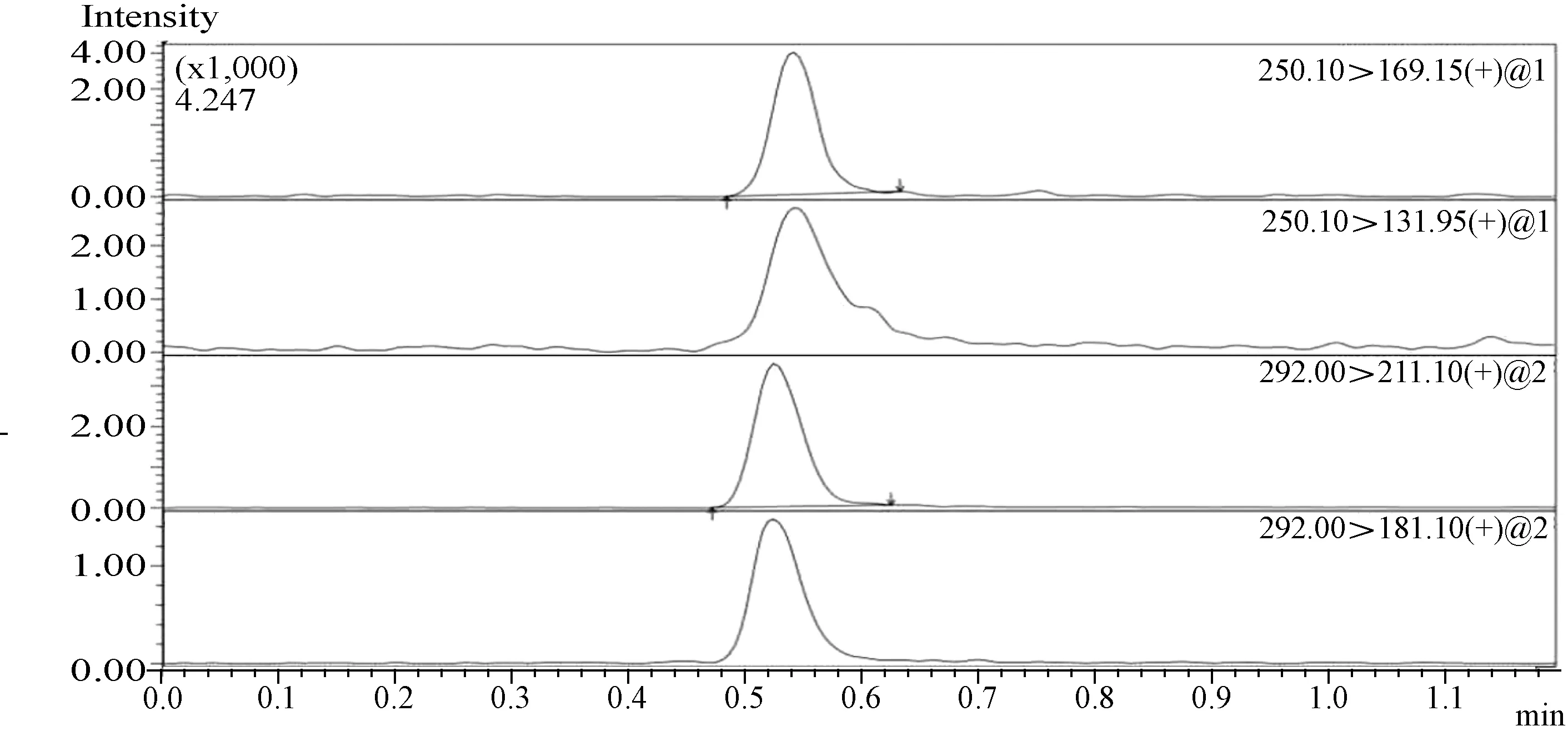
图11 噻虫嗪、噻虫胺在菌棒上的最终残留质谱图(135 g a.i./hm2,施药2次,用药10 d取样)
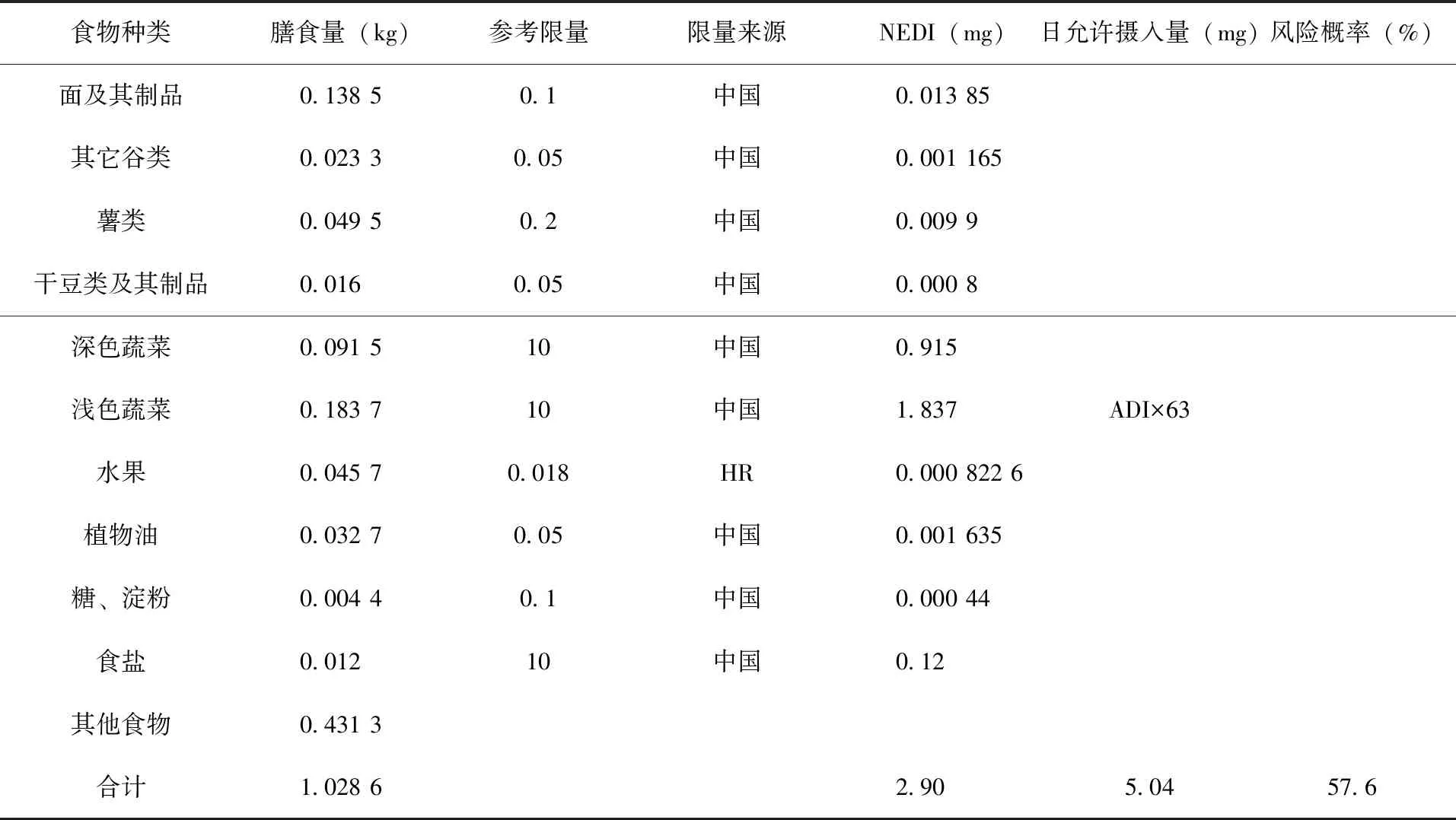
表6 噻虫嗪在所有登记作物中的长期膳食摄入风险评估结果
3 结论
建立了液相色谱-串联质谱同时测定茶树菇及其菌棒中噻虫嗪及其代谢物噻虫胺残留的分析方法,方法的准确性和精密度均达到残留分析要求。
消解动态试验结果表明,噻虫嗪在茶树菇中半衰期分别为1.77 d,属于易降解农药。由于施药方式为喷雾,噻虫嗪主要在菌棒顶端照耀,随时间推移,未见由上至下淋溶现象,主要集中在菌棒上段。噻虫胺在菌棒上段、中段和下段的残留量均<定量限。
最终残留试验结果发现,噻虫嗪残留主要集中在菌棒上段,最终残留试验中茶树菇上的残留量较菌棒中的残留量低。目前,噻虫嗪在我国暂未制定最大残留限量(maximum residue limit,MRL)标准,国际食品法典委员会、美国、日本和韩国也没有相关规定;欧盟规定噻虫嗪在真菌上MRL为0.01 mg/kg[21],本研究以30%噻虫嗪悬浮剂在90~135 g a.i./hm2条件下,施药2~3次,用药10 d后噻虫嗪在茶树菇中的残留量< 0.011 mg/kg,结果与之近似。
在实际生产中,食用菌作为小宗作物相应的登记产品较少,农户使用未登记农药意味着没有使用准则,不知该如何科学使用这些农药。缺乏管理依据,无法判定安全性,对于消费者来说是潜在的健康风险。希望有关部门及农药企业尽快完善我国农药在食用菌上的登记及限量标准的制定,为促进小宗作物合理用药、应对技术性贸易壁垒提供科学的数据支撑[22]。
